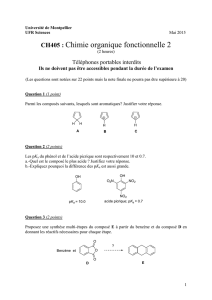
Exercice: SPECTRE RMN DE LA TETRALONE
Les signaux du spectre de résonance magnétique nucléaire du proton (enregistré à 300 MHz) de la
tétralone sont indiqués dans le tableau suivant (𝐽 désigne les constantes de couplage) :
Formule de la tétralone :
1) Indiquer, en ppm, l’écart entre deux signaux séparés par une différence de fréquence de 8 Hz à
la
fréquence de fonctionnement du spectromètre.
2) La modification de la fréquence de fonctionnement de l’instrument entraîne-t-elle une variation
des déplacements chimiques des signaux ? Pour quelle raison ?
3) Quel est l’intérêt d’une modification de la fréquence de fonctionnement d’un spectromètre
RMN ?
4) Attribuer, en justifiant votre réponse, les signaux à 8,02 ; 7,45 ; 7,28 et 7,25 ppm aux atomes
d’hydrogène de la tétralone.
5) ہ quels atomes d’hydrogène de la tétralone peut-on attribuer le signal entre 2,20 et 2,08 ppm ?
Sur ce spectre, ce signal ressemble à un quintuplet avec une constante de couplage 𝐽 = 7 Hz.
Expliquer les raisons qui font que ce signal ne peut être considéré comme un quintuplet. Pour
quelle raison apparaît-il ainsi ?
Constantes de couplage pour des protons de cycle benzénique :

Exercice 2 :
Le spectre de RMN TH du composé C fait apparaître, entre autres :
- un doublet d’intégration 3H, de déplacement chimique 𝛿 = 0,96 ppm (noté 𝑎) ;
- un singulet d’intégration 6H, de déplacement chimique 𝛿 = 1,36 ppm (noté 𝑏) ;
- un multiplet mal résolu d’intégration 1H, de déplacement chimique 𝛿 = 1,85 ppm (noté 𝑐) ;
- un multiplet mal résolu d’intégration 1H, de déplacement chimique 𝛿 = 4,12 ppm (noté 𝑑).
4) Identifier les protons correspondant à ces quatre signaux dans la molécule C.
Exercice 3 :
38 IDENTIFICATION DE STRUCTURE
A, de formule brute C.HT0O, présente une bande large et intense en IR vers 3400 cmbT. Traité par le

permanganate de potassium en milieu aqueux acide, A conduit à B, dont le spectre RMN ne
présente
aucun signal au-delà de 3 ppm.
A est chauffé en présence d’acide sulfurique concentré pour conduire à C. Traité dans les
conditions de
Lemieux-Johnson, C conduit à de l’éthanal et à D, dont le spectre RMN ne comporte qu’un unique
singulet.
Identifier A.
Exercice 3 :
39 OXYDATION PAR LE DIOXYDE DE MANGANبSE
L’oxydation du 3-méthylbut-2-én-1-ol par le dioxyde de manganèse MnO0 conduit à un unique
produit
A, de formule brute C.HSO et dont le spectre IR présente deux bandes caractéristiques à 1683 et
1623 cmbT. Le spectre RMN TH de A comporte trois signaux : un doublet intégrant pour 1H à
9,96 ppm ; un doublet intégrant pour 1H à 5,88 ppm et un singulet intégrant pour 6H à 2,1 ppm.
1) Quelles sont les fonctions du 3-méthylbut-2-én-1-ol susceptibles de s’oxyder ?
2) ہ partir des données spectroscopiques, identifier A. Commenter spécifiquement les valeurs des
bandes d’absorption IR.
3) Déterminer les nombres d’oxydation du carbone fonctionnel du 3-méthylbut-2-én-1-ol et de A.
4) ةcrire l’équation équilibrée symbolisant l’oxydation de A, sachant qu’enfin de réaction, le
manganèse est récupéré sous la forme d’ions Mn05.
5) Proposer un autre réactif qui pourrait ici remplacer MnO0. Sachant que le 3-méthylbutan-1-ol ne
réagit pas dans des conditions similaires, quelle est la chiomiosélectivité de MnO0 ?
1
/
3
100%