REVUE MÉDICALE SUISSE
732
WWW.REVMED.CH
13 avril 2016
Microbiologie et traitement
antibiotique du pied diabétique infecté
Drs MARIE-CÉLINE ZANELLAa, BENJAMIN KRESSMANNa,b, LYDIA WUARINb, BENOIT COULINb,
SOPHIE MAÎTREc, DOMIZIO SUVÀb, Pr BENJAMIN A. LIPSKYa et Dr ILKER UÇKAYa,b
Rev Med Suisse 2016; 12: 732-7
Chez le patient diabétique, l’ulcère du pied est une problématique
fréquente dont la prévalence au cours de la vie est de 25%. Une
infection complique l’ulcère dans près de 50% des cas, est asso-
ciée à une importante morbidité et à une réduction de la qualité
de vie, et est parfois le déclencheur d’une cascade menant à l’am-
putation. Les ulcères et infections surviennent dans un terrain de
polyneuropathie périphérique et d’insuffisance artérielle, impli-
quant ainsi une prise en charge multidisciplinaire. La connaissance
de la microbiologie de l’infection du pied diabétique est néces-
saire à l’administration judicieuse d’une antibiothérapie empirique
et ciblée. Cet article se concentrera sur la définition et le diagnostic
de l’infection du pied diabétique, sur les aspects principaux de sa
microbiologie et du traitement antibiotique.
Microbiology and antibiotic treatment
of diabetic foot infection
In diabetic patients, foot ulcer is a common problem which preva-
lence during life is about 25%. Infection occurs as a complication in
almost 50% of cases, is associated with significant morbidity and a
reduced quality of life and is sometimes the trigger leading to am-
putation. Ulcers and infections occur among patients with predis-
posing factors such as peripheral neuropathy and arterial insuffi-
ciency, and require a multi-disciplinary care system. The knowledge
of the microbiology of diabetic foot infection is necessary for a wise
use of empirical and targeted antibiotic therapy. This article will focus
on the definition and diagnosis of diabetic foot infection, on the
main aspects of its microbiology and antibiotic treatment.
IntroductIon – physIopathologIe
des InfectIons du pIed dIabétIque
Le diabète est associé à une proportion plus élevée de presque
tous les types d’infection chez les patients orthopédiques
comparés aux patients non diabétiques.
1
L’incidence des in
fections du pied est d’environ 4 à 15% chez les patients diabé
tiques,
2
la majorité survient dans le contexte
d’un
diabète de
longue date, et
l’ulcère
est la porte d’entrée de nombreux pa
thogènes. L’infection est le plus souvent un épiphénomène
survenant dans un terrain fragilisé par l’existence
d’une
poly
neuropathie périphérique et
d’une
artériopathie, ellesmêmes
en lien avec la durée du diabète et la qualité de l’équilibre mé
tabolique. En raison de la perte des sensations protectrices
thermoalgiques, des microtraumatismes, notamment sur des
zones d’hyperpression, peuvent créer des lésions cutanées
passant inaperçues. L’existence
d’une
polyneuropathie péri
phérique motrice augmente le risque de lésions cutanées en
contribuant à des déformations des pieds, un déplacement des
points
d’appui
et des troubles de la marche. Les atteintes micro
et macrovasculaires contribuent à l’évolution défavorable vers
l’ulcération. Une fois la barrière cutanée rompue, les tissus
sont exposés à la colonisation par des organismes potentielle
ment pathogènes et l’infection peut se manifester sous forme
d’une
dermohypodermite,
d’un
ulcère infecté et/ou
d’une
os
téomyélite.
2
L’infection du pied diabétique est souvent
l’évé
nement déclencheur de la cascade menant à l’amputation.
3
défInItIon et dIagnostIc
La définition de l’infection du pied diabétique reste complexe.
Parce que toutes les plaies ouvertes sont colonisées par des
microorganismes, la définition ne peut se faire que sur une
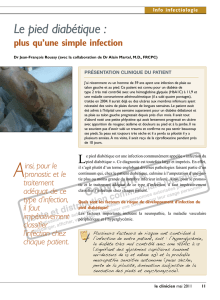
base clinique; il est nécessaire de considérer des signes clas
siques de l’inflammation: douleur, érythème, chaleur, indura
tion et purulence (
figure 1
). Les signes systémiques (fièvre,
frissons, hypotension) et les marqueurs inflammatoires (leu
cocytose, élévation de la CRP) ou la positivité des hémocul
tures ne sont pas indispensables pour le diagnostic mais sont
utiles pour stratifier la sévérité;
3
cela va de même pour les
examens radiologiques.
En présence
d’un
tableau clinique suggestif
d’une
infection ou
d’une
radiographie standard en faveur
d’une
lésion osseuse, la
mise en évidence par la culture
d’une
(ou plusieurs) espèce(s)
bactérienne(s) conforte le diagnostic et permet de cibler
fig 1
Lésions cliniques caractéristiques
d’une infection du pied diabétique:
nécrose, ulcération et purulence
a
Service des maladies infectieuses,
b
Service de chirurgie orthopédique,
c
Service
de diabétologie, HUG, 1211 Genève 14
marie-celine.zanella@hcuge.ch | benjamin.kressmann@hcuge.ch
lydia.wuarin@hcuge.ch | benoit.coulin@hcuge.ch | sophie.maitre@hcuge.ch
domizio.[email protected]h
|
dblipsky@hotmail.com
|
ilker.u[email protected]h
(Diffusion en accord avec le patient).

maladies
infectieuses
www.revmed.ch
13 avril 2016
733
l’antibiothérapie. Les échantillons envoyés en culture doivent
être issus de prélèvements tissulaires faits après débridement
profond; ceux intraopératoires restent la référence. Les
prélèvements avec des écouvillons et en surface devraient
être évités: ils augmentent le risque d’isoler des bactéries
colonisant ou contaminant la plaie et de manquer les véri
tables pathogènes. Les résultats de l’examen direct et de la
culture de prélèvements tissulaires ou de pus sont donc à
interpréter en fonction des types d’échantillons et de la si
tuation clinique.
diagnostic de l’ostéomyélite
L’ostéomyélite du pied diabétique est presque toujours la
conséquence de la propagation contiguë de
l’infection
depuis
un ulcère chronique; 20% des infections du pied diabétique
impliquent
l’os
dans leur présentation initiale.
4
Une ostéo
myélite devrait être suspectée en présence
d’un
ulcère d’évo
lution lente, de grande profondeur, ou si un orteil présente
une tuméfaction et un érythème chronique important.
L’exa
men à la sonde boutonnée est facilement réalisable et associé
à une valeur prédictive positive modérée à bonne, mais
n’est
pas la preuve absolue
d’une
ostéomyélite chronique. Sur le
plan biologique, la présence
d’un
syndrome inflammatoire est
suggestive
d’une
ostéomyélite mais
n’est
pas nécessaire au
diagnostic.
Le gold standard diagnostique reste l’examen microbiologi
que de biopsies osseuses percutanées ou de prélèvements
osseux peropératoires;
5
ceci est renforcé lorsque
c’est
associé
à la visualisation de destructions osseuses à la radiographie
standard, ou encore au prélèvement aisé
d’un
bout
d’os
fragi
lisé avec une pince (luérisation). Les cultures d’échantillons
des tissus mous adjacents à
l’os
ne sont pas suffisamment
fiables puisqu’elles ne permettent pas de prédire de manière
fiable les microorganismes retrouvés dans les cultures de
tissus osseux.
6
Sur le plan radiologique, la radiographie stan
dard a une sensibilité variant entre 28 et 75% (sa sensibilité
est médiocre en cas d’infection précoce puisque les signes
radiologiques ne sont visibles qu’après plusieurs semaines) et
une spécificité d’environ 70%. Sa sensibilité augmente avec la
réalisation de radiographies sériées, à deux semaines d’inter
valle.
L’IRM
est l’examen de choix, avec une sensibilité de
près de 80 à 90%.
7
Le CTscan est l’examen de choix lorsque
l’IRM
est contreindiquée. Il arrive que certains résultats
radiologiques soient contradictoires, comme en cas d’inflam
mation osseuse sans destruction à
l’IRM,
alors que le CTscan
ou la radiographie standard ne montrent pas de lésion osseuse:
on parle alors d’ostéomyélite radiologique, sans connaître à
l’heure actuelle les conséquences cliniques et la prise en charge
optimale de cette entité.
classIfIcatIon de la sévérIté des InfectIons
L
’I
nt
e
rnational
W
orking
Group
on
the
D
iabetic
F
oot
(IW
GDF)
et
l’I
nfectious
D
iseases
Society
of
Ame
rica
(IDS
A
)
ont
élabor
é
des recommandations pour la classification et la prise en
charge des infections du pied diabétique. L’IWGDF a développé
une classification dont les critères sont regroupés sous l’acro
nyme anglais PEDIS:
3
Perfusion, Extent, Depth
(profondeur de
la perte de tissus),
Infection, Sensation
(
tableau 1
). Elle a notam
Tableau 1
Classifications des infections du pied
diabétique selon l’IWGDF et l’IDSA
IWGDF: Groupe de travail international sur le pied diabétique; IDSA: Société
américaine d’infectiologie.
* L’infection est définie par la présence de ≥2 éléments suivants:
•
Tuméfaction ou induration locale
•
Erythème
•
Sensibilité ou douleur locale
•
Chaleur locale
•
Ecoulement purulent (épais, opaque ou sanguinolent).
** SIRS: syndrome de réponse inflammatoire systémique.
Manifestations cliniques et paracliniques
de l’infection
Stade
selon PEDIS
Sévérité
selon IDSA
Pas de symptômes ou signes d’infection*
1
Absence
d’infection
•
Infection locale impliquant uniquement la
peau ou le tissu sous-cutané (sans implication
des tissus profonds ni signes systémiques)
En cas d’érythème: >0,5 cm ou ≤2 cm autour
de l’ulcère
•
Exclusion d’autres diagnostics différentiels
d’inflammation (exemples: traumatisme, goutte,
neuro-ostéoarthropathie aiguë de Charcot,
thrombose, insuffisance veineuse, fracture)
2
Légère
Infection locale avec érythème >2 cm
ou
impliquant des structures au-delà des tissus
sous-cutanés (abcès, fascéite, ostéomyélite,
arthrite septique)
et
absence de signes de SIRS**
3
Modérée
Infection locale avec signes de SIRS**:
•
Température >38 ou <36°C
•
Fréquence cardiaque >90/min
•
Fréquence respiratoire >20/min
•
Leucocytes >12 G/L ou <4 G/L ou >10%
neutrophiles non segmentés
4
Sévère
(Adapté de réf.3).
ment été validée comme outil de prédiction des
outcomes
. La
classification proposée par
l’IDSA
(
tableau 1
) a été prospecti
vement validée comme outil de prédiction des
outcomes
en
général et du risque d’amputation des membres inférieurs
(3% en cas d’infection légère, 46% pour les formes modérées
et 70% pour une infection sévère).
3
MIcrobIologIe
Les infections communautaires légères sont surtout causées
par des coques Gram positif aérobies, en particulier
Staphylo-
coccus aureus
et, dans une moindre mesure, par des strepto
coques bêtahémolytiques (souvent du groupe B). Les infec
tions modérées à sévères et les infections de plaies trauma
tiques sont souvent polymicrobiennes, avec des coques Gram
positif
(S. aureus)
, bacilles Gram négatif
(Escherichia coli, Proteus
mirabilis, Klebsiella
spp.) et bacilles Gram négatif non fermen
tatifs
(Pseudomonas aeruginosa)
(
tableau 2
). Dans le cas de
l’ostéomyélite, l’agent causal le plus fréquent reste
S. aureus
,
seul ou comme bactérie prédominante dans une infection po
lymicrobienne.
Jusqu’à la dernière décennie, la plupart des études traitant de
la microbiologie des infections du pied diabétique ont été me
nées en Amérique du Nord et en Europe. En revanche, des
études récemment réalisées dans des régions du globe à climat
chaud (principalement en Inde, au MoyenOrient et en Afrique)
montrent que
S. aureus
est moins prévalent (30% contre 75%

REVUE MÉDICALE SUISSE
734
WWW.REVMED.CH
13 avril 2016
Tableau 2
Recommandations pour l’antibiothérapie empirique des infections du pied diabétique
Aucune évidence ne permet de confirmer qu’un traitement intraveineux (IV) est supérieur à un traitement oral. Seules exceptio ns: bactériémies, dermo/hypodermites
étendues ou antibiotique uniquement disponible sous forme intraveineuse.
* Le portage de SARM ne justifie pas forcément une antibiothérapie dirigée contre le SARM.
** En cas de signes SIRS, prélever des hémocultures.
*** Eviter si possible toute antibiothérapie empirique en cas d’ostéomyélite non amputée. Une fenêtre antibiotique est recommandée et sa durée optimale est de minimum
4 jours et au mieux 10-14 jours avant tout prélèvement pour mise en culture.
**** Durée moins longue si tout os infecté est enlevé.
SARM: Staphylococcus aureus résistant à la méticilline; SIRS: syndrome de réponse inflammatoire systémique.
Sévérité de l’infection
Pathogènes attendus
Antibiotiques proposés
Voie d’administration
Durée de traitement
Légère
•
S. aureus*
•
Streptocoques
•
Entérobactéries
•
Céphalosporines
•
Amoxicilline
•
Clindamycine
•
Amoxicilline-acide clavulanique
•
Co-trimoxazole
Per os
1-2 semaines
Modérée
•
S. aureus
•
Streptocoques
•
Entérobactéries
•
Amoxicilline-acide clavulanique
•
Association clindamycine + quinolone
Per os ou IV
1-2 semaines
Sévère
•
S. aureus
•
Streptocoques
•
Entérobactéries
•
Anaérobes
•
Pseudomonas aeruginosa
•
Pipéracilline-tazobactam
•
Céfépime
•
Carbapénème
IV puis per os
1-2 semaines
Bactériémie associée**
Le plus souvent: S. aureus
A adapter selon cultures et sensibilités
IV
1-2 semaines
Ostéomyélite***
•
S. aureus
•
Streptocoques
•
Entérobactéries
A adapter selon cultures des prélèvements
osseux
Per os
4-6 semaines (en l’absence de
résection chirurgicale) ****
(Adapté de réf.
14
).
sous nos latitudes); les infections aux entérobactéries et à
P.
aeruginosa
sont rapportées comme étant les plus fréquentes.
Parmi les hypothèses de cette variation géographique, citons
les différences épidémiologiques, la disponibilité des antibio
tiques sans ordonnance et l’utilisation des antibiotiques en
général ou encore d’autres facteurs soupçonnés et non prou
vés tels qu’un climat aride ou le lavage itératif des pieds (avec
une prévalence élevée de certains Gram négatif dans le milieu
humide tels que
P. aeruginosa
).
Les bactéries anaérobies (
Bacteroides
et
Finegoldia
) sont rare
ment identifiées, et ne sont pas associées à des signes clini
ques spécifiques ni à des manifestations plus sévères.
8
Un
essai randomisé dans lequel l’isolement des anaérobes a été
optimisé a rapporté que parmi les six groupes de bactéries
isolées, aucun
n’a
été associé à de plus mauvais
outcomes
(coques Gram positif anaérobies,
Peptostreptococcus magnus
,
Peptostreptococcus asaccharolyticus, bacilles Gram positif anaé
robies et bacilles Gram négatif anaérobies y compris
Bacte-
roides
spp.). De même, plusieurs essais randomisés confirment
des
outcomes
équivalents entre des traitements comprenant
une couverture des germes anaérobies par rapport à ceux
avec une couverture plus étroite.
9
Dans ce contexte, il semble
donc raisonnable de ne pas modifier la pratique actuelle et
donc d’ajouter une couverture antibiotique contre les anaé
robes uniquement en cas de sepsis avéré.
Concernant les champignons, les parasites et les mycobactéries,
leur relevance clinique est incertaine et ils ne sont décrits
comme agents pathogènes que dans de rares rapports de cas.
Comme dans tout le domaine orthopédique, les infections
virales osseuses ou des tissus mous n’ont pas (encore) été
décrites.
bactéries multirésistantes
La probabilité d’isoler une bactérie multirésistante (BMR) a
augmenté au niveau mondial au cours de la dernière décennie.
10
Les infections avec des souches de
S. aureus
résistant à la
méticilline (SARM), notamment communautaires, et les in
fections par des bactéries Gram négatif, productrices de bêta
lactamases à spectre élargi (BLSE) ou de carbapénémases,
sont un problème émergent et préoccupant, qui n’est pas en
soi l’objet de cet article.
11
Les recommandations de traitement
à venir pourraient tenir compte de ce changement.
Microbiome et métagénomique
Les récentes techniques moléculaires, telles que la PCR 16S et
le séquençage génétique, permettent d’identifier une plus
grande variété de bactéries, notamment les anaérobes,
12
et
ont révélé de nouvelles informations concernant la manière
avec laquelle les bactéries «s’organisent» dans les infections
du pied diabétique, en «groupes fonctionnellement patho
équivalents»: certaines espèces bactériennes qui sont géné
ralement non pathogènes peuvent se réunir de manière sym
biotique au sein
d’un
biofilm pathogène et agir en synergie
pour provoquer une infection chronique. La diversité bacté
rienne est probablement liée au développement
d’un
biofilm
microbien fixé à la matrice de la plaie. Ces techniques
n’ap
portent pas encore toutes les réponses concernant les déter
minants de cette organisation et la distinction entre orga
nismes colonisants et pathogènes. Elles ne permettent pas
encore de dire si le traitement antibiotique devrait être ciblé
sur une ou plusieurs espèces, sur certaines espèces «leaders»
ou d’autres considérées jusqu’alors comme non pathogènes.
Toutefois, ces études ouvrent la voie vers de potentiels

maladies
infectieuses
www.revmed.ch
13 avril 2016
735
•
CRP
•
Cultures des prélèvements profonds de
tissu
post-débridement/ou d’aspiration de pus
•
Examens radiologiques standards
•
Suivi par les consultations spécialisées et
considérer:
–
Une chirurgie
–
Une revascularisation
•
Soins de plaie, débridement,
antibiothérapie
selon recommandations
•
Décharge obligatoire
nouveaux paradigmes dans la compréhension de l’infection
du pied diabétique.
12,13
traIteMents
La prise en charge d’une infection du pied diabétique néces
site une approche multidisciplinaire.
2
La
figure 2
illustre un
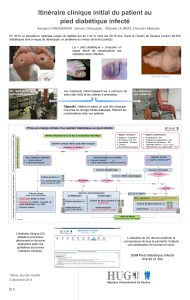
itinéraire clinique de la prise en charge des infections du pied
diabétique aux Hôpitaux universitaires de Genève.
chirurgie, revascularisation, podologie et décharge
du membre inférieur
La plupart des infections du pied diabétique nécessite une in
tervention médicale et chirurgicale avec notamment débride
ment, incision, drainage et amputation en cas d’ischémie dé
passée.
14
La chirurgie est incontournable dans le traitement des
abcès, fascéites nécrosantes et certains cas d’ostéomyélite des
tructive où elle est aussi préventive dans le cadre des modifi
cations
anat
omiques
liées
à
la
polyne
ur
opathie.
2
La
pr
ése
nce
d
’
u
n
ulcère chez un patient diabétique implique la réalisation d’un
bilan vasculaire et une proposition de revascularisation en cas
d’insuffisance artérielle. Les soins de podologie et la décharge
adéquate et constante du membre concerné sont primordiaux.
14
antibiothérapie
Antibiothérapie empirique
Dans l’attente des résultats microbiologiques, le choix de l’anti
biothérapie estdéterminé par la situation clinique, l’épidémio
logie microbienne locale et selon les recommandations des
sociétés savantes
3
(
tableau 2
). L’antibiothérapie empirique doit
assurer la couverture de
S. aureus
, le pathogène le plus fréquent
sous nos latitudes. Selon les centres, si la prévalence de SARM
communautaire estélevée, sa couverture peutêtre recomman
dée. Si l’infection est modérée à sévère ou en cas d’échec d’une
antibiothérapie à spectre étroit, le traitement doit permettre
la couverture des bactéries Gram négatif.
3
Dans les régions du
globe à climat chaud, et surtout en cas de sepsis ou d’infec
tion sévère, la couverture empirique des bactéries Gram né
gatif et éventuellement des anaérobes est primordiale.
15
Antibiothérapie ciblée
Lorsque les cultures quantitatives montrent la présence de
multiples organismes, la décision de considérer une souche
particulière comme dominante, et donc celle à traiter, dépend
de la qualité de l’échantillon et du type de microorganisme:
si l’échantillon est obtenu de manière aseptique dans des tissus
mous profonds ou au niveau osseux, la couverture des deux
ou trois espèces les plus prévalentes semble prudente. En effet,
dans la plupart des cas, il est recommandé de ne traiter que le
pathogène qui semble le plus susceptible d’être à l’origine de
l’infection tel que
S. aureus
, les streptocoques et les entéro
bactéries présents en quantité significative (
tableau 2
). Con
cernant les germes commensaux de la peau, comme les sta
phylocoques coagulase négatif, les corynebactéries ou certaines
espèces de
Bacillus
, une couverture spécifique n’est recomman
dée que si le patient est porteur au niveau du pied de matériel
d’ostéosynthèse susceptible d’être infecté.
Concernant le traitement des infections causées par des patho
gènes multirésistants, les résultats sont contradictoires, mais
il ne semble pas nécessaire d’ajuster la prise en charge stan
fig 2
Itinéraire clinique de la prise en charge intra-hospitalière d'une infection du pied diabétique
aux Hôpitaux Universitaires de Genève
Infection sévère?
Ostéomyélite?
Non
Oui
(Adaptée de réf
14
).
•
Consultation spécialisée de chirurgie
ortho-
pédique, vasculaire et d’infectiologie
•
Débuter l’antibiothérapie selon les recom-
mandations
Non
Suspicion d’infection?
Oui
Suivi par consultation spécialisée de
diabétologie:
•
Optimisation du profil glycémique
•
Nouvelle estimation du status nutritionnel
•
Planification du suivi ambulatoire
•
Soins infirmiers et podologue
•
Décharge obligatoire
•
Chaussage adapté/orthopédique
Phase 1 – Admission
Phase 2 – Pendant l’hospitalisation
Phase 3 – Préparation à la sortie
Consultation spécialisée de diabétologie:
•
Optimisation rapide du profil glycémique
•
Détermination du status nutritionnel
•
Consultation spécialisée d’angiologie: bilan
vasculaire
•
Débridement, décharge
Suivi par consultation spécialisée de
diabétologie:
•
Optimisation du profil glycémique et de
la
compliance
•
Suivi par la consultation spécialisée de
chirurgie orthopédique et/ou d’angiologie
et/ou d’infectiologie:
–
Soins de plaie, débridement, antibiothé-
rapie, revascularisation, décharge obligatoire
–
Podologie

REVUE MÉDICALE SUISSE
736
WWW.REVMED.CH
13 avril 2016
dard empirique
16
(
tableau 2
). En cas de portage de SARM hos
pitalier (au contraire du SARM communautaire), les taux de
guérison sont similaires en cas d’antibiothérapie empirique
couvrant le SARM ou non.
16
On peut s’interroger sur la pénétration des antibiotiques oraux
notamment jusqu’au tissu osseux en cas d’artériopathie sous
jacente. Pour certains antibiotiques (clindamycine, fluoroqui
nolones, linézolide, rifampicine, tétracyclines et cotrimoxa
zole), des études rapportent une biodisponibilité orale accep
table, associée à une pénétration suffisante dans la synovie et
dans
l’os,
étonnammentmême enprésence d’une macroangio
pathie ischémique.
17
Concernant les bêtalactames en adminis
tration orale, les concentrations tissulaires peuvent parfois
être basses.
Une revue systématique de la littérature réalisée par
l’IWGDF
(douze études randomisées contrôlées, retenues pour
l’ana
lyse) conclut
qu’aucun
antibiotique
n’est
supérieur aux autres
pour les infections du pied diabétique.
14,17,18
Finalement, au
cune étude
n’a
clairement montré la supériorité des agents
bactéricides par rapport aux bactériostatiques, ni la supériorité
d’une voie d’administration ou d’une durée d’antibiothérapie.17,18
Cas particulier de l’ostéomyélite
La durée optimale du traitement de l’ostéomyélite du pied
diabétique non amputé
n’est
pas connue avec certitude. Un
traitement de 46 semaines, associé à une intervention chirur
gicale (débridement et résection des tissus mous et osseux in
fectés ou nécrotiques), est recommandé.
3
Pourtant, certaines
études rapportent des taux de guérison atteignant parfois 60
70% en l’absence de traitement chirurgical. En fonction de la
situation clinique, si une chirurgie
n’est
pas envisageable ou
n’est
pas souhaitée par le patient, en l’absence d’ischémie cri
tique
ou
d’alt
é
r
ations
anat
omiques
fa
vorisant
l’h
ype
r
appui,
un traitement antibiotique seul peut être raisonnablement
effectué dans un premier temps; ceci tout en informant le pa
tient
qu’il n’y
a pas de garantie claire de guérison (ce qui est
cependant aussi valable pour l’approche chirurgicale, notam
ment en cas d’ischémie compromettante associée).
conclusIon
Les infections du pied diabétique sont un problème fréquent,
associé à une importante morbidité et dont la prise en charge
est multidisciplinaire.
2
La recherche clinique et dans le domaine
de la microbiologie a permis d’améliorer notre compréhension
de la pathophysiologie des infections du pied diabétique et
aut
orise
r
a
à
l’a
ve
nir
des
tr
ait
eme
nts
da
vantage
ciblés
.
P
our
l’antibiothérapie empirique, le choix doit être basé sur
l’his
toire du patient, la sévérité de la situation clinique et
l’épidé
miologie microbienne locale; pour les infections légères à
modérées, l’antibiothérapie empirique doit assurer la couver
ture pour
S. aureus
, les streptocoques et entérobactéries, et
doit être étendue pour les infections sévères à la couverture
des Gram négatif. Pour l’antibiothérapie ciblée, l’antibiotique
est choisi en fonction des résultats des cultures, en tenant
compte de la qualité des prélèvements. La littérature à dispo
sition ne permet pas de faire ressortir une classe d’antibio
tique, une voie d’administration ou une durée de traitement
idéale; les recommandations des sociétés comme
l’IDSA
font
donc encore référence. La prise en charge de l’ostéomyélite
destructive ou ischémique du pied diabétique associe inter
vention chirurgicale et antibiothérapie, bien qu’aucune étude
n’ait
permis de conclure que cette prise en charge était dans
tous les cas supérieure à une antibiothérapie seule. Finalement,
rappelons que toute infection du pied diabétique risque de
progresser et/ou récidiver si certaines conditions (l’hyperap
pui,
le
mauvais
équilibr
e
glycé
mique,
le
tabagisme,
l’h
ype
rt
e
n
sion, le respect des techniques de décharge, le chaussage adé
quat, le bon soin des plaies et le suivi podologique) ne sont pas
respectées ou corrigées, et ceci tout au long de la vie du patient.
Remerciements: Les auteurs remercient M. Christophe Paoli (podologie), M. Alain
Lacraz (physiothérapie prothétique) et M
me
Michelle Le Braz (Itinéraires cliniques)
ainsi que les équipes des Services de diabétologie, d’orthopédie et du Laboratoire
de bactériologie des HUG.
Conflit d’intérêts: Les auteurs n’ont déclaré aucun conflit d’intérêts en relation
avec cet article.
1
al-Mayahi M, cian a, Kressmann b, et
al. associations of diabetes mellitus with
orthopaedic infections. Infect dis (lond)
2016;48:70-3.
2
darbellay p, uçkay I, dominguez d, et
al. traitement du pied diabétique infecté:
une approche multidisciplinaire par ex-
cellence. rev Med suisse 2011;7:894-7.
3
** lipsky ba, berendt ar, cornia pb,
et al. 2012 Infectious diseases society of
america clinical practice guideline for the
diagnosis and treatment of diabetic foot
infections. clin Infect dis 2012;54:132-73.
4
n
ewman
l
g
,
W
aller
J
,
palestro
c
J
,
et
al. unsuspected osteomyelitis in diabetic
foot ulcers. diagnosis and monitoring by
leukocyte scanning with indium in 111
oxyquinoline. JaMa 1991;266:1246-51.
5
lipsky ba, peters eJ, senneville e, et
al. expert opinion on the management of
infections in the diabetic foot. diabetes
Metab res rev 2012;28:163-78.
6
senneville e, Morant h, descamps d,
et al. needle puncture and transcutaneous
bone biopsy cultures are inconsistent in
patients with diabetes and suspected
osteomyelitis of the foot. clin Infect dis
2009;48:888-93.
7
dinh Mt, abad cl, safdar n. diagnostic
accuracy of the physical examination and
imaging tests for osteomyelitis underlying
diabetic foot ulcers: Meta-analysis. clin
implicaTions praTiques
Les infections du pied diabétique sont un problème fréquent,
associé à une importante morbidité et dont la prise en charge est
multidisciplinaire
Il faut distinguer l’antibiothérapie empirique, qui doit assurer la
couverture des pathogènes les plus fréquents en fonction de
l’épidémiologie microbiologique locale, de la sévérité de la situation
clinique et des antécédents de traitements antibiotiques, et
l’antibiothérapie ciblée, qui doit être adaptée aux résultats des
cultures de prélèvements tissulaires
Les pathogènes les plus fréquemment responsables des infections
du pied diabétique non sévères sont Staphylococcus aureus, les
streptocoques et les entérobactéries
Chez les patients avec une infection sévère, l’antibiothérapie
doit être élargie pour assurer la couverture des bactéries Gram
négatif
La littérature à disposition ne permet pas de faire ressortir une
classe d’antibiotique, une voie d’administration ou une durée de
traitement idéale; les recommandations des sociétés comme
l’IDSA (Infectious Diseases Society of America) font donc pour le
moment référence
 6
6
1
/
6
100%