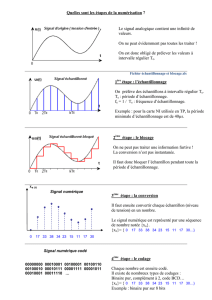
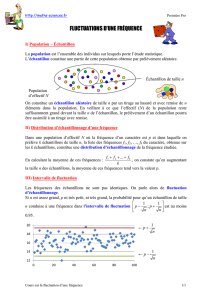
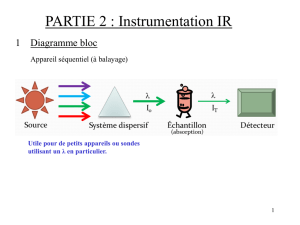
Stratégies d'échantillonnage en biologie des populations
Telechargé par
ahlam Ali Ahmed

i
UNIVERSITE CHEIKH ANTA DIOP DE DAKAR
FACULTE DES SCIENCES ET TECHNIQUES
Département de Biologie Animale
Année : 2017-2018
STRATIGIES
D’ECHANTILLONNAGE EN
BIOLOGIE DES POPULATIONS
Sous la supervision du
Pr Pape Mbacké
SEMBENE
Présenté par :
BA Mariama Diouldé
DIOP Mame Matar
ILHAM Ali Ahmed
KA Ndoumbé
MENDES Marie
RAHMA Hassane Rambou
SOW Kalidou
THIAW Alphonse Birame

i
TABLE DES MATIERES:
INTRODUCTION ------------------------------------------------------------------------------------------------------ 1
I. BIOLOGIE DES POPULATIONS ------------------------------------------------------------------------ 1
I.1) NOTION DE BIOLOGIE DES POPULATIONS ---------------------------------------------- 1
I.1.1) La dynamique des populations -------------------------------------------------------------------- 2
I.1.2) La génétique des populations ----------------------------------------------------------------------- 2
I.2) NOTION DE POPULATION ---------------------------------------------------------------------- 3
I.2.1) Populations ouvertes ----------------------------------------------------------------------------------- 3
I.2.2) Populations fermées ----------------------------------------------------------------------------------- 3
I.2.3) Population en échantillonnage ---------------------------------------------------------------------- 3
I.2.3.1) Population statistique ---------------------------------------------------------------------------------- 3
I.2.3.2) Population cible ----------------------------------------------------------------------------------------- 3
II. STRATEGIES D’ECHANTILLONNAGES ----------------------------------------------------------- 4
II.1) NOTION D’ECHANTILLONNAGE ---------------------------------------------------------- 4
II.1.1) Définitions ---------------------------------------------------------------------------------------------- 4
II.1.1.1) Echantillonnage ------------------------------------------------------------------------------------------ 4
II.1.1.2) Echantillon ----------------------------------------------------------------------------------------------- 4
II.2) Les objectifs de l’échantillonnage ------------------------------------------------------------------------ 5
II.3) Les modalités de l’échantillonnage ------------------------------------------------------------------------ 5
II.3.1) Déterminer la population cible ------------------------------------------------------------------------- 5
II.3.2) Choisir le plan d’échantillonnage ---------------------------------------------------------------------- 5
II.3.3) Définir la taille de l’échantillon ------------------------------------------------------------------------- 6
II.3.4) Définir la taille des unités d’échantillonnage -------------------------------------------------------- 6
II.3.5) Définir le nombre d'échantillon -----------------------------------------------------------------------6
II.3.6) Positionner les échantillons-----------------------------------------------------------------------------6
II.3.7) Prévoir la durée de l'étude-----------------------------------------------------------------------------7
II.3.8) Choisir la méthode d'échantillonnage appropriée -----------------------------------------------7
II.4) Paramètres d’une distribution ---------------------------------------------------------------------------- 7
II.4.1) Paramètres de position----------------------------------------------------------------------------------- 7
II.4.2) Paramètres de dispersion -------------------------------------------------------------------------------- 7
II.5) Utilisation du GPS dans l’échantillonnage----------------------------------------------------------- 8

ii
III. METHODES D’ECHANTILLONNAGES ----------------------------------------------------------- 9
III.1) METHODES PROBABILISTES (ALEATOIRES) ------------------------------------------- 9
III.1.1) Echantillonnage aléatoire simple (EAS) -------------------------------------------------------------- 9
III.1.2) Echantillonnage systématique ---------------------------------------------------------------------- 12
III.1.3) Echantillonnage stratifié ------------------------------------------------------------------------------ 15
III.1.4) Echantillonnage en grappes (par degrés) -------------------------------------------------------- 17
III.2.5) Echantillonnage à plusieurs degrés ---------------------------------------------------------------- 19
III.2.6) Echantillonnage à plusieurs phases ---------------------------------------------------------- 19
III.2) METHODES NON PROBABILISTES (EMPIRIQUES OU RAISONNEES) -------- 20
III.2.1) Echantillonnage par quotas -------------------------------------------------------------------------- 20
III.2.2) Echantillonnage de convenance (de commodité) ---------------------------------------------- 21
III.2.3) Echantillonnage selon le jugement ---------------------------------------------------------------- 21
III.2.4) Echantillonnage volontaire -------------------------------------------------------------------------- 22
III.2.5) Echantillonnage accidentel (à l’aveuglette) ------------------------------------------------------ 22
IV. LES TECHNIQUES DE PRELEVEMENT -------------------------------------------------------------- 23
IV.1) TECHNIQUE DE PRELEVEMENT EN MILIEU TERRESTRE ------------------------ 23
IV.1.1) Prélèvement des échantillons de sol à l’aide d’une tarière ---------------------------------- 23
IV.1.2) La technique de la berlèse---------------------------------------------------------------------------24
IV.1.3) Le parapluie japonais -------------------------------------------------------------------------------25
IV.1.4) Les pièges au sol --------------------------------------------------------------------------------------- 26
IV.2) TECHNIQUE DE PRELEVEMENT EN MILIEU AQUATIQUE ----------------------- 28
IV.2.1) La pêche à la roténone (également appelée nivrée) ------------------------------------------- 28
IV.2.2) Piège à Filet Surber ------------------------------------------------------------------------------------- 29
IV.3) TECHNIQUE DE PRELEVEMENT EN MILIEU AERIENNE ------------------------- 30
IV.3.1) Piège malaise -------------------------------------------------------------------------------------------- 30
IV.3.2) Pièges lumineux --------------------------------------------------------------------------------------- 31
IV.3.3) Pièges à phéromones -------------------------------------------------------------------------------- 32
IV.4) TECHNIQUE DE PRELEVEMENT MIXTE ------------------------------------------------- 33
IV.4.1) Technique des quadrats ------------------------------------------------------------------------------- 33
IV.4.2) Cages d’émergences ----------------------------------------------------------------------------------- 33
IV.4.3) Technique de Capture- Marquage- Recapture (CMR) ----------------------------------------- 34
IV.5) QUELQUES EXEMPLES DE TECHNIQUES DE PRELEVEMENT MEDICAL--------------------36

iii
V. ERREURS DE L'ECHANTILLONNAGE------------------------------------------------------------38
V.1) DEFINITION-------------------------------------------------------------------------------------------38
V.2) DIFFERENTS TYPES D'ERREUR---------------------------------------------------------------39
CONCLUSION----------------------------------------------------------------------------------------------------40
REFERENCES BIBLIOGRAPHIQUES--------------------------------------------------------------------41

1
INTRODUCTION
La population est définie comme un ensemble d’individu appartenant à la même espèce
susceptible de se reproduire entre eux, occupant une aire géographique commune en un
moment donné et jouant un rôle particulier dans un même écosystème.
La science qui permet d’étudier la population est la biologie des populations. Cette notion de
biologie de population a pour précurseur l’économiste anglais Malthus avec sa publication :
« l’essai sur le principe de la population » en 1798, exposant quelques directions d’étude de la
population humaine. Pour son travail sur l’évolution de l’espèce vivante, Charles Darwin
s’inspira des idées sociologiques de Malthus qu’il transféra au monde animal et végétal.
La biologie des populations des organismes vivants est un champ d’étude ayant comme
disciplines de base la dynamique des populations qui s’intéresse aux variations d’abondance
des populations et la génétique des populations qui utilise la variabilité spatio-temporelle des
marqueurs génétiques afin de caractériser les populations. Cependant, il est pratiquement
impossible de mettre la main sur l’ensemble des individus d’une population d’où la nécessité
de faire recours à l’échantillonnage qui résulte de l’impossibilité de collecter des données sur
tous les éléments d’une population ou d’une surface, souvent pour des raisons pratiques,
techniques ou économiques.
I. BIOLOGIE DES POPULATIONS
I.1 NOTION DE BIOLOGIE DES POPULATIONS
La biologie des populations s’intéresse aux caractéristiques collectives des individus
organisés en population et à l’évolution de ces caractéristiques:
abondance et variation de l’abondance dans le temps ou dans l’espace;
phénomènes démographiques par lesquels une population se renouvelle et rendent
compte des variations d’abondance;
structure démographique qui sanctionne le comportement démographique passé et
annonce celui à venir;
structure allélique et génotypique, polymorphisme et variabilité génétique,
hétérozygotie, etc.., dont l’évolution au cours du temps peut modifier les performances
démographiques et par la suite le devenir à long terme des populations ;
structure sociale qui décrit l’organisation des populations animales en unités sociales
dans lesquelles les individus ont des rôles et des positions hiérarchiques différentes, en
particulier au plan de reproduction.
Les deux disciplines fondatrices de la biologie des populations sont la dynamique des
populations, dont les concepts et les méthodes sont empruntés à la démographie humaine et
écologique, et la génétique des populations, elle-même représentée par deux traditions, l’une
mathématique, l’autre expérimentale.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
1
/
48
100%