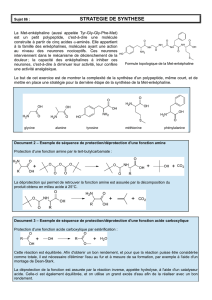
CHAPITRE II : HETEROCYCLES
Introduction
Un très grand nombre de composés, naturels ou synthétiques, renferment des squelettes
cycliques, comportant un ou plusieurs hétéroatomes (atomes autres que le carbone). Ces composés
sont dits hétérocycliques et peuvent être divisés en deux classes : ceux qui sont aromatiques et ceux
qui ne le sont pas.
Les composés hétérocycliques non aromatiques ne se distinguent pas en général des composés
non cycliques et renferment les mêmes fonctions. Ainsi, le diéthyléther et le tétrahydrofuranne ont
des propriétés chimiques voisines.
En chimie organique, la classification des molécules est basée sur le nombre et la diversité des
atomes qui les composent, mais aussi sur les différents types de liaisons qui constituent leur
structure. Dans le cas où les atomes forment une chaine, les composés correspondants sont dits
acycliques. Au contraire, si l'enchainement des atomes forme un cycle, on dira qu'il s'agit de
composés cycliques. Si le cycle est entièrement composé d'atomes de carbone, il s'agit de
carbocycle.
D'une manière générale, si le cycle est entièrement constitué d'un seul type d'atome, carbone
ou autre, on ajoute le préfixe iso, composés isocycliques. Un cycle qui est constitué d'au moins
deux types d'atomes est un hétérocycle. II existe deux groupes d'hétérocycles :
- ceux qui contiennent un ou des atomes de carbone liés à un ou plusieurs autres éléments
comme l'oxygène, le soufre, l'azote...appelés hétéroéléments ou hétéroatomes et qui sont les
composés hétérocycliques organiques ;
- et ceux qui ne contiennent pas d'atome de carbone et qui sont les hétérocycles inorganiques
ou minéraux, lesquels ne sont pas traités dans ce cours.
I. Caractère aromatique
Le caractère aromatique n’est pas limité aux hydrocarbures benzéniques. Hückel a défini une
règle très générale : est aromatique toute structure possédant 4n+2 électrons délocalisés. Dans le
cas d’une structure à 6 électrons (la plus fréquente), les 6 électrons peuvent provenir de liaisons
π, de doublet non liant ou d’une charge négative. Ainsi, les trois hydrocarbures ci-après sont
donc aromatiques, ils possèdent 6 électrons et, comme le montrent les flèches, ces six électrons
sont délocalisés sur l’ensemble du cycle.

Un système à 6 électrons délocalisés est également possible avec les hétérocycles insaturés. Les
6 électrons sont, selon le cas, apportés par trois liaisons π (pyridine) ou par deux liaisons π et un
doublet non liant (hétérocycle à cinq chaînons)
II. NOMENCLATURE
La nomenclature des hétérocycles est régie par des conventions internationales définies par la
commission de I'lUPAC, International Union of Pure and Applied Chemistry. Elles permettent aux
chimistes de tous pays de retrouver la formule d'une molécule à partir de sa dénomination. C'est très
utile pour la rédaction de publications de recherche et de dépôt de brevets, à caractère international.
Deux principaux types de régies IUPAC sont utilisées : celles de Hantzsch-Widman et celles dites
de remplacement.
I.1. Nomenclature de remplacement
Dans cette nomenclature, on considère que l'hétérocycle est formé par remplacement par un
ou plusieurs hétéroéléments d'un ou plusieurs atomes de carbone d'un système cyclique carbone.
Devant le nom du cycle carbone, on écrit d'abord le préfixe ou les préfixes correspondants aux
hétéroatomes figurant dans l'hétérocycle selon les préséances déjà indiquées, et la position ou les
positions respectives de l'hétéroélément ou des hétéroéléments suivie(s) d'un tiret.
A chaque hétéroatome est attribué un préfixe. Ces préfixes sont ordonnés selon une
convention pour la dénomination d'un hétérocycle. Dans le tableau 1 sont indiqués les préfixes et
leur ordre relatif (préséances des atomes O > S > Se > N...).
Hétéroéléments
Préfixes
Hétéroéléments
Préfixes
oxygène (O)
soufre (S)
selenium (Se)
azote (N)
phosphore (P)
arsenic (As)
antimoine (Sb)
oxa
thia
selena
aza
phospha
arsa
stiba
bismuth (Bi)
silicium (Si)
germanium (Ge)
etain (Sn)
plomb (Pb)
bore (B)
mercure (Hg)
bisma
sila
germa
stanna
plomba
bora
mercura

I.2. Règles de nomenclature de Hantzsch-Widman
Les règles de nomenclature selon Hantzsch-Widman s'appliquent à de nombreux composés et
en particulier aux hétérocycles dont le nombre d'atomes du cycle est compris entre trois et dix. Pour
les hétérocycles dont le nombre d'atomes cycliques est supérieur à 10, plus rares, une autre
nomenclature a été proposée. Cette nomenclature est basée sur les hétérocycles les plus insaturés
possibles. Dans cette nomenclature, le nom comporte nécessairement un préfixe (ou plusieurs)
indiquant le nom de l’hétéroatome concerné (oxa, aza, …) et un suffixe indiquant la taille et la
saturation du cycle (Tableau 2).
Nombre de
chainons du
cycle
Nombre
maximium de
doubles
liaisons
compatibles
Cycles azotés
Cycles non azotés
Composé le
plus insaturé
Composé
saturé
Composé le
plus insaturé
Composé
saturé
3
1
irine
iridine
irène
iranne
4
2
ète
étidine
ète
étanne
5
2
ole
olidine
ole
olanne
6
3
ine
**
inne
anne
7
3
épine
**
épinne
épanne
8
4
ocine
**
ocinne
ocanne
9
4
onine
**
oninne
onanne
10
5
écine
**
écinne
écanne
** Mettre per hydro devant le préfixe
Monocycles comportant plusieurs hétéroatomes de natures différentes
Les monocycles comportant plusieurs hétéroatomes de natures différentes sont nommés en
fonction de la préséance des préfixes de chaque hétéroélément et du nombre de chacun d’eux (di,
tri…). La position 1 revient à celui qui a la préséance supérieure par rapport aux autres (O > S > N
…). L’hétéroélément de plus faible préséance donne son nom à l’hétérocycle. Exemples

Position d’un hydrogène pour certains isomères structuraux
Lorsque plusieurs isomères ont pour différence entre eux la position d’un hydrogène dans le
cycle, celle-ci est indiquée par un « H » en italique précédé de la position de l’atome auquel il est
lié, celle-ci étant la plus faible si plusieurs positions existent.
III. HETEROCYCLES PENTAGONAUX A UN ATOME
II.1. Hétérocycles saturés
Les saturés ne sont pas les plus importants, leur comportement est celui des fonctions simples.
O
Tetrahydrothiophène
sN
H
Tetrahydrofurane Pyrrolidine
II.2. Hétérocycles aromatiques à un hétéroatome
Les insaturés sont très fréquents dans les composés naturels. On distingue :
s
Thiophène Furane
Se
Sélénophène
O
Pyrrole
H
N
II.2.1. Méthodes d’obtention
La méthode la plus simple et la plus utilisée est celle initiée par PAAL-KNORR. Elle consiste
en la condensation de δ-dicétones avec des réactifs nucléophiles générateurs d’hétéroatome

oxygéné, soufré ou azoté. Elle conduit respectivement à l’obtention de dérivé furanique,
thiophénique et pyrrolique.
R2
R1
O
O
O
S
N
H
R2R1
R1
R2
R2R1
Dérivé furanique
Dérivé thiophénique
Dérivé pyrrolique
P2O5 ou H2SO4
P2S5
NH3
II.2.2. Propriétés chimiques
Deux propriétés sont reconnues à ces composés :
II.2.2.1. Caractère nucléophilie
Ces hétérocycles sont aromatiques du fait de la participation du doublet de l’hétéroatome aux
mouvements électroniques. Les formes limites issues de ces mouvements montrent que tous les
sommets sont électro-excédentaires donc nucléophiles. Ils peuvent par conséquent être le siège de
réaction électrophile. Cependant en pratique, on constate que seuls les sommets en 2 et 5 participent
aux attaques électrophiles.
ZS.Ear
S.Ear
Z = O, S, NH
II.2.2.2. Caractère oxydant
Ces hétérocycles peuvent être réduit partiellement ou entièrement en présence de dihydrogène
et de catalyseur métallique.
II.2.3. Réactivité
II.2.3.1. Réactivité du furane
a. Réaction de substitution électrophile
Elles sont limitées par l’instabilité du furane en milieu acide. Cependant, on peut faire les
réactions de : sulfonation, nitration, acylation, halogénation, formylation…..
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
1
/
29
100%