Index Glycémique : Utilité Pratique et Impact Métabolique
Telechargé par
Youssef Elouafi

Cah. Nutr. Diét., 41, 4, 2006 247
nutrition appliquée
nutrition appliquée
L’INDEX GLYCÉMIQUE
EST-IL UTILISABLE EN PRATIQUE ?
Marie PIGEYRE, Monique ROMON
En 1981, Jenkins a proposé l’index glycémique (IG) comme base physiologique
pour classer les aliments contenant des hydrates de carbone [1]. Selon ce sys-
tème, les différents aliments sont assignés à des valeurs en fonction de leur
réponse glycémique. Ce concept est une extension de l’hypothèse de Burkitt et
Trowell, suggérant que la consommation de fibres réduit le taux d’afflux des
nutriments dans l’intestin qui sont donc absorbés plus lentement et auraient
des avantages métaboliques sur le diabète et les maladies cardio-vasculaires [2].
Les recommandations diététiques habituelles soulignent la quantité plutôt
que la qualité des glucides, malgré le fait que les sources et la nature des
glucides influencent profondément la glycémie post-prandiale. Plusieurs études
ont démontré que l’index et la charge glycémique d’un régime, et non la
quantité totale de glucides, sont indépendamment liés au risque de dévelop-
per un diabète de type 2, une maladie cardio-vasculaire et certains cancers.
The American Diabetes Association reconnaît que l’utilisation des aliments à
index glycémique bas réduit l’hyperglycémie post-prandiale. Toutefois, il n’y
a pas de preuves suffisantes sur les bénéfices à long terme pour recommander
leur utilisation en première intention. Au contraire, l’European Association
for the Study of Diabetes recommande de remplacer les aliments à index
glycémique élevé par des aliments à index glycémique bas. Actuellement,
l’impact de l’utilisation de l’index glycémique des aliments demeure toujours
controversé.
Pour comprendre
L’index glycémique (IG) est calculé par le rapport de l’aire
sous la courbe de la glycémie après la consommation de
50 g d’hydrate de carbone d’un aliment-test et l’aire sous la
courbe après consommation d’une quantité semblable d’un
aliment-témoin, glucose ou pain blanc pendant deux heures.
Il s’exprime en pourcentage de la norme [3]. L’IG étant
mesuré individuellement pour chaque aliment, la capacité
de prévoir les réponses glycémiques des repas variés a dû
être discutée à partir des IG des aliments constitutifs. Ainsi,
le concept de charge glycémique (CG) a été proposé
comme méthode pour caractériser l’effet glycémique des
repas. La CG est calculée par le produit de l’IG et la quan-
tité d’hydrate de carbone apportée dans le repas (IG X g
hydrate de carbone) [4].
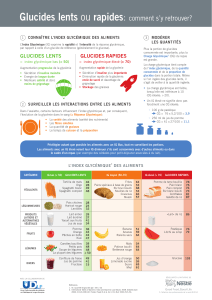
La classification résultante de l’index glycémique des ali-
ments fournit donc une classification physiologique des
aliments (tableau 1) [5].
Mécanismes physiologiques
L’index glycémique traduit la vitesse d’absorption des glu-
cides par l’intestin grêle, et c’est celle-ci qui explique les
effets métaboliques observés [6].
Service de Nutrition, CHU, 59045 Lille, France.
Correspondance : M. Romon, à l’adresse ci-dessus.
Email : [email protected]

248 Cah. Nutr. Diét., 41, 4, 2006
nutrition appliquée
Le ralentissement d’absorption du glucose après consom-
mation de glucides à IG bas réduit l’élévation glycémique
post-prandiale maximale et donc l’élévation post-pran-
diale de l’insuline et des hormones intestinales, ce qui
favorise l’oxydation des acides gras libres [7]. À long
terme, la réduction des concentrations d’AGL améliore
l’insulino-sensibilité.
De plus, la consommation d’un repas à IG bas améliore
la tolérance glucidique du second repas, en abaissant les
concentrations d’AGL (effet rémanent de Staub-Traugott)
[8].
Par conséquent, la consommation d’un régime riche en
hydrate de carbone à IG élevé produit une hyperglycémie
et une hyper-insulinémie post-prandiales récurrentes qui
sont d’autant plus accentuées chez les personnes insulino-
résistantes. L’oxydation du glucose est plus élevée et
l’oxydation des AG est moindre tout au long de la période
post-prandiale, favorisant ainsi le stockage des lipides.
Ceci s’explique par une élévation de l’expression et de
l’activité du complexe enzymatique de synthèse des acides
gras dans le tissu adipeux parallèlement à l’augmentation
de l’entrée du glucose dans les adipocytes. La lipogénèse
augmente également dans le foie par modification de
l’expression des gènes des enzymes de la lipogénèse
hépatique. À ces effets aigus sur l’oxydation du substrat
énergétique, s’ajoutent, lors d’une alimentation à IG élevé
au long cours, des changements d’expression de ces
enzymes, diminuant de ce fait le potentiel d’oxydation
hépatique des lipides [9]. Un autre mécanisme a été sug-
géré pour expliquer l’insulino-résistance lors d’alimenta-
tion à index glycémique élevé, la déplétion en chrome, la
tyrosine-phosphatase du récepteur d’insuline étant activée
par le chrome. La consommation d’hydrates de carbone
sous forme de boissons est responsable de pics hyper-
glycémiques importants, qui augmentent les pertes urinai-
res de chrome [10]. La consommation fréquente de repas
à IG élevé pourrait causer un épuisement progressif des
concentrations en chrome tissulaire.
Ces résultats ont des implications importantes parce qu’ils
défient la prétention qu’une calorie est une calorie. Bien
que cela demeure incertain, la consommation au long
cours de repas à IG élevé favoriserait une accumulation
des graisses dans les viscères.
À l’inverse, les régimes à IG bas diminuent la masse
grasse abdominale, de façon corrélée, semble-t-il, à une
diminution d’expression du gène de la leptine dans le tissu
adipeux sous-cutané [11].
Conséquences sur le métabolisme glucido-lipidique
La consommation de repas à CG réduite, en améliorant
l’insulino-sensibilité, permet une augmentation de la cap-
tation du glucose par le muscle, une augmentation de
l’épuration des chylomicrons et une réduction de la syn-
thèse des particules VLDL, des particules LDL petites et
denses et une augmentation des particules HDL.
Inversement, la consommation d’aliments à IG élevé aug-
mente les triglycérides et entraîne des modifications défavo-
Tableau 1.
Index glycémique de quelques aliments.
Index glycémique Aliments
110 Maltose (bière)
100 Glucose
95 Pommes cuites au four ou frites – Galettes de riz soufflé
90 Purée de pomme de terre – Riz instantané – Miel
85 Carottes cuites – Corn-flakes, Pop-corn – Farine T45 (pain très blanc baguette) – Gâteau de riz
80 Fèves – Pain suédois – Crackers – Pain d’épices
75 Potiron, Citrouille – Farine T55 (baguette) – Weetabix, Chocopops – Pastèque
70 Croissant, petit pain au lait – Gnocchi – Pain de campagne (farine blanche T65) – Céréales sucrées – Barres cho-
colatées (type Mars) – Pomme de terre bouillie (sans peau) – Riz blanc précuit incollable – Maïs – Navets – Maïzena,
Tacos – Soda sucré, Coca, Pepsi classiques – Sucre de canne ou de betterave (saccharose)
65 Pommes de terre cuites à l’eau dans leur peau – Semoule raffinée (couscous, taboulé) – Betterave – Barre de céréales
– Banane, melon, ananas – Raisins secs – Confiture classique 50 % sucre – Fruit au sirop – Jus d’orange industriel
60 Riz long cuit en 15 min – Cookies – Papaye – Chips
55 Biscuit sec type « Petit beurre » – Biscuits sablés – Muesli non toasté, Spécial K – Kiwi
50 Pain complet (farine T150) – Sarrazin, Flocons d’avoine – Chocolat – Muffin aux pommes – Riz brun complet –
Petits pois en conserve – Patate douce, carottes crues – Mangue – Pâtes blanches bien cuites – Sorbets – Riz blancs
riches en Amylose (Basmati)
45 Muesli toasté – Pain au son – Boulgour entier – Grains de blé dur entier précuit (Ebly) – Petits pois frais – Raisin
40 Jus d’orange frais – Jus de pomme nature – Pain de seigle complet – Pâtes complètes (farine T150) – Haricots
rouges
35 Pain intégral – Pâtes (spaghetti) cuites al dente – Vermicelles chinois – Bâtonnet de poisson – Pois secs – Yogourt
– Orange, pomme, poire, abricots secs, figues
30 Pâtes intégrales – Lait – All-bran (céréales) – Pêches – Lait chocolaté non sucré – Haricots secs, haricots de Soissons
– Haricots beurre, haricots verts – Lentilles brunes, Pois chiches – Marmelade aux fruits (sans sucre ajouté)
22 Prune – Lentilles vertes, Pois cassés – Cerises, pamplemousse
20 Fructose
15 Grains de soja – Abricot
10 Légumes verts – Salades – Tomates, aubergines, poivrons – Ail, oignons, Champignons, etc.

Cah. Nutr. Diét., 41, 4, 2006 249
nutrition appliquée
rables des profils lipidiques et fibrinolytiques, contribuant
ainsi au processus athérosclérotique [12].
Conséquences sur la satiété
Lors de la consommation d’un repas à index glycémique
bas, la satiété est prolongée, car la stimulation prolongée
des récepteurs des nutriments de l’appareil gastro-intestinal
entraîne une rétroaction prolongée, via la cholecystoki-
nine et le glucagon-like peptide 1 au niveau des centres
nerveux de la satiété [13].
À l’inverse, un repas à index glycémique élevé favorise
une chute rapide de la glycémie qui déclenche la sensation
de faim [14].
Conséquences sur les processus inflammatoires
Actuellement, les nouvelles perspectives de recherche
tentent de mettre en évidence des relations entre l’insu-
lino-résistance et la formation d’anti-oxydants, respon-
sable des dommages tissulaires, et de la libération des
cytokines pro-inflammatoires. Des études ont prouvé que
l’élévation post-prandiale de la glycémie permettait de
diminuer proportionnellement la concentration plasma-
tique des antioxydants (lycopène et la vitamine E), suggé-
rant donc un rôle bénéfique possible des régimes à faible IG
sur les dommages tissulaires [15].
Les études de cas-témoins ont également montré des
associations positives entre l’index glycémique et le risque
de survenue d’un cancer – du colon, du sein, de l’ovaire
et de la prostate – impliquant l’insulino-résistance et l’IGF
[16].
Index glycémique et obésité
Il existe une controverse sur l’intérêt des régimes pauvres
en glucides par rapport aux régimes pauvres en graisses
dans la prise en charge de l’obésité [17]. De nombreux
auteurs suggèrent que les régimes riches en glucides et
pauvres en graisses sont plus efficaces à long terme ; alors
que d’autres suggèrent que dans ce cas les régimes hypo-
caloriques basés sur des aliments à IG bas produisent une
plus grande perte de poids que des régimes équivalents
basés sur des aliments à IG élevés [18, 19].
Les régimes basés sur les aliments à faible teneur lipidique
et riches en glucides à IG bas améliorent le contrôle pon-
déral, en réduisant au minimum la sécrétion post-pran-
diale d’insuline, en maintenant la sensibilité d’insuline et
en favorisant la satiété [20].
Récemment, suite aux résultats controversés des études,
Raben a revu le « pour et le contre » de l’IG en terme
d’appétit, de prise alimentaire, de dépense énergétique et
de poids. Il a conclu qu’il n’existait pas suffisamment de
preuve pour affirmer que les aliments à IG bas ont un effet
supérieur sur le maintien du poids à long terme. D’autre
part, des études ont montré que dès que l’apport énergé-
tique était réduit, la source d’hydrates de carbone ne sem-
blait pas influer sur le poids. De même, les études portant
sur l’apport énergétique ad libitum montrent qu’il n’y a
pas, chez des sujets sains et obèses, de différence en
terme de perte de poids dans le groupe consommant des
aliments à IG bas et celui consommant des aliments à IG
élevé. La perte de poids s’expliquait par une diminution
des apports énergétiques, qui semblait plus facile à réduire
dans le groupe IG élevé [21].
Des études randomisées, contrôlées, multicentriques compa-
rant les effets des régimes conventionnels et IG bas sur le
contrôle pondéral sont encore nécessaires.
Index glycémique et diabète de type 2
En contrôlant les régimes des patients diabétiques, les
objectifs principaux sont de réduire les hyperglycémies,
d’empêcher les épisodes d’hypoglycémies chez les diabé-
tiques traités par l’insuline, et de réduire la survenue des
complications notamment cardiovasculaires.
Une étude confirme que les régimes à IG bas diminuent
l’excrétion urinaire de C-peptide chez les sujets sains, amé-
liorent le contrôle glycémique chez les sujets diabétiques et
le profil lipidique chez les sujets hyperlipidémiques [22-24].
Les études à moyen terme suggèrent que le remplacement
des hydrates de carbone à IG élevé par des formes à IG
bas améliore le contrôle glycémique et, parmi les personnes
traitées par insuline, réduit les besoins insuliniques et les
épisodes d’hypoglycémies.
Une méta-analyse réalisée sur quatorze études, englobant
356 patients, a montré que dix des études avaient mis en
évidence une amélioration du contrôle glycémique à moyen
terme. Après dix semaines de régime à IG faible, chez des
sujets diabétiques de type 1 et de type 2, l’HbA1c diminue
de 0,4 points comparativement aux patients ayant suivi
un régime à IG élevé. Après quatre semaines, la fructosa-
mine diminue de 0,2 mmol/L. Lors des essais réalisés sur
du long terme et dans une plus grande population,
l’HbA1c diminue jusqu’à 0,6 points, ce qui correspond au
bénéfice rendu par certaines thérapies pharmacologiques
(acarbose). Cependant, il est nécessaire de modifier au moins
deux repas par jour ou de réduire de cinquante pour cent
les glucides totaux pour observer une modification. Toute-
fois, il s’agit souvent d’étude de courte durée, réalisée sur
un petit nombre de sujets et dans lesquelles la compliance
diététique est souvent discutable [25].
Index glycémique
et risque cardio-vasculaire
Les régimes à IG bas sont associés à des concentrations
plus élevées de HDL-cholestérol et, dans de grandes études
de cohorte, à la diminution du risque de développer un dia-
bète et une maladie cardiovasculaire [26].
Un régime riche en hydrates de carbone à IG élevé et
charge glycémique élevée a été corrélé au risque de déve-
loppement de maladie coronaire chez les femmes.
Deux études transversales ont prouvé que les régimes à
IG bas sont associés à l’augmentation des concentrations
en HDL-cholestérol, particulièrement chez les femmes
[27]. Dans une étude chez des patients diabétiques de
type 2, le cholestérol total (LDL-cholestérol) et les concen-
trations d’apolipoprotéine B ont diminué de manière
significative après un régime à IG bas. Dans la même
étude, les concentrations de PAI1 (plasminogen activa-
teur inhibitor-1) ont été réduites de 58 % après le régime
à IG bas [28]. L’insulino-sensibilité des adipocytes était
sensiblement plus haute chez les patients ayant subi un
pontage coronaire, après quatre semaines de consom-
mation d’un régime à IG bas [29].

250 Cah. Nutr. Diét., 41, 4, 2006
nutrition appliquée
Jusqu’ici, aucune étude d’observation à long terme n’a été
entreprise sur les effets des régimes à IG bas sur les compli-
cations cardiovasculaires.
Index glycémique : intérêt controversé
L’IG devait être une norme comparative, simple, précise,
et reproductible, mais ce n’est pas le cas pour de nom-
breuses raisons :
– Les modalités du calcul restent controversées. Plusieurs
limitations techniques au calcul de l’IG doivent être consi-
dérées en tant que déterminantes pour sa valeur. Plusieurs
experts considèrent la totalité de l’aire sous la courbe de
la glycémie comme vraie mesure de la disponibilité du
glucose plutôt que l’aire sous la courbe au-dessus de la
glycémie à jeun. Ceci atténue considérablement les diffé-
rences d’IG entre les aliments. Le choix de codifier la
réponse de glucose sur la valeur de deux heures a semblé
peu raisonnable parce que cette norme a été établie seu-
lement comme outil diagnostique dans le diabète du
type 2 et l’intolérance au glucose, et ne peut pas marquer
toute la période d’hyperglycémie post-prandiale. Les
patients présentant un diabète de type 2 exigent plus de
deux heures pour que la glycémie retourne aux concen-
trations normales. Les différences d’IG entre les aliments
rétrécissent considérablement lorsque de plus longues
périodes post-prandiales sont employées, comme par
exemple quatre heures [30]. L’IG a été conçu à l’origine
comme propriété inhérente d’un aliment, et pas comme
réponse métabolique d’un individu à cet aliment.
– De nombreux facteurs font en fait varier l’index glycé-
mique. L’index glycémique traduit principalement la
vitesse d’absorption de l’aliment. Ainsi, tous les facteurs
qui influent sur cette absorption vont donc le modifier.
L’aliment
Les changements de dimensions particulaires des aliments,
la méthode de traitement et la modification chimique modi-
fient l’IG. L’IG dépend de l’histoire du traitement, du stoc-
kage, de la maturité, de la découpe, et de la cuisson. Il est
également affecté par la méthode de préparation : la cha-
leur utilisée, la quantité de l’eau, et le temps de préparation
culinaire ont tous un effet significatif sur l’IG.
La composition du repas
Les différences entre les index glycémiques des aliments
sont perdues une fois que ces aliments sont consommés
dans un repas varié. Lorsqu’il existe plusieurs sources
d’hydrate de carbone, l’effet de l’aliment à IG bas est dilué
proportionnellement à la quantité d’hydrate de carbone
venant des autres aliments. La réponse glycémique diffère
selon les proportions de glucides, lipides et protéines. Plus
la proportion d’hydrate de carbone est importante, par
opposition aux protéines et aux graisses, plus l’IG est
haut. Les aliments riches en protéines augmentent la
sécrétion d’insuline sans augmenter la glycémie. De
même, l’ajout de graisses ralentit la vidange gastrique et
contribue de ce fait à baisser l’index glycémique [31].
L’état du sujet
Pour un même individu, tous les facteurs susceptibles de
modifier la vidange gastrique vont modifier l’index glycé-
mique, c’est le cas par exemple de l’heure de prise alimen-
taire : la vidange gastrique est plus rapide le matin [32].
Conclusion
Pour lutter contre l’augmentation du diabète et de l’obé-
sité, le message donné par la santé publique est clair :
diminuer l’apport calorique total et augmenter l’activité
physique. Pour lutter contre l’incidence des maladies car-
diovasculaires, une consommation faible de graisses satu-
rées est recommandée. Ce sont des recommandations sur
lesquelles nous pouvons tous convenir, et beaucoup de
travail est encore nécessaire pour les faire appliquer à
l’échelle de la population.
Bien que les études suggèrent que les aliments à index gly-
cémique élevé sont nuisibles pour la santé, il n’y a pas assez
de preuves scientifiques disponibles à ce jour pour lancer une
campagne de santé publique. L’index glycémique est une
notion intéressante qui permet de mieux comprendre les fac-
teurs de variation de la glycémie et qui donne un classement
des aliments. Son plus grand intérêt dans la pratique est de
remettre en cause certaines idées reçues, en amenant à réflé-
chir sur la physiologie.
Bibliographie
[1] Jenkins D.J., Wolever T.M., Taylor R.H. – Glycemic
index of foods: a physiological basis for carbohydrate
exchange. Am. J. Clin. Nutr., 1981, 34, 362-366.
[2] Burkitt D.P., Trowell H.C. – Dietary fibre and western
diseases. Ir. Med. J., 1977, 70, 272-277.
[3] Wolever T.M., Jenkins D.J., Jenkins A.L., Josse R.G. –
The glycemic index: methodology and clinical implica-
tions. Am. J. Clin. Nutr., 1991, 54, 846-854.
[4] Salmeron J., Manson J.E., Stampfer M.J., Colditz G.A.,
Wing A.L., Willett W.C. – Dietary fiber, glycemic load,
and risk of non-insulindependent diabetes mellitus in
women. JAMA, 1997, 277, 472-477.
[5] Foster-Powell K., Holt S.H., Brand Miller J.C. – Interna-
tional table of glycemic index and glycemic load values:
2002. Am. J. Clin. Nutr., 2002, 76, 5-56.
[6] Jenkins D.J.A., Kendall C.W.C., Augustin L.S.A. – Gly-
cemic index: overview of implications in health and
disease. Am. J. Clin. Nutr., 2002, 76, 266S-273S.
[7] Jenkins D.J., Wolever T.M., Ocana AM et al. – Metabolic
effects of reducing rate of glucose ingestion by single
bolus versus continuous sipping. Diabetes, 1990, 39,
775-781.
[8] Jenkins D.J., Wolever T.M., Taylor R.H. – Slow release
dietary carbohydrate improves second meal tolerance.
Am. J. Clin. Nutr., 1982, 5, 1339-1346.
[9] Simoneau J.A., Veerkamp J.H., Turcotte L.P., Kelley
D.E. – Markers of capacity to utilize fatty acids in human
skeletal muscle: relation to insulin resistance and effects
of weight loss. FASEB J., 1999, 13, 2051-2060.
[10] Anderson R.A. – Chromium and diabetes. Nutrition,
1999, 15, 720-722.
[11] Brand-Miller J.C., Holt S.H.A., Pawlak D.B., McMillan J.
– Glycemic index and obesity. Am. J. Clin. Nutr., 2002,
76, 281S-285S.
[12] Leeds A.R. – Glycemic index and heart disease. Am.
J. Clin. Nutr., 2002, 76, 286S-289S.
[13] Lavin J.H., Wittert G.A., Andrews J. – Interaction of insu-
lin, glucagonlike peptide 1, gastric inhibitory polypeptide,
and appetite in response to intraduodenal carbohydrate.
Am. J. Clin. Nutr., 1998, 68, 591-598.

Cah. Nutr. Diét., 41, 4, 2006 251
nutrition appliquée
[14] Melanson K.J., Westerterp-Plantenga M.S., Saris W.H.,
Smith F.J., Campfield L.A. – Blood glucose patterns and
appetite in time-blinded humans: carbohydrate versus fat.
Am. J. Physiol., 1999, 277, R337-345.
[15] Rao A.V., Agarwal S. – Role of lycopene as antioxidant
carotenoid in the prevention of chronic diseases: a
review. Nutr. Res., 1999, 19, 305-323.
[16] Giovannucci E. – Insulin and colon cancer. Cancer Causes
Control, 1995, 6, 164–179.
[17] Vermunt S.H., Pasman W.J., Schaafsma G., Kardinaal A.F.
– Effects of sugar intake on body weight: a review. Obes.
Rev., 2003, 4, 91-99.
[18] Astrup A., Grunwald G.K., Melanson E.L., Saris W.H.,
Hill J.O. – The role of low-fat diets in body weight control:
a meta-analysis of ad libitum dietary intervention studies.
Int. J. Obes. Relat. Metab. Disord., 2000, 24, 1545-
1552.
[19] Wolever T.M.S., Jenkins D.J.A., Vuksan V., Jenkins A.L.,
Wong G.S., Joss R.G. – Beneficial effect of low-glycemic
index diet in overweight NIDDM subjects. Diabetes Care,
1992, 15, 562-564.
[20] Lerer-Metzger M., Rizkalla S.W., Luo J. – Effects of long-
term lowglycemic index starchy food on plasma glucose
and lipid concentrations and adipose tissue cellularity in
normal and diabetic rats. Br. J. Nutr., 1996, 75, 723-
732.
[21] Raben A. – Should obese patients be counselled to follow
a low-glycaemic index diet? No. Obes. Rev., 2002, 3,
245-256.
[22] Jenkins D.J., Wolever T.M., Collier G.R. – Metabolic
effects of a low-glycemic-index diet. Am. J. Clin. Nutr.,
1987, 46, 968-975.
[23] Wolever T.M.S. – Summary of FAO and WHO recommen-
dations on carbohydrate in human nutrition. Importance of
glycemic index of foods, physical activity and caloric distribu-
tion on obesity, diabetics and cardiovascular disease. Dietary
reference intake. In : Macronutrient panel symposium: role
of macronutrients in long-term health. National Academy of
Sciences, Washington, DC, 2000.
[24] Jenkins D.J., Wolever T.M., Kalmusky J. – Low-glycemic
index diet in hyperlipidemia: use of traditional starchy
foods. Am. J. Clin. Nutr., 1987, 46, 66-71.
[25] Brand-Miller J., Hayne S., Petocz P., Colagiuri S. – Low-
glycemic index diets in the management of diabetes: a
meta-analysis of randomized controlled trials. Diabetes
Care, 2003, 26, 2261-2267.
[26] Liu S., Willett W.C., Stampfer M.J. – A prospective study
of dietary glycemic load, carbohydrate intake, and risk of
coronary heart disease in US women. Am. J. Clin. Nutr.,
2000, 71, 1455-1461.
[27] Frost G., Leeds A.A., Dore C.J. – Glycaemic index as a
determinant of serum HDL-cholesterol concentration.
Lancet, 1999, 353, 1045-1048.
[28] Wolever T.M., Jenkins D.J., Vuksan V. – Beneficial effect
of a low glycaemic index diet in type 2 diabetes. Diabet.
Med., 1992, 9, 451-458.
[29] Frost G.S., Keogh B.E., Smith D., Leeds A.R., Dorn-
horst A. – Reduced adipocyte insulin sensitivity in Cau-
casian and Asian subjects with coronary heart disease.
Diabet. Med., 1998, 15, 1003-1009.
[30] Pi-Sunyer F.X. – Glycemic index and disease. Am. J. Clin.
Nutr., 2002, 76, 290S-298S.
[31] Nuttall F.Q., Gannon M., Wald J., Ahmed M. – Plasma
glucose and insulin profiles in normal subjects ingesting
diets of varying carbohydrate, fat and protein content.
J. Am. Coll. Nutr., 1985, 4, 437-450.
[32] Scheen A.J., Van Cauter E. – The roles of time of day
and sleep quality in modulating glucose regulation: clinical
implications. Horm. Res., 1998, 49, 191-201.
1
/
5
100%