Etude de la réaction immunitaire activée dans les cellules

UNIVERSITE DE LIMOGES
ECOLE DOCTORALE ED 523 Sciences pour l’Environnement Gay Lussac
FACULTE de Pharmacie et de Médecine
UNITE DE RECHERCHE UMR INSERM 1094
Neuroépidémiologie Tropicale (NET)
Thèse N°
Thèse pour obtenir le grade de DOCTEUR DE L’UNIVERSITÉ DE LIMOGES
Discipline / Spécialité : Immunologie et Infectiologie
présentée et soutenue par
Nour MAMMARI
le 08 juillet 2014
Thèse dirigée par
Pr. Marie-Laure Dardé et Dr. Bertrand Courtioux
JURY :
Rapporteurs
!
Mme. Isabelle Dimier-Poisson (Université François-Rabelais de Tours)
M. Alexander Pfaff (Université de Strasbourg)
!
Examinateurs
!
M. Hervé Pelloux (Université de Grenoble)
Mme. Marie-Odile Jauberteau-Marchan (Université de Limoges)
Mme. Marie-Laure Dardé (Université de Limoges)
M. Bertrand Courtioux (Université de Limoges)
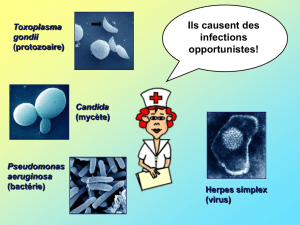
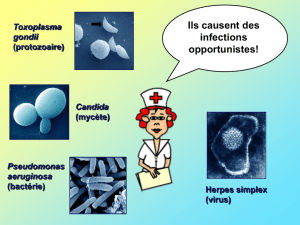
Etude de la réaction immunitaire activée dans les cellules nerveuses
humaines infectées par différentes souches de Toxoplasma gondii

2!
!
Remerciements
Suite à l’année passée pour obtenir mon Master
« Neuroparasitologie Tropicale et Neuroépidémiologie »
Mon travail de recherche en thèse j’ai poursuivi
Ce travail est loin d’être un travail solitaire
Et ça j’en ai la certitude
Je tiens à exprimer toute ma gratitude
Auprès du professeur Dreyfuss pour m’avoir donné
L’opportunité de réaliser ce Master
Sans la générosité et la bonne humeur
Le soutien de nombreuses personnes dont l’intérêt
A l’égard de ma recherche s’est manifesté
M’ont permis de progresser
Dans cette phase délicate de « l’apprenti chercheur »
A tous mille mercis pour votre bienveillance
Je vous témoigne toute ma reconnaissance
A mes directeurs de thèse en particulier
Pour avoir rendu possible pendant ces trois années
Cette aventure enrichissante et merveilleuse
Parfois difficile et douloureuse
A madame le Professeur Marie-Laure Dardé
De m’avoir permis de travailler
Dans son laboratoire avec son protég
Toxoplasma gondii

3!
!
Et monsieur Courtioux Bertrand
Pour la confiance qu’il m’a accordée en acceptant
D’être un de mes encadrants
Un remerciement spécial
Pour ses multiples conseils et son implication
Pour le temps passé et sa précieuse contribution
A la réalisation de ce travail doctoral
Pour ses disponibilités mêmes si serrées étaient
Les délais de relecture des documents que je lui adressais
Je tiens à remercier monsieur Pfaff de Strasbourg
Monsieur Pelloux de Grenoble, madame Poisson de Tours
Madame Jauberteau de Limoges également
D’avoir accepté de faire le déplacement
Pour prendre part au jury et ce malgré
Leur emploi du temps bien chargé
Je remercie toute l’équipe de l’UMR (1094)
Elisabeth, Pascale et Charlotte les secrétaires
Et tout particulièrement son directeur
En la personne de Pierre Marie Preux, professeur
Pour ses remarques pertinentes, pour ses encouragements
Les mercredis, lors des réunions d’équipe
Merci au docteur Philippe Vignolles pour les calculs statistiques
Sa grande disponibilité, sa patience et ses graphiques

4!
!
Un grand merci aussi aux membres du service de Parasitologie
Du CHU et notamment au docteur Hommayoun Riahi
Mon principal fournisseur de cerveaux de souris
Et au docteur Daniel Ajzenberg pour ses précieux avis
Via monsieur le doyen de la faculté de Pharmacie
Le ministère de l’Enseignement Supérieur et de la Recherche, je remercie
Car il a financé en partie cette thèse en m’accordant
Un poste d’ATER : « l’apprenti enseignant »
Je remercie également tous les permanents
Du quatrième, professeur, maitre de conférences ou non
Pour leur bonne humeur, nos sorties resto ou piscine
Nos discussions chaussures, promotions
Merci à Félicité, Sylvie, Martine
Aurélie, Jeanny et Roselyne
Un immense merci à tous les thésards
Présents et passés
Pour leur amitié et cette aventure partagée…
Bassel, Ryma, Mona, Emilie, Karim, Mustafa, Nivine, Nathalie et Hazard

5!
!
Les quelques vers qui vont suivre sont plus personnels à formuler
C’est de l’autre coté de la Méditerranée
Que je suis née, que j’ai appris à marcher
Mes parents m’ont prénommée Nour, Nour Mammari
Fille du soleil, c’est à Oran que j’ai grandi
En Algérie
De tout cœur, je remercie mes parents pour l’amour
Qu’ils m’ont donné, témoigné chaque jour
De ma toute petite enfance à aujourd’hui
Grâce à eux, mon frère, ma sœur, je me suis épanouie
Je leur dois d’être celle que je suis
Leur soutien, leur aide, leur affection est sans frontière
Dans la poursuite de mes études en biologie
J’ai choisi malgré la distance
La France
Précisément Limoges, ville de caractère
Capitale du Limousin, de l’émail et du feu
Où vivent mon oncle, ma tante et Aïcha leur fille
A tous, merci pour votre accueil chaleureux
C’est aussi ça la famille
Mes derniers remerciements sont pour l’homme que j’aime
Pour son soutien, sa tendresse, sa force, son humour
Sa joie, sa gentillesse, son ouverture d’esprit, son amour
C’est pour tout ça que je te dédis ce poème
Adnan, une pluie de « merci » s’échappe de mon cœur
Mets-toi à l’abri ! Merci, merci, merci
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
 188
188
 189
189
 190
190
 191
191
 192
192
 193
193
 194
194
 195
195
 196
196
 197
197
 198
198
 199
199
 200
200
 201
201
 202
202
 203
203
 204
204
 205
205
 206
206
 207
207
 208
208
 209
209
 210
210
 211
211
 212
212
 213
213
 214
214
 215
215
 216
216
 217
217
 218
218
 219
219
 220
220
 221
221
 222
222
 223
223
 224
224
 225
225
 226
226
 227
227
 228
228
 229
229
 230
230
 231
231
 232
232
 233
233
 234
234
 235
235
 236
236
 237
237
 238
238
 239
239
 240
240
 241
241
1
/
241
100%

![Communiqué de presse []](http://s1.studylibfr.com/store/data/001006847_1-327d56b10b29f439d0ca0670da916ebd-300x300.png)