Le syndrome des abcès aseptiques : diagnostic et traitement

Journal Identification = MET Article Identification = 0405 Date: June 12, 2013 Time: 12:27 pm
Revue
mt 2013 ; 19 (2) : 121-7
Le syndrome
des abcès aseptiques :
diagnostic et traitement
Marc André1,2
1CHU Gabriel-Montpied, service de médecine interne, 58, rue Montalembert, 63000
Clermont-Ferrand cedex 1, France
2UMR1071 Inserm/université d’Auvergne M2iSH, microbe intestin inflammation et
susceptibilité de l’hôte, 63000 Clermont-Ferrand, France
Le syndrome des abcès aseptiques est une pathologie inflammatoire caractérisée par des col-
lections profondes riches en polynucléaires neutrophiles et stériles qui apparaît principalement
lors des troisième et quatrième décades de la vie. Les abcès aseptiques ont une localisation
souvent intra-abdominale, notamment splénique mais tous les organes peuvent être atteints.
Ils se manifestent principalement par des douleurs, variables en fonction de leur siège, et de la
fièvre. Ils sont généralement associés à une polynucléose neutrophile et un syndrome inflam-
matoire biologique intenses. Des examens microbiologiques sont indispensables pour écarter
une infection car il s’agit d’un diagnostic d’élimination qui nécessite d’exclure également
certaines pathologies granulomateuses. Les antibiotiques n’ont pas d’effet. L’association avec
une autre affection inflammatoire, notamment une maladie inflammatoire cryptogénétique
de l’intestin, peut aider à conforter la suspicion d’abcès aseptiques. Le traitement repose sur
la corticothérapie générale dont l’efficacité est spectaculaire. Des immunosuppresseurs sont
souvent requis en cas de rechute.
Mots clés : abcès aseptique, corticoïde, anti-TNF-␣, maladie inflammatoire cryptogénétique
de l’intestin
Le syndrome des abcès asep-
tiques (AA) est une pathologie
inflammatoire qui se manifeste typi-
quement par de la fièvre et des
douleurs en rapport avec des col-
lections profondes abcédées et sté-
riles, de localisation principalement
abdominale. Pratiquement tous les
organes peuvent être concernés par
les AA, de fac¸on simultanée ou
successive. Cette entité anatomocli-
nique caractérisée histologiquement
par des lésions qui ont un aspect
pyo-épithélioïde [1] a été individua-
lisée en 1995. Il est vraisemblable
que son existence soit plus ancienne
et que les progrès de l’imagerie
médicale, de la microbiologie et
des anti-infectieux aient facilité son
identification. On ne dispose donc
que de peu d’éléments sur l’histoire
naturelle des AA mais de très
rares observations pour lesquelles ce
diagnostic a été retenu rétrospective-
ment, après une évolution prolongée
sur plusieurs années sans traitement
anti-inflammatoire, montrent que les
récidives ont justifié des interventions
chirurgicales itératives sans véritable
guérison [2]. Le diagnostic du syn-
drome des AA peut être difficile
et long, exigeant en moyenne un
an de délais même s’il est sus-
pecté plus tôt. En effet, il implique
différentes recherches étiologiques
préalables, notamment infectieuses,
et souvent des traitements anti-
biotiques infructueux. Cela diffère
l’instauration d’une corticothérapie
générale qui a une efficacité très
rapide. Les premières observations
ont mis l’accent sur l’association
fréquente des AA avec une mala-
die inflammatoire cryptogénétique
de l’intestin (MICI) dont la découverte
peut faciliter le diagnostic et qui,
sur un plan nosologique et physio-
pathologique, pourrait les rapprocher
des maladies auto-inflammatoires
[1, 3].
doi:10.1684/met.2013.0405
mt
Tirés à part : M. André
121
Pour citer cet article : André M. Le syndrome des abcès aseptiques : diagnostic et traitement. mt 2013 ; 19 (2) : 121-7 doi:10.1684/met.2013.0405
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Journal Identification = MET Article Identification = 0405 Date: June 12, 2013 Time: 12:27 pm
Revue
Épidémiologie
Le syndrome des AA est une affection rare mais
non exceptionnelle. En 2007, l’enregistrement national
(SNFMI-CNIL 99-149) réunissait 30 patients et la revue de
la littérature recensait 19 autres cas [2]. Depuis, l’effectif
de cette cohorte a pratiquement doublé et une dizaine
de cas cliniques isolés ont été publiés [4-12]. Il s’agit
d’une pathologie émergente dont l’incidence est en hausse
mais les AA sont probablement plus facilement et rapide-
ment diagnostiqués actuellement car mieux connus. Le
syndrome des AA a initialement été rapporté en France
puis, une observation néerlandaise [2] et plusieurs autres
cas européens [4, 13] ont été signalés. Comme on pou-
vait le suspecter devant l’association avec les MICI et
la répartition mondiale de ces dernières, des cas d’AA
sont maintenant déclarés à l’échelle mondiale notam-
ment sur le continent américain ou au Japon [14]. Les
AA surviennent principalement au cours de la troisième
décade, surtout s’ils sont associés à une MICI, ou de la
quatrième décade mais les âges extrêmes de survenue se
sont étendus au fil du temps de trois à 80 ans. Le sex-ratio
homme/femme est légèrement supérieur à 1.
Nosologie et physiopathologie
Les AA surviennent de fac¸on isolée dans un quart des
cas [2, 4, 5]. Ils peuvent également accompagner ou révé-
ler une autre maladie inflammatoire ou dysimmunitaire
sous-jacente. Dans ce cas, les AA sont notamment associés
une fois sur deux aux MICI et peuvent précéder la survenue
des signes digestifs de plusieurs années [1]. D’autres affec-
tions sont encore rencontrées lors du syndrome des AA
comme la polychondrite atrophiante, la spondylarthrite
ankylosante, la polyarthrite rhumatoïde, les dermatoses
neutrophiliques ou les gammapathies monoclonales de
signification indéterminée. Les AA ont souvent une évo-
lution indépendante de la maladie qu’ils accompagnent
notamment de la MICI qui est très souvent une maladie
de Crohn. Les AA sont au cœur d’un spectre de maladies
multifactorielles ou de transmission mendélienne. Ils sont
par exemple proches de la maladie de Behc¸et à laquelle
ils sont reliés par le chevauchement qui existe parfois
entre celle-ci et la polychondrite atrophiante (mouth and
genital ulcers with inflamed cartilage [MAGIC] syndrome).
Il peut parfois être difficile de classer précisément un
patient notamment au Japon où une forme de dermatose
neutrophilique, le syndrome de Sweet, présente des cri-
tères communs avec la maladie de Behc¸et qui elle-même
peut ressembler à une MICI. Il s’agit donc bien d’une
entité syndromique et le caractère parfois idiopathique
des AA de même que ses aspects histologiques et évolu-
tifs justifient pleinement son individualisation. Certaines
observations, anciennes pour la plupart, ont été mal-
encontreusement rapportées comme des granulomatoses
atypiques, des sarcoïdoses nécrosantes ou bien encore des
pyoderma gangrenosum profonds alors que pour ce der-
nier, l’appellation se réfère à une entité purement cutanée.
Comme le soulignent Ito et al., lorsqu’une autre affection
coexiste avec les AA, son évolution peut être non seule-
ment dissociée de celle des AA mais encore au second
plan par rapport à eux [14]. En revanche, il est probable
que toutes ces affections partagent certains mécanismes
physiopathologiques communs. Ainsi, certains variants du
gène NOD2/CARD 15 associés à la maladie de Crohn
ont été retrouvés chez des patients atteints d’AA qu’ils
aient ou non une maladie de Crohn avérée [15]. Le
polymorphisme R459R de NOD2/CARD 15 est aussi asso-
cié à une plus grande sévérité du syndrome des AA.
Les polymorphismes longs du promoteur du gène PST-
PIP1 sont significativement plus fréquents chez les patients
qui ont des AA que dans la population témoin [16].
Cet élément pourrait permettre de rapprocher les AA
des maladies auto-inflammatoires puisque PSTPIP1 est
le gène impliqué dans une forme héréditaire de pyo-
derma gangrenosum, le syndrome autosomique dominant
pyogenic arthritis pyoderma gangrenosum acne (PAPA
syndrome). Le déterminisme commun des maladies auto-
inflammatoires est un excès de production d’IL-1via
l’inflammasome. Le blocage de l’IL-1par les biothérapies
s’est avéré temporairement efficace chez un patient avec
des AA [17]. De plus, il existe une surexpression d’IL-1
dans les lésions d’AA [18]. En revanche, les patients ayant
des AA n’ont pas ou peu de stigmates d’auto-immunité.
D’autres mécanismes physiopathologiques peuvent éga-
lement être envisagés sans qu’ils soient scientifiquement
étayés, comme des phénomènes précoces de vascularite
par analogie avec les dermatoses neutrophiliques. Des
stimuli bactériens ou environnementaux sont aussi vrai-
semblables : une observation relate ainsi une infection
àYersinia accompagnée d’AA et suivie d’une maladie
de Crohn [19]. Un homing aberrant de lymphocytes T
mémoires muqueux dans la rate et d’autres organes est
aussi une hypothèse physiopathologique possible à l’instar
des manifestations extra-intestinales des MICI [20].
Présentation clinique,
biologique et radiologique
Le tableau clinique est généralement bruyant. Il existe
fréquemment une phase prodromique avec des signes
généraux marqués par une fièvre volontiers hectique,
une altération de l’état général, des douleurs, et pendant
laquelle l’imagerie classique peut être prise en défaut.
À la phase d’état, les patients ont une fièvre de haut
grade qui conduit à prescrire des examens d’imagerie.
122 mt, vol. 19, n◦2, avril-mai-juin 2013
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Journal Identification = MET Article Identification = 0405 Date: June 12, 2013 Time: 12:27 pm
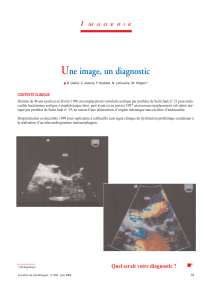
Figure 1. Tomodensitométrie abdominale avec injection : abcès aseptiques spléniques.
L’examen de choix en première intention est la tomoden-
sitométrie qui met en évidence des lésions hypodenses
grossièrement arrondies évocatrices d’abcès ou de collec-
tions profondes (figure 1). Il existe, dans 78 % des cas,
une polynucléose neutrophile qui peut atteindre des taux
très importants. Dans 30 % des cas, il n’y a pas de fièvre
et parfois pas de douleur non plus, voire pas de syndrome
inflammatoire (6 %). Contrastant avec cette présentation
pseudo-infectieuse, l’hémodynamique est conservée. Les
AA se développent principalement dans les organes intra-
abdominaux. Les patients ont très souvent une atteinte
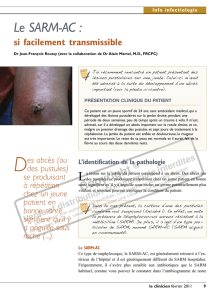
splénique pour des raisons que l’on ignore. Les AA cuta-
nés sont facilement biopsiables et leur diagnostic est plus
aisé (figure 2). Pratiquement tous les organes peuvent être
concernés par les AA, de fac¸on concomitante ou suc-
cessive (tableau 1). Une localisation cardiaque et de la
symphyse pubienne a été récemment rapportée chez une
femme japonaise de 57 ans qui avait une atteinte valvu-
laire mitrale [21]. Une atteinte du septum nasal a aussi été
signalée [22].
Des arthralgies inflammatoires, voire des arthrites,
peuvent apparaître indépendamment de tout rhumatisme
associé. Outre les dermatoses neutrophiliques, diffé-
rentes manifestations cutanéomuqueuses non spécifiques
peuvent être observées telles qu’un érythème noueux ou
des aphtes.
Il existe quelquefois une élévation des enzymes
hépatiques. La procalcitonine est négative. Son dosage
Tableau 1. Fréquence de l’atteinte de différents organes au
cours des abcès aseptiques (AA) (d’après les données du
registre).
Localisation des AA Fréquence de la
localisation (%)
Rate 78
Ganglions abdominaux 47
Foie 37
Poumon 24
Prostate/muscle/peau/
cerveau/pancréas/rein/
muscle/pharynx/testicules
<5
a un intérêt important pour différencier une rechute
d’une infection intercurrente. Il n’y a généralement
pas d’auto-anticorps : rarement, on détecte des anti-
corps anticytoplasme de polynucléaires neutrophiles
(PNN), sans spécificité le plus souvent, ou des anticorps
anti-Saccharomyces cerevisiae. Une patiente avec une
polyarthrite rhumatoïde associée avait des anticorps anti-
peptides cycliques citrullinés.
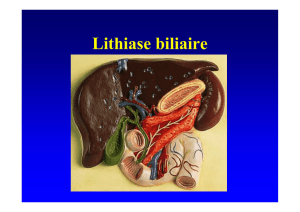
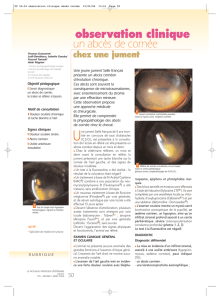
La tomographie par émission de positons (TEP) au
18FDG peut contribuer à localiser des abcès alors qu’ils
ne sont pas collectés et en cas de fièvre ou de syndrome
mt, vol. 19, n◦2, avril-mai-juin 2013 123
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Journal Identification = MET Article Identification = 0405 Date: June 12, 2013 Time: 12:27 pm
Revue
Figure 2. Abcès aseptique cutané situé au-dessus de la malléole externe en regard d’une cicatrice (effet pathergique).
inflammatoire manquants, elle permet d’authentifier une
poussée (figures 3 et 4) [13]. Elle pourrait être utile à la
phase prodromique comme elle l’est lors des rechutes.
L’IRM n’apporte aucun renseignement supplémentaire.
Diagnostic
Le diagnostic repose sur les données cliniques,
microbiologiques, radiologiques, anatomopathologiques
et évolutives sous traitement. Les critères définis en 2007
(tableau 2) sont repris dans la plupart des cas cliniques
publiés récemment. Il s’agit d’un diagnostic d’élimination
qui nécessite d’écarter une infection par les moyens adé-
quats laissés à l’appréciation du clinicien : hémocultures,
recherche de bacille acido-alcoolo résistant (BAAR), séro-
logies, examen bactériologique des abcès après biopsie
ou ponction avec PCR mycobactérie et ARN 16s et 18s.
L’examen anatomopathologique montre typiquement des
lésions pyo-épithélioïdes qui ne sont pas pathognomo-
niques mais doivent évoquer le diagnostic dans le contexte
d’autant que les causes infectieuses pourvoyeuses de telles
124 mt, vol. 19, n◦2, avril-mai-juin 2013
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Journal Identification = MET Article Identification = 0405 Date: June 12, 2013 Time: 12:27 pm
Figure 3. Tomographie par émission de positons : abcès asep-
tiques ganglionnaires et spléniques.
Figure 4. Tomographie par émission de positons : abcès aseptique
pulmonaire.
lésions comme Yersinia,Bartonella ou Chlamydia sont
faciles à écarter. Ces lésions sont différentes d’abcès à pyo-
gène. Les lésions récentes comportent un centre constitué
de PNN plus ou moins altérés, nécrotique sans caséum,
entouré d’une couronne d’histiocytes à disposition palis-
sadique prenant un aspect épithélioïde auxquels se mêlent
quelques cellules géantes puis la zone la plus externe
comporte des lymphocytes séparant le tissu sain (figure 5)
[23].
Outre les causes purement infectieuses, les principaux
diagnostics différentiels à écarter sont la granulomatose
septique chronique notamment chez les patients de moins
de 30 ans, la granulomatose avec polyangéite et la périar-
térite noueuse [24]. Il n’y a pas d’atteinte glomérulaire au
cours des AA. Le contexte et l’évolution l’écartent d’une
sarcoïdose ou de nodules rhumatoïdes.
La recherche d’une MICI associée et surtout d’une
maladie de Crohn est importante, même si les signes
Tableau 2. Critères diagnostiques des abcès aseptiques (AA)
(d’après [2]).
Abcès profond(s) en imagerie avec une prédominance de PNN
lorsqu’une ponction-biopsie a été effectuée
Hémocultures négatives, sérologies négatives notamment pour
Yersinia enterocolitica ; et si ponction-biopsie, bactériologie
standard, BAAR, mycologie, parasitologie du pus négatives
Échec des antibiotiques, s’ils ont été prescrits, après au moins
deux semaines pour une antibiothérapie conventionnelle et trois
mois pour les antituberculeux que l’on administre pour la durée
conventionnelle
Amélioration clinique rapide dès le lendemain de l’administration
des corticoïdes (au moins 0,5 mg/kg par jour de prednisone ou
équivalent, 1mg/kg par jour recommandé) suivie d’une
amélioration radiologique après un mois de corticoïdes,
quelquefois en association aux immunosuppresseurs
digestifs sont frustes car les pathologies associées sont
souvent au second plan. Dans ce contexte, la découverte
d’une maladie de Crohn va conforter l’hypothèse d’AA et
l’existence d’AA spléniques est très spécifique d’AA, des
abcès bactériens n’étant pas rencontrés dans cette situa-
tion en dehors de cas de fistules [4].
Traitement et évolution
La corticothérapie générale constitue le traitement de
référence par définition. Elle est toujours efficace sur
les premières poussées et dans le cas contraire, le dia-
gnostic d’AA doit être remis en question. Le niveau initial
de corticothérapie est empirique mais il se situait entre
0,5 et 1 mg/kg par jour pour la plupart des patients de
la série. L’objectif est de diminuer les corticoïdes afin
d’atteindre 15 à 20 mg/j sur six mois et de tenter un sevrage
au bout de 18 mois. Une corticothérapie prolongée sur
plusieurs années est souvent nécessaire pour les formes
récidivantes. Une antibiothérapie n’est pas un préalable
indispensable à l’introduction d’une corticothérapie si le
tableau est évocateur, notamment en cas d’abcès cuta-
nés. Un patient a eu une rémission sous colchicine seule
pendant sept mois, aussi la colchicine peut constituer un
traitement de première intention (1 mg/j) en attendant les
résultats complets des investigations ou être un traitement
d’appoint lors de la tentative de sevrage de la corticothé-
rapie.
En cas d’AA de la rate, la splénectomie ne peut être
envisagée à des seules fins curatives car dans le registre
national, le taux de rechute est de 77 % dans ce cas de
figure. Une seule observation suggère l’intérêt de la splé-
nectomie à titre thérapeutique mais le recul paraît faible
quand on sait que dans l’observation princeps, une rechute
dans un autre organe apparaissait neuf mois plus tard [25].
mt, vol. 19, n◦2, avril-mai-juin 2013 125
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.
 6
6
 7
7
1
/
7
100%