GH or not GH ? Telle est la question

73
Métabolismes Hormones Diabètes et Nutrition (XI), n° 2, mars-avril 2007
Cas clinique
Cas clinique
L
a pathologie endocrinienne de Madame A., âgée
de 24 ans, a débuté lorsqu’elle avait 17 ans. À cette
date, elle n’avait pas d’antécédent personnel ou
familial particulier et ne suivait aucun traitement. Son
développement pubertaire était complet et, après l’appari-
tion des premières règles à l’âge de 13 ans, ses cycles ont
été spontanément réguliers pendant 4 ans. L’apparition à
l’âge de 17 ans d’une aménorrhée secondaire associée à
une galactorrhée et à des céphalées a fait déterminer le
taux de prolactine plasmatique. Celui-ci a été retrouvé
élevé à plusieurs reprises : 40 ng/ml, pour une norme infé-
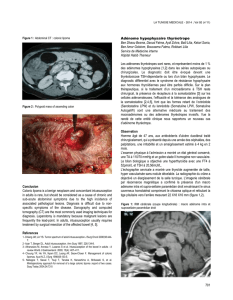
rieure à 25. L’examen par IRM de la région hypophysaire
(figure 1) a confirmé la présence d’un volumineux adé-
nome antéhypophysaire affleurant, sans le comprimer, le
chiasma optique, le champ visuel s’avérant normal.
À ce stade, plusieurs hypothèses diagnostiques étaient
compatibles avec les tableaux clinique, biologique et
radiologique. L’hypothèse d’un adénome hypophysaire à
prolactine permettait d’expliquer le syndrome aménorrhée-
galactorrhée mais se heurtait, a contrario, à la dissociation
entre un taux de prolactine peu élevé et un volumineux
adénome. Si le diagnostic de prolactinome était retenu, il
fallait alors admettre que cet adénome soit en grande partie
nécrotique. La deuxième hypothèse était celle d’un adénome
non sécrétant responsable d’une hyperprolactinémie fonc-
tionnelle. En 2007, le volume de l’adénome hypophysaire
contre-indiquerait la réalisation d’une exploration dyna-
mique utilisant la TRH ou la GnRH. Ce test a été effectué au
début de l’histoire endocrinienne de Madame A., bien avant
2007. La prolactine s’élève de 40 à 95 ng/ml après adminis-
tration de TRH, ce qui constituait un argument en faveur du
caractère fonctionnel de l’hyperprolactinémie, vraisembla-
blement de déconnexion. Par ailleurs, si l’adénome hypo-
physaire n’est pas directement responsable de la sécrétion
de prolactine, il peut être la source d’autres sécrétions anor-
males. L’examen clinique de Madame A. est, à cette date,
peu informatif dans ce domaine. Elle mesure 1,73 m et pèse
54 kg. La pression artérielle est à 110/70 mmHg. Il n’y a
aucun signe de catabolisme tissulaire. Elle est cliniquement
euthyroïdienne. Enfin, il n’y a pas de signe clinique étayant
l’hypothèse d’une acromégalie, mais nous ne disposons
pas d’une courbe de croissance. Au demeurant, le résultat
de l’exploration fonctionnelle hypophysaire apportera de
précieuses informations. Il existe une insuffisance gona-
dotrope vraisemblablement satellite de l’hyperprolacti-
némie. Les fonctions corticotrope et thyréotrope s’avèrent
parfaitement normales. Le taux d’hormone de croissance
atteint 84 ng/ml, s’élevant à 147 après administration de
TRH. L’IGF-1 plasmatique, égal à 1 656 ng/ml, est situé
très largement au-dessus de la norme pour l’âge. In fine, le
diagnostic qui est retenu est celui de macroadénome soma-
totrope associé à une hyperprolactinémie de déconnexion.
Compte tenu du volume de l’adénome, l’option est prise
d’une intervention neurochirurgicale par voie trans-
sphénoïdale. L’examen anatomopathologique de la pièce
d’exérèse confirmera la nature somatotrope de l’adénome.
En postopératoire, les céphalées disparaissent, de même que
la galactorrhée et des cycles spontanés réapparaissent. Un
mois après l’intervention, la prolactinémie est à 14 ng/ml,
le taux de GH à 58 ng/ml et celui d’IGF-1 à 952 ng/ml.
Le reste de la fonction antéhypophysaire s’inscrit dans la
norme. Le suivi ultérieur confirmera la persistance d’une
hypersécrétion d’hormone de croissance en dépit de la
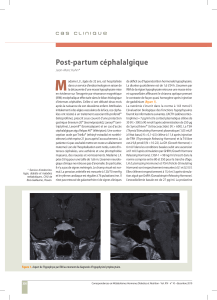
réduction volumétrique tout à fait considérable obtenue par
le geste neurochirurgical (figure 2). Ce geste sera complété
par la réalisation d’une radiothérapie stéréotaxique par
gamma knife suivie d’un traitement par analogue de la
somatostatine dans l’attente de l’obtention de la pleine effi-
cacité du traitement radiothérapique. Une contraception par
Implanon® (étonogestrel) est simultanément assurée.
En dépit de la triple étape thérapeutique (neurochirurgicale,
radiothérapique, puis médicale par analogue de la somatos-
tatine), l’hypersécrétion somatotrope persiste. L’évolution
des taux d’IGF-1 plasmatique est représentée sur la figure 3.
Sous traitement, le taux d’hormone de croissance s’abaisse
à 2 ng/ml et celui d’IGF-1 à 580 ng/ml. La prolactine est
à 23 ng/ml et le reste de la fonction anté hypophysaire
s’inscrit dans la norme. Ces résultats amènent à modifier
la stratégie thérapeutique en interrompant le traitement par
GH or not GH ? Telle est la question
J.M. Kuhn*
* CHU de Rouen.
Figure 1. IRM hypophysaire objectivant la présence d’un volumineux
adénome affleurant le chiasma optique sans le comprimer.

74
Métabolismes Hormones Diabètes et Nutrition (XI), n° 2, mars-avril 2007
Cas clinique
Cas clinique
analogue de la somatostatine et en le remplaçant par du
pegvisomant. À noter, 10 mg par jour de l’antagoniste de la
GH permettent de normaliser parfaitement le taux d’IGF-1
plasmatique qui s’abaisse dès le premier mois à 200 ng/
ml (figure 3). Les bilans ultérieurs confirmeront à la fois
l’excellente tolérance et l’efficacité du traitement médical
s’opposant à l’effet hépatique de la GH.
Le tout dernier bilan de surveillance, réalisé à l’âge de
24 ans, alors que la contraception est assurée désormais par
stérilet, confirme l’intégrité de la fonction antéhypophy-
saire et la normalisation du taux d’IGF-1 plasmatique qui
est réduit à 178 ng/ml. En revanche, le taux d’hormone de
croissance est considérablement élevé et atteint 4 000 ng/
ml. Ce dernier chiffre, communiqué en urgence par le labo-
ratoire dès l’obtention du résultat, devait-il faire remettre
en question la stratégie thérapeutique précédemment
adoptée ? En effet, si la normalisation du taux d’IGF-1
plasmatique réduit son effet de “rétrocontrôle négatif”
exercé sur la sécrétion de l’adénome hypophysaire, l’élé-
vation secondaire et attendue du taux plasmatique de
GH n’atteint jamais un tel chiffre. Le résultat obtenu est
donc très vraisemblablement lié à la présence d’un arté-
fact, le kit de dosage utilisé reconnaissant à la fois la GH
native et le pegvisomant, dont la structure moléculaire est
proche de celle de l’hormone de croissance. Informations
prises auprès du laboratoire, il apparaît que la méthode
de dosage de la GH a été récemment modifiée, le kit Dia
Sorin Liaison® ayant remplacé la technique précédente,
qui utilisait la GH Advantage®. La mesure sur le même
échantillon plasmatique du taux d’hormone de croissance
à l’aide de cette dernière méthode a confirmé le caractère
artéfactuel du chiffre obtenu avec la nouvelle technique de
dosage. Dans l’interprétation des paramètres hormonaux
de surveillance, il faut donc tenir compte des possibles
interférences du traitement par pegvisomant dans le dosage
utilisé pour la mesure de la GH. Une élévation majeure
des taux de GH ne doit pas faire conclure ex abrupto à une
exacerbation majeure de la sécrétion du reliquat adéno-
mateux sous-tendu par un défreinage secondaire à la
normalisation des taux d’IGF-1 et, éventuellement, à son
expansion volumétrique. Cette dernière conséquence du
traitement par pegvisomant, au demeurant exceptionnel-
lement rapportée dans la littérature, peut être totalement
exclue chez Madame A., l’examen par IRM réalisé dans le
cadre du bilan de surveillance retrouvant une hypophyse
de dimensions tout à fait normales (figure 4).
Dans le cas précis de Madame A., le traitement par
antagoniste de la GH a été poursuivi au rythme d’une
injection trois fois par semaine et le taux d’hormone de
croissance a été mesuré en sélectionnant précisément un
kit de dosage dénué de cette interférence artéfactuelle.
•
Van der Lely AJ et al. Lancet 2001;358:1754-9.
•
Jehle S et al. J Clin Endocrinol Metab 2005;90:1588-93.
Figure 2. IRM hypophysaire effectuée 3 mois après la réalisation
d’une intervention transsphénoïdale et avant celle d’une radio-
théraphie stéréotaxique.
Neurochirurgie
IGF-1 (ng/ml)
Mois
Base 0 18 36 42 54
SMS
*
PEG
2 000
1 000
01
10
100
1 000
10 000
Gamma knife
GH (ng/ml)
Figure 3. Évolution des taux plasmatiques de GH et d’IGF-1 au cours
du traitement. Les taux de GH ont été déterminés par la méthode GH
Advantage
®
, à l’exception du dernier en date (marqué d’un astéris-
que), qui a été mesuré avec le kit de dosage Dia Sorin Liaison
®
.
Figure 4. IRM hypophysaire du dernier bilan de surveillance, contem-
porain de la mesure du taux de GH plasmatique par la méthode Dia
Sorin Liaison
®
.
1
/
2
100%