Interleukine 2, IL-2 - Serveur UNT-ORI

Immunosuppresseurs
L'immunité couvre l'ensemble des mécanismes qui nous permettent de nous défendre contre les
organismes étrangers, microbes, virus, parasites et contre les protéines étrangères. Mais parfois notre
propre organisme produit des protéines anormales qui lui paraissent étrangères et qui sont à l'origine
de diverses maladies appelées auto-immunes. Par ailleurs de plus en plus souvent les malades
reçoivent des greffes provenant d'un autre individu, donc étrangères, et leur organisme tend à les
rejeter. Les immunosuppresseurs réduisent ces mécanismes de défense et atténuent les
manifestations des maladies auto-immunes et le risque de rejet d'un organe transplanté.
Parallèlement à leurs effets bénéfiques ils réduisent les capacités de défense de l'organisme contre
les infections dues aux microbes, aux virus et aux parasites. De plus ils peuvent avoir de effets
indésirables non directement liés à leurs effets sur l'immunité.
Glucocorticoïdes
Inhibiteurs de la synthèse d'IL2
ciclosporine
tacrolimus
Inhibiteurs des effets de l'IL2
daclizumab
basiliximab
sirolimus
Inhibiteurs de la synthèse du DNA
azathioprine
mycophénolate
Alkylants
cyclophosphamide
Anticorps antilymphocytaires
muromonab
Glucocorticoïdes
Les stéroïdes sécrétés par la glande corticosurrénale se divisent en trois classes en fonction de leur
activité principale :
1. Les glucocorticoïdes comme le cortisol, qui agissent essentiellement sur le métabolisme
glucidique et protéique

2. Les minéralocorticoïdes comme l'aldostérone, qui agissent sur le métabolisme hydrominéral
3. Des androgènes.
Le terme corticoïdes désigne à la fois les glucocorticoïdes et les minéralocorticoïdes.
Les glucocorticoïdes comprennent le cortisol, hormone endogène, et plusieurs dérivés de synthèse
sélectionnés en fonction de l'intensité de certains de leurs effets.
Interleukine 2, IL-2
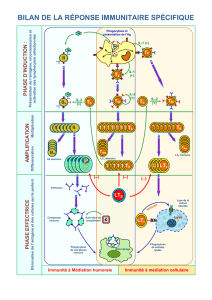
L'IL-2 a été appelée initialement TCGF (T cell growth factor) parce qu'elle entraîne une maturation et
une prolifération des lymphocytes T.
Sécrétion
L'IL-2 est sécrétée essentiellement par les lymphocytes T de type CD4+ stimulés par les antigènes
présentés par les macrophages et par l'IL-1. L'interaction entre un macrophage porteur d'un antigène
présenté par les molécules HLA de classe II et le récepteur d'un lymphocyte T Helper, provoque au
niveau du lymphocyte T la stimulation de la phospholipase C qui hydrolyse le PIP2 en IP3 et en
diacylglycérol. L'IP3 libère du calcium qui active la calmoduline, laquelle s'unit à la calcineurine. Le
complexe calmoduline-calcineurine déphosphoryle le NF-AT (nuclear factor of activated T cell) qui est
présent dans les cellules lymphoïdes quiescentes à l'état phosphorylé. Le NF-AT déphosphorylé
pénètre dans le noyau et active la synthèse d'IL-2.
On trouve dans le plasma au cours de diverses maladies d'origine tumorale, immunologique ou
infectieuse (bactérienne, virale, parasitaire) des récepteurs de l'IL-2, solubles, dont la signification
reste obscure mais qui pourraient réduire l'activité de l'IL-2 en la fixant.
Effets
L'IL-2 a des effets de type autocrine et paracrine.
L'IL-2 active des récepteurs situés sur la membrane de diverses cellules, lymphocytes T et
lymphocytes NK, lymphocytes B activés.

Les récepteurs de l'IL-2 sont composés de trois chaînes polypeptidiques non liées d'une manière
covalente. La stimulation des récepteurs de l'IL-2 conduit à l'activation des protéines RAFT1
(rapamycine FKBP target) et FRAP (FKBP-rapamycine associated protein), lesquelles activent à leur
tour les CDK (cycline dependent kinases).
L'IL-2 est un facteur de croissance pour les lymphocytes T. Elle active leur transformation en
lymphocytes T cytotoxiques de type CD8+ qui sécrètent l'interféron , lequel stimule les macrophages à
libérer le TNF et le TGF (transforming growth factor ).
L'IL-2 stimule la croissance et l'activité cytolytique des cellules NK (natural killer).
Elle stimule la maturation des lymphocytes B et la synthèse d'anticorps.
Par ces actions l'IL-2 participe à la défense de l'organisme contre les molécules qui lui sont
étrangères.
Utilisation thérapeutique
L'IL-2 est obtenue par génie génétique et appelée IL-2 recombinante.
Elle est indiquée dans le traitement du cancer du rein métastasé contre lequel elle a montré une
certaine efficacité, sans que les justifications théoriques de cette indication particulière soient claires.
Elle s'administre par voie intraveineuse. Elle est également proposée dans le traitement du mélanome
métastatique et pour stimuler les défenses immunitaires de malades atteints du SIDA.
Interleukine 2 ou aldesleukine
PROLEUKIN* Inj
Les effets indésirables de l'IL-2 sont proportionnels à la dose : fièvre, frissons, fatigue, éruption
érythémateuse généralisée, anémie, hyperéosinophilie, hypoalbuminémie, diarrhée, stomatite,
troubles psychiatriques, troubles cardiaques comme l'infarctus. En cas de tumeur cérébrale,
l'administration de l'IL-2 peut être à l'origine d'un dème péritumoral et d'une hypertension
intracranienne.
Interleukine 2, IL-2 - Inhibiteurs de la sécrétion
Les médicaments inhibant la sécrétion d'IL-2 sont la ciclosporine et le tacrolimus, tous deux
pénétrant dans le cytoplasme des lymphocytes de type CD4+ où ils inhibent la transduction du signal
conduisant à la synthèse d'IL-2.
Ciclosporine
La ciclosporine, qui s'écrit aussi cyclosporine, est un médicament majeur, découvert et utilisé en
thérapeutique avant que l'on ne connaisse son mécanisme d'action au niveau moléculaire.

Elle a été sélectionnée parce qu'elle inhibait le rejet de greffe chez l'animal. Par la suite elle s'est
montrée efficace en thérapeutique dans la même indication.
Le mécanisme d'action de la ciclosporine retenu actuellement est l'inhibition de la synthèse de
certaines cytokines, en particulier celle de l'IL-2 par les lymphocytes T Helper. Cette inhibition s'opère
selon les mécanismes suivants :
a. La ciclosporine pénètre dans le cytoplasme des lymphocytes T Helper où elle se lie à une
immunophiline, la cyclophiline, qui est une enzyme, la peptidyl-prolyl-cis-trans-isoménase ou
rotamase.
b. Le complexe cyclophiline-ciclosporine se lie à la calcineurine et inhibe son activité
phosphatasique, ce qui conduit à l'accumulation de phosphoprotéines parmi lesquelles le NF-
AT (nuclear factor of activated T cell) sous forme phosphorylée qui ne pénètre pas dans le
noyau et n'induit pas la synthèse d'IL-2.
La ciclosporine inhibe, outre la synthèse d'IL-2, celle d'IL-3 et d'IL-4, du GMCSF et du TNF, cytokines
intervenant notamment dans le rejet de greffes.
Un autre mécanisme d'action a été proposé : la ciclosporine augmenterait la synthèse de TGF-ß qui a
des propriétés immunosuppressives.
Sur le plan pharmacocinétique, la ciclosporine est métabolisée dans l'organisme par le cytochrome P-
450 en plusieurs métabolites oxygénés dont certains possèdent une activité pharmacologique. Son
métabolisme peut être modifié, soit accéléré, soit ralenti, par d'autres médicaments :
accéléré par les inducteurs enzymatiques comme la rifampicine, la carbamazépine, le
phénobarbital, qui diminuent sa concentration plasmatique
ralenti par les inhibiteurs du cytochrome P-450 comme l'érythromycine et le kétoconazole qui
entraînent une élévation de sa concentration plasmatique.
La ciclosporine dont la prescription doit être initiée à l'hôpital a plusieurs indications :
a. La transplantation d'organe et la greffe de moelle osseuse où elle est utilisée dans la
prévention du rejet du greffon et le traitement du rejet lorsqu'il survient
b. En néphrologie, le traitement de deuxième intention des syndromes néphrotiques avec lésions
glomérulaires
c. En dermatologie, les formes étendues et graves du psoriasis résistant aux autres traitements
et de la dermatite atopique de l'adulte
d. En rhumatologie, le traitement des formes très actives et graves de la polyarthrite rhumatoïde,
en cas d'inefficacité des autres traitements
e. En ophtalmologie, le traitement de certaines uvéites
f. En hématologie, le traitement des aplasies médullaires acquises sévères.

L'indication essentielle de la cyclosporine reste la transplantation d'organe qui s'est développée grâce
à son efficacité.
Elle est commercialisée sous deux formulations différentes (excipients différents) l'une le NEORAL* a
une meilleure biodisponibilité par voie orale que l'autre, le SANDIMMUN*.
Ciclosporine
NÉORAL* sol buv 100 mg/ml, Capsules
SANDIMMUN*Capsules 25,50,100mg, Sol buv, Inj 50 mg/ml
La ciclosporine peut entraîner un certain nombre d'effets indésirables : insuffisance rénale,
hypertension artérielle, tremblements, paresthésies, sensations de brûlure aux mains et aux pieds,
hirsutisme, troubles digestifs (anorexie, nausées, vomissements, diarrhées, hypertrophie gingivale),
troubles métaboliques (hyperkaliémie, hyperuricémie, hypomagnésémie).
En raison de la diminution des réponses immunitaires, elle peut augmenter le risque d'apparition de
certaines tumeurs malignes ou de lymphomes.
La ciclosporine n'aurait pas d'effet tératotogène.
Régulation de la biosynthèse d'IL-2
Site d'action de la ciclosporine et du tacrolimus
Tacrolimus ou FK 506
Le tacrolimus est une lactone macrocyclique hydrophobe, isolée au Japon à partir d'un Streptomyces.
Le tacrolimus a le même mécanisme d'action que la ciclosporine, mais au lieu de se fixer à la
cyclophiline, il se fixe à une protéine appelée FKBP (FK binding protein). Le complexe tacrolimus-
FKBP inhibe l'activité phosphatasique de la calcineurine responsable de la déphosphorylation du NF-
AT-P. Comme seul le NF-AT (non phosphorylé) est susceptible de pénétrer dans le noyau et de
stimuler la production d'IL-2, l'inhibition de la déphosphorylation du NF-AT-P, l'inactive.
Tacrolimus
PROGRAF* Gel 1 et 5mg
PROTOPIC*, pommade
MODIGRAF* Suspension buvable 0,2 et 1 mg
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%