Carcinome différencié de la thyroïde

Carcinome différencié de la thyroïde
Ce qu’il faut savoir en pratique
Katharina Binza, Andreas Haldemannb, Ingrid Schweizerc, Thomas Gürtlerd, Christoph A. Meiere
aPraxis für Endokrinologie-Diabetologie, Zürich, bNuklearmedizin, Stadtspital Triemli, Zürich, cChirurgische Klinik, Kreisspital Männedorf,
d Chirurgische Klinik, Stadtspital Triemli, Zürich, eMedizinische Klinik, Stadtspital Triemli, Zürich
CABINET Forum Med Suisse 2008;8(43):818–822 818
Introduction
En Suisse, quelque 350 nouveaux carcinomes
différenciés de la thyroïde sont diagnostiqués
chaque année [1]. Ils sont deux fois plus fré-
quents chez les femmes que chez les hommes.
Leur incidence et leur prévalence en Suisse sont
très proches des valeurs pour l’ensemble de
l’Europe de l’Ouest.
Les carcinomes papillaires sont 3–4 fois plus
fréquents que les folliculaires. Ils font le plus
souvent leurs métastases dans les ganglions
lymphatiques régionaux. Le diagnostic peut
être posé par la cytologie. Les carcinomes folli-
culaires sont généralement plus volumineux
lors de leur diagnostic, et leurs métastases sont
principalement hématogènes. Leur diagnostic
cytologique n’est généralement pas possible.
L’incidence du carcinome thyroïdien papillaire
est en augmentation dans le monde entier.
S’agit-il d’une augmentation bien réelle? Cette
question est très controversée. Les modifica-
tions des critères histologiques surtout, ainsi
que les échographies toujours plus fréquentes
de la thyroïde et de la région cervicale contri-
buent très nettement à cette augmentation d’in-
cidence [2].
Le pronostic du carcinome thyroïdien différencié
après traitement adéquat (strumectomie totale
avec ou sans élimination par l’iode radioactif) est
excellent [3]; pour le carcinome papillaire, la sur-
vie à 10 ans est de 97% (avec toutefois jusqu’à
20% de récidives locales et ganglionnaires) et
celle du carcinome folliculaire de 75% [4].
L’agressivité de la chirurgie ainsi que le traite-
ment qui suit doivent donc être adaptés au risque.
Facteurs de risque et manifestations
du carcinome thyroïdien différencié
Les patients à haut risque sont ceux qui ont subi
une irradiation de la tête ou du cou, ceux qui pré-
sentent certains syndromes tumoraux familiaux
rares (par ex. Cowden, carcinome thyroïdien pa-
pillaire familial) ainsi que ceux chez lesquels il y
a une rapide augmentation de volume d’un no-
dule.
Vous trouverez les questions à choix multiple concernant cet article à la page 809 ou sur internet sous www.smf-cme.ch.
Quintessence
쎲Les carcinomes de la thyroïde se manifestent par des nodules indolores au niveau
de la loge thyroïdienne. Leur incidence annuelle en Suisse est d’environ 2/100000
chez les hommes et de 5/100000 chez les femmes [1]. Leur mortalité est faible.
쎲Histologiquement, on distingue les carcinomes bien différenciés (papillaires
et folliculaires) des indifférenciés (anaplasiques), sans oublier les rares carci-
nomes thyroïdiens médullaires. Ce travail ne traitera que des carcinomes thy-
roïdiens différenciés.
쎲La classification se base sur le système de l’UICC (Union Internationale Contre
le Cancer) de 2002, basé quant à lui sur le système TNM, combiné avec l’âge du
patient lors du diagnostic. Cette donnée a une valeur pronostique et détermine
ainsi le choix du traitement.
쎲En principe, le traitement est choisi en fonction du risque individuel. Pour un
carcinome thyroïdien différencié de 01,5 cm de diamètre, la strumectomie totale
est le traitement de choix. Une résection des ganglions lymphatiques par com-
partiments n’est effectuée qu’en cas de suspicion échographique ou peropéra-
toire de métastases.
쎲Un traitement d’élimination à l’iode 131 fait souvent suite à la strumectomie
totale dans le but d’éliminer toutes les cellules thyroïdiennes résiduelles (dans la
loge thyroïdienne mais aussi les éventuelles micrométastases). Cette procédure
a également une importance diagnostique (scintigraphie du corps entier, mesure
fiable du marqueur tumoral).
쎲Le suivi des patients se fait en fonction du risque. Il a été sérieusement mo-
difié par les appareils d’échographie actuels et par le dosage ultrasensible de la
thyroglobuline après stimulation par la rhTSH.
쎲L’hormonothérapie suppressive continue à représenter un élément important
du traitement. Toutefois, ici aussi, il faut bien en peser les bénéfices par rapport
aux risques potentiels.
Summary
Differentiated thyroid cancer: pointers for the practitioner
쎲Thyroid cancer presents as painless nodules in the thyroid bed. The annual
incidence in Switzerland is approx. 2/100000 for men and 5/100000 for women
[1]. Mortality is low.
쎲Histologically a distinction is drawn between well differentiated (papillary
and follicular) and undifferentiated (anaplastic) as well as the rare medullary
thyroid cancers. In this paper only differentiated thyroid cancers will be con-
sidered.
쎲The basis for classification is the UICC system (Union Internationale Contre
le Cancer) of 2002, which is based on the TNM system, combined with patient’s
age at diagnosis. It has prognostic significance and thus determines the choice
of therapy.
818-822 Binz 132_f.qxp 9.10.2008 13:02 Uhr Seite 818

CABINET Forum Med Suisse 2008;8(43):818–822 819
Le dosage de la thyroglobuline ou de la calcito-
nine lors de l’évaluation initiale d’un nodule
thyroïdien ne peut être préconisé (gros pro-
blème de sensibilité, de spécificité et de rapport
coût–efficacité). Une scintigraphie de la thy-
roïde est surtout indiquée si la TSH est suppri-
mée ou en cas de suspicion d’extension rétro-
sternale d’un goitre multinodulaire.
L’échographie de la thyroïde est la technique de
choix pour le diagnostic des nodules thyroï-
diens, leur localisation précise, la mesure de
leur volume et la ponction à l’aiguille fine (Fine-
Needle Aspiration Cytology, FNAC)) sous contrôle
échographique. Cet examen doit toujours in-
clure aussi les ganglions lymphatiques cervi-
caux. Bien que des signes écho graphiques aient
été décrits concernant les ganglions métasta-
tiques (microcalcifications, hypo échogénicité
et/ou limites irrégulières, nodule solide sans
bordure hypoéchogène [«halo»] ou perfusion
plus importante et irrégulière au Doppler cou-
leur), ils ne sont pas fiables et ne permettent au-
cune certitude diagnostique [8, 9].
Tous les ganglions de plus de 1–1,5 cm de dia-
mètre (ou de moins de 1 cm si constellation à
risque, v. plus haut) doivent être ponctionnés à
l’aiguille fine et, dans le goitre multinodulaire,
les 2–3 plus grands, ou ceux dont l’image écho-
graphique semble suspecte. La FNAC est le meil-
leur examen diagnostique des nodules thyroï-
diens. C’est même l’examen de choix des nodules
aussi bien solitaires que multiples. L’examen cy-
tologique permet de faire l’importante distinc-
tion entre lésion macrofolliculaire (bénigne) et
microfolliculaire (dignité incertaine) et de poser
le diagnostic de carcinome papillaire de la thy-
roïde.
Le diagnostic cytologique de lésion microfolli-
culaire est posé dans 10–20% des cas, mais il
ne permet pas de faire la distinction entre un
adénome (90–95%) et un carcinome (5–10%) en
toute sécurité. Un examen histologique est re-
commandé dans de telles situations.
Dans 10% des cas, la FNAC ne donne pas de diag-
nostic, car le matériel est insuffisant. Plusieurs
articles ont déjà présenté en détail les nodules
thyroïdiens et leur investigation [10, 11].
L’échographie permet de diagnostiquer prati-
quement autant de nodules thyroïdiens que
l’autopsie, soit chez >50% de la population. Un
dixième seulement se manifestera cliniquement.
La prévalence d’un carcinome dans un nodule
thyroïdien est estimée à 10–15% environ, mais
il s’agit là en très grande majorité de microcar-
cinomes papillaires, sans aucune importance
clinique. En d’autres termes: l’examen écho-
graphique permet de diagnostiquer des carci-
nomes qui ne seront jamais cliniquement ma-
nifestes et n’auront donc jamais besoin d’un
quelconque traitement. Ce n’est que dans des
situations exceptionnelles (volumineux goitre
rétrosternal, suspicion d’infiltration de la tra-
Le carcinome thyroïdien papillaire est plus
fréquent chez les survivants de la bombe ato-
mique d’Hiroshima, et chez les gens qui vivaient
près de Tchernobyl lors de l’accident du réacteur
[5]. La relation entre irradiation reçue et inci-
dence est linéaire, et le risque très dépendant de
l’âge. Le risque le plus élevé se trouve chez les
enfants de moins de 10 ans; après 20 ans, il n’y
a plus d’augmentation démontrable du risque. Ce
risque est encore augmenté par le manque d’iode.
La manifestation la plus fréquente du carcinome
de la thyroïde est un nodule découvert par ha-
sard. L’examen peut révéler un nodule thyroïdien
fixé et parfois des ganglions lymphatiques latéro -
cervicaux homolatéraux. Les patients ayant un
carcinome thyroïdien différencié ne présentent
que rarement un enrouement d’apparition ré-
cente, signe d’une compression ou d’une infiltra-
tion du nerf récurrent. L’absence de ces signes ou
symptômes n’exclut toutefois pas un carcinome
thyroïdien.
La biologie, le status et l’évolution sont différents
pour les carcinomes papillaire et folliculaire [6].
Le papillaire est souvent de petite taille, multifo-
cal et s’accompagne de métastases lymphatiques
cervicales chez un tiers des patients. Les récidives
ganglionnaires atteignent 12% pour le stade pN1,
contre 3% pour le stade pN0 [7]. Le carcinome
thyroïdien folliculaire est souvent plus volumi-
neux lors du diagnostic (>pT2). Les carcinomes
folliculaires minimalement invasifs sont des car-
cinomes dits «low risk»; ils sont unifocaux, ne
font pas de métastases lymphatiques et très
rarement des métastases hématogènes. La sur-
vie à long terme est >95%.
Examens à faire en cas de suspicion
de carcinome de la thyroïde
Le premier examen à demander après la dé-
couverte d’un nodule thyroïdien solide est le
dosage de la TSH. Si elle est augmentée ou
abaissée, il faut doser la FT4.
쎲Basically the choice of treatment is guided by the individual risk. In differen-
tiated thyroid cancers of 01.5 cm diameter total thyroidectomy is the therapy of
choice. Lymph node resection by compartment is performed only where there is
intraoperative suspicion of metastases.
쎲Total thyroidectomy is frequently followed by radioiodine-131 ablation ther-
apy, the aim of which is to eliminate all residual thyroid cells (in the thyroid bed,
but also micrometastases). It is likewise of diagnostic importance (whole body
scintigraphy, reliable measurement of the tumour marker).
쎲Patient follow-up is risk-dependent and has been greatly changed by present-
day sonography equipment and by rhTSH-stimulated ultrasensitive thyroglubu-
lin determination.
쎲Thyroid hormone suppressive therapy continues to form an important part
of treatment, though here, too, its usefulness must be weighed against the po-
tential risks.
818-822 Binz 132_f.qxp 9.10.2008 13:02 Uhr Seite 819

CABINET Forum Med Suisse 2008;8(43):818–822 820
donnée a une valeur pronostique et détermine
ainsi le choix du traitement (tab. 1 p).
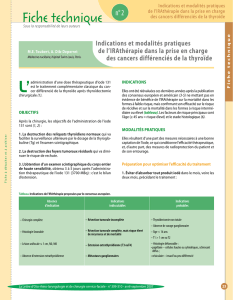
Traitement du carcinome de la thyroïde
Chirurgie
A l’exception du microcarcinome solitaire bien
différencié (diamètre 91 cm), en l’absence de
toute métastase ganglionnaire et d’irradiation
préalable de la région cervicale, la strumectomie
totale est le traitement de choix. Dans le car -
cinome papillaire, elle est complétée par une
résection des ganglions lymphatiques du com-
partiment central. En présence de métastases
ganglionnaires confirmées en préopératoire, ou
d’un status suspect en peropératoire, il faut en
plus procéder à une lymphadénectomie des com-
partiments suspects [12].
Cette intervention devrait se faire dans des
centres expérimentés, de manière à en réduire au
maximum la morbidité et les récidives. Les chi-
rurgiens expérimentés opèrent avec un risque de
1,6% de parésies unilatérales définitives du nerf
récurrent et de 2–3% d’hypoparathyroïdie per-
sistante [6]. Un enrouement suite à une lésion
transitoire du récurrent est très fréquent, mais il
disparaît la plupart du temps au bout d’un à six
mois. Des hypocalcémies transitoires (par mani-
pulation peropératoire des parathyroïdes) peu-
vent se présenter chez jusqu’à un tiers des pa-
tients opérés. Mais souvent les parathyroïdes
fonctionnent de nouveau normalement en l’es-
pace de trois mois.
Radiothérapie postopératoire
L’ablation à l’iode radioactif (I¹³¹) s’effectue dans
des centres équipés pour ce faire, dans le but de
détruire le tissu thyroïdien normal résiduel et
d’éventuels résidus tumoraux microscopiques.
Deux à cinq jours après l’ablation, on fait une
scintigraphie du corps entier (TBS, Total Body
Scan) dans le but de dépister d’éventuelles mé-
tastases encore inconnues. Un dosage de la thy-
roglobuline est en outre effectué, car c’est un pa-
ramètre important de l’évolution. Les patients ne
doivent avoir pris aucune hormone thyroïdienne
pendant plusieurs semaines (but: TSH >30 mU/l),
aucun iode (attention: le produit de contraste
radiologique prend au moins 1–2 mois pour être
éliminé) et, pour des raisons légales (loi sur la
radioprotection), ils doivent être hospitalisés
dans des chambres de radioprotection spéciales
(3–5 jours). La dose est déterminée par les spé-
cialistes en médecine nucléaire en fonction du
risque (en général 3700 MBq). Le tableau 2 p
montre quels patients devraient bénéficier d’une
ablation à l’iode radioactif [13].
Grossesse et allaitement sont des contre-indications
absolues à un traitement à l’iode radioactif. Les
femmes ne doivent en outre pas tomber enceintes
dans les 12 mois qui suivent un tel traitement.
chée ou de l’œsophage) qu’une IRM peut égale-
ment être indiquée en vue de la préparation à
l’intervention.
Classification
La classification se base sur le système de l’UICC
(Union Internationale Contre le Cancer) de 2002,
basé quant à lui sur le système TNM, combiné
avec l’âge du patient lors du diagnostic. Cette
Tableau 2. Indication à l’ablation à l’iode radioactif en fonction du risque [13].
Patients à très faible risque: Aucun avantage prouvé
carcinomes différenciés unifocaux ≤1 cm N0 M0
Patients à faible risque: Récidives peut-être moins nombreuses,
T 1–2 cm N0 M0 évidence non définitive
T2 N0 M0
Patients à haut risque: Preuve évidente de récidives moins
tous les T3 et T4 nombreuses et de mortalité abaissée
tous les T N1 M1
Tableau 1. Classification TNM des carcinomes différenciés de la thyroïde de 2002
(AJCC, UICC 2002) et classification par stades en fonction des catégories de risque.
TNM
T1 Tumeur primaire ≤2 cm
T2 Tumeur primaire 2–4 cm
T3 Tumeur primaire >4 cm, à l’intérieur de la thyroïde ou envahissement
extrathyroïdien minime
T4a Tumeur primaire de toute taille avec envahissement au-delà de la capsule
thyroïdienne et invasion du tissu sous-cutané, du larynx, de la trachée,
de l’œsophage ou du nerf récurrent
T4b Tumeur avec invasion du fascia prévertébral ou manchon autour de la carotide
ou de vaisseaux médiastinaux
TXN0 Volume de la tumeur primaire inconnu mais pas d’envahissement extrathyroïdien
N0 Pas d’envahissement ganglionnaire
N1a Métastases ganglionnaires niveau VI (prétrachéales, paratrachéales, prélaryngées,
ganglions de Delphes)
N1b Métastases ganglionnaires autres niveaux unilatérales, bilatérales, controlatérales,
cervicales ou médiastinales supérieures
NX Status ganglionnaire lymphatique inconnu
M0 Aucune métastase à distance
M1 Métastases à distance
MX Status métastatique inconnu
Stage Patient de moins de 45 ans Patient de plus de 45 ans
Stage I Tous les T, tous les N, M0 T1, N0, M0
Stage II Tous les T, tous les N, M1 T2, N0, M0
Stage III T3, N0, M0
T1, N1a, M0
T2, N1a, M0
T3, N1a, M0
Stage IVA T4a, N0, M0
T4a, N1a, M0
T1, N1b, M0
T2, N1b, M0
T3, N1b, N0
T4a, N1b, M0
Stage IVB T4b, tous les N, M0
Stage IVC Tous les T, tous les N, M1
818-822 Binz 132_f.qxp 9.10.2008 13:02 Uhr Seite 820

CABINET Forum Med Suisse 2008;8(43):818–822 821
métastases pulmonaires. La survie à 10 ans des
patients ayant des métastases est d’environ 40%.
Suppression de la TSH
La thérapie visant la suppression de la TSH a les
objectifs suivants: 1) la substitution des patients
athyroïdiens par la thyroxine et 2) l’inhibition de
la prolifération d’éventuelles cellules tumorales
encore présentes, dépendantes de la TSH.
Un traitement suppresseur se fait par la lévothy-
roxine, avec pour but d’atteindre un taux de TSH
90,1 mU/l (ou même <0,01 mU/l chez les patients
à haut risque), avec des taux de FT4 dans les
normes supérieures. Le premier dosage de la
TSH devrait se faire après 3 mois, et ensuite tous
les 6–12 mois.
Un tel traitement suppresseur est certainement
indiqué chez les patients ayant une activité tu-
morale persistante (radiologiquement visible ou
chez les patients positifs pour la thyroglobuline).
Chez les patients à haut risque ayant atteint une
rémission après traitement initial, le traitement
suppresseur sera poursuivi durant 3–5 ans. Chez
ceux à faible risque (microcarcinome ou stade I),
et ceux ayant obtenu une guérison, le risque de
récidive est minime (<1%). La dose de lévothy-
roxine peut alors être adaptée de manière à at-
teindre un taux de TSH dans les normes infé-
rieures (0,5–1,0 mU/l) [14].
Les effets indésirables les plus fréquents d’une
hyperthyroïdie subclinique induite sont des com-
plications cardiaques (fibrillation auriculaire, in-
suffisance cardiaque et augmentation de la mor-
talité cardiovasculaire), sans oublier une baisse
de la densité osseuse. Donc, chez les patients très
âgés et ceux souffrant de cardiopathies, il faut
renoncer à un traitement suppresseur trop agres-
sif. Il s’agit, ici aussi, de traiter les patients en
fonction de leurs risques.
Les autres formes de traitement, comme la radio -
thérapie externe ou la chimiothérapie, n’ont pas
leur place dans le traitement du carcinome thy-
roïdien différencié, exception faite des tumeurs
inopérables ou réfractaires à l’iode radioactif.
Contrôles
Un consensus européen pour le traitement et le
suivi du carcinome thyroïdien différencié a été
élaboré et publié en 2004 (fig. 1 x[12]). Il repose
pour l’essentiel sur la détermination du taux sé-
rique de thyroglobuline (basale et stimulée par
TSH), l’échographie et la scintigraphie à l’iode ra-
dioactif.
Nous recourons depuis peu à la rhTSH (TSH re-
combinante humaine), qui remplace la stimula-
tion par la TSH endogène après 6 semaines de
sevrage de lévothyroxine. Cette stimulation par
rhTSH permet de doser la thyroglobuline (Tg) et
de faire une scintigraphie du corps entier à visée
diagnostique. Il est même possible d’entrepren-
Il est depuis peu également possible d’effectuer
l’ablation à l’iode radioactif après injection de TSH
recombinante [14], ce qui permet d’éviter l’inter-
ruption des hormones thyroïdiennes et les symp-
tômes parfois invalidants d’une hypothyroïdie.
Les métastases à distance, en général pulmo-
naires ou osseuses, se voient chez 10–15% des
patients ayant un carcinome différencié de la thy-
roïde. Pratiquement tous les patients ayant des
métastases ont un taux sérique de thyroglobuline
augmenté, et les deux tiers captent l’iode 131
dans leurs métastases. Le traitement des grands
foyers métastatiques est chirurgical, de même
que celui des complications neurologiques ou
orthopédiques. Les autres patients sont traités
par plusieurs doses d’iode 131 (en général tous
les 4–6 mois). Les patients jeunes ont un bon pro-
nostic de même que ceux qui n’ont que des micro-
Strumectomie totale et ablation à l’iode 131
Evaluation au moment de l’ablation:
Scintigraphie du corps entier postthérapeutique – examen clinique – Tg:
aucune preuve de maladie
Contrôles après 3 mois:
TSH, Tg, FT3 sous lévothyroxine, échographie cervicale, examen clinique:
aucune preuve de maladie
Contrôles après 6–12 mois:
Tg après stimulation par rhTSH, échographie cervicale, examen clinique,
en cas de scintigraphie postthérapeutique positive
Tg non dosable Tg dosable, Tg dosable (ou >norme
aucune autre mais <norme interne interne) et/ou
particularité et aucune autre particularité autre particularité
Diminuer dose de LT4 Répéter Tg après Arrêter la LT4; traitement par
évaluation au moins annuelle stimulation par rhTSH iode radioactif à haute dose
Tg sous LT4 ± échographie** au moins chaque année* et/ou chirurgie
TBS posttraitement
Tg en baisse Tg stable ou en augmentation
Légende
Tg thyroglobuline
rhTSH TSH humaine recombinante
FT3 triiodothyronine libre
LT4 lévothyroxine
Norme interne la norme pour la thyroglobuline doit être fixée par le laboratoire interne pour
chaque méthode de dosage.
Echographie tout élément suspect doit être précisé par une FNAC ou d’autres examens.
cervicale
TBS scintigraphie du corps entier
* cet intervalle dépend du taux de Tg et du contexte clinique
** certains experts proposent un second dosage de la Tg après stimulation
par rhTSH après 2–5 ans au plus
Figure 1
Traitement et suivi du carcinome différencié de la thyroïde, légèrement modifié d’après
le consensus européen [12].
818-822 Binz 132_f.qxp 9.10.2008 13:02 Uhr Seite 821

CABINET Forum Med Suisse 2008;8(43):818–822 822
Conclusions
Le carcinome différencié de la thyroïde est une
tumeur rare dont le pronostic est bon. La palpa-
tion et l’échographie, avec ponction à l’aiguille
fine, permettent la plupart du temps d’en poser
le diagnostic précocement. Le traitement de choix
d’un carcinome de plus de 1,5–2 cm de diamètre
est la strumectomie, généralement (en fonction
du risque) suivie d’un traitement d’ablation à
l’iode radioactif. La suppression par la lévothy-
roxine joue un rôle important, surtout dans les
situations à haut risque, mais ne doit être entre-
prise que de manière différenciée, en fonction du
patient. Le patient peut ensuite être contrôlé par
examen clinique, échographie et dosage du taux
de thyroglobuline. Dans les situations à très haut
risque, il est possible d’envisager un dosage de
la thyroglobuline après stimulation par la rhTSH,
éventuellement avec scintigraphie du corps en-
tier. En cas de très haut risque ou de métastases,
un nouveau traitement par iode radioactif lui fera
suite. La prise en charge et le suivi de ces patients
se feront de préférence sur le mode interdisci -
plinaire et dans des centres spécialement orga-
nisés pour ce faire, avec des spécialistes en
chirurgie, médecine nucléaire, pathologie et en-
docrinologie.
dre un traitement au iode radioactif dans des cas
spéciaux [15, 16]. La stimulation par rhTSH est
moins lourde, les patients ne sont pas obligés
d’interrompre leur travail, mais la rhTSH est
chère (Thyrogen®, Genzyme, coûte 1680.55 francs,
situation septembre 2007). En Suisse, elle est prise
en charge par les caisses maladie comme presta-
tion obligatoire pour deux injections, actuellement
uniquement pour l’utilisation du iode radioactif à
des fins diagnostiques (stimulation de la Tg, TBS)
et non thérapeutiques.
La condition à l’utilisation de la rhTSH est de dis-
poser d’un test de la thyroglobuline sensible avec
mesure de la récupération (problème d’interfé-
rence avec les anticorps anti-thyroglobuline), de
manière à atteindre une sensibilité et une spéci-
ficité suffisantes. Ce test n’est pas effectué de rou-
tine dans tous les laboratoires.
L’échographie de la région cervicale joue un rôle
important également dans le suivi, car entre des
mains expertes sa sensibilité est très élevée pour
déceler les récidives, en général locales (loge
thyroïdienne ou ganglions cervicaux). Une FNAC
sous contrôle échographique doit être faite pour
chaque nodule suspect. Théoriquement, les pa-
tients devraient être contrôlés pour la plupart
chaque année ou tous les deux ans à long terme
(>10 ans). Cela n’a pas de sens chez les patients
âgés ou ceux ayant un risque de récidive très fai-
ble, et l’échographie peut être remplacée par une
simple palpation.
Références
1 Schweizerisches Krebsregister, Globocan 2002, www.vskr.ch
2 Verkooijen HM, Fioretta G, Pache JC, Francesci S, Raymond
L, Schubert H, et al. Diagnostic changes as a reason for the
increase in papillary thyroid cancer incidence in Geneva,
Switzerland. Cancer Causes Control. 2003;14(1):13–7.
3 Schlumberger MJ. Papillary and follicular thyroid carcinoma.
N Engl J Med. 1998;338(5):297–306.
4 Triponez F, Simon S, Robert J, Andereggen E, Ussel M,
Bouchardy C, et al. Thyroid Cancer: the Geneva experience.
Ann Chir. 2001;126(10):969–76.
5 Boice JD, Thyroid disease 60 years after Hiroshima and
20 years after Chernobyl. JAMA. 2006;295:1011–2.
6 Gemsenjäger E, Heitz PU, Seifert B, Benedict M, Schweizer
I. Differentiated thyroid carcinoma. Swiss Medical Weekly.
2001;131:157–63.
7 Gemsenjäger E, Perren A, Seifert B, Schüler G, Schweizer I,
Heitz PU. Lymph node surgery in papillary thyroid carcinoma.
Am Coll Surg. 2003;197:182–90.
8 Rago T, Vitti P, Chiovato L, Mazzeo S, De Liperi A, Miccoli P,
et al. Role of conventional ultrasonography and color flow-
doppler sonography in predicting malignancy in “cold” thy-
roid nodules. Eur J Endocrinol. 1998;138(1):41–6.
9 Papini E, Giuglielmi R, Bianchini A, Crescenzi A, Taccogna
S, Nardi F, et al. Risk of malignancy in nonpalpable thyroid
nodules: predictive value of ultrasound and colour doppler.
Clin Endocrinol Metab. 2002;87(5):1941–6.
10 Petite Ch, Meier CA. Nodules thyroïdiens et goitres: le traite-
ment chirurgical. Schweiz Med Forum. 2004;4:1090–6.
11 Meier CA. Thyroid nodules: pathogenesis, diagnosis and
treatment. Baillière’s Clinical Endocrinology and Metabolism
2000; Vol14, No4, pp 559–75. London, Baillière Tindall.
12 Pacini F, Schlumberger M, Dralle H, Elisei R, Smit J, Wier -
singa W. et al. European consensus for the management of
patients with differentiated thyroid carcinoma of the folli -
cular epithelium. Eur J Endocrinol. 2006;154:787–803.
13 Pacini F, Schlumberger M, Harmer C, Berg GG, Cohen O, Duntas
L, et al. Post-surgical use of radioiodine in patients with papil-
lary and follicular thyroid cancer and the issue of remnant abla-
tion: a consensus report. Eur J Endocrinol. 2005;153(5):651–9.
14 Cooper DS, Specker B, Ho M, Sperling M, Ladenson PW, Ross
DS, et al. Thyrotropin suppression and disease progression
in patients with differentiated thyroid cancer: results from
the National Thyroid Cancer Treatment Cooperative Reg-
istry. Thyroid. 1998;8(9):737–44.
15 Haugen B, Pacini F, Reiners C, Schlumberger M, Ladenson P,
Sherman SI. A comparison of recombinant human thyro tropin
an thyroid hormone withdrawal for the detection of thyroid rem-
nant or cancer. J Clin Endocrinol Metab. 1999; 84:3877–85.
16 Kloos R, Mazzaferri EL. A single recombinant human thyro -
tropin-stimulated serum thyroglobin measurement predicts
differentiated thyroid carcinoma metastases three to five
years later. J Clin Endocrinol Metabol. 2005;90:5047–57.
Correspondance:
Dr Katharina Binz
FMH Endokrinologie-Diabetologie
Stockerstrasse 42
CH-8002 Zürich
kathar[email protected]
818-822 Binz 132_f.qxp 9.10.2008 13:02 Uhr Seite 822
1
/
5
100%