Fredette_et_al_2012_travaildirige

DÉMYSTIFIER LA PROBLÉMATIQUE DE L’ÉPAULE HÉMIPLÉGIQUE
DOULOUREUSE
COMPRENANT :
Mécanismes neurologiques centraux et leurs rôles dans le développement de la douleur à
l’épaule post-AVC
Par ANNIE PIER-FREDETTE
Mécanismes périphériques et facteurs personnels impliqués dans la douleur à l’épaule
post-AVC
Par STÉPHANIE LEBEL
Évaluation et pronostic fonctionnel de la douleur à l’épaule post-AVC
Par GABRIELLE PEDNEAULT
Prévention et traitement de la douleur à l’épaule post-AVC
Par VANESSA RONDEAU
PRÉSENTÉ À :
ROBERT FORGET &
CAROLLE LAVALLÉE
DANS LE CADRE DU COURS PHT-6113
UNIVERSITÉ DE MONTRÉAL
JEUDI LE 31 MAI 2012

2
Table des matières
Abrégé ............................................................................................................................... 6
1. Introduction ................................................................................................................. 7
2. Mécanismes neurologiques centraux et leurs rôles dans le développement de la
douleur à l’épaule post-AVC ............................................................................................ 10
2.1 Voies anatomiques et les mécanismes centraux de la douleur .................................. 10
2.2 Neuroplasticité et ses relations avec la chronicité ...................................................... 13
2.2.1 Syndrome de la douleur centrale accompagnant la douleur thalamique ................. 13
Théorie de la désinhibition centrale .................................................................................. 14
Théorie de la sensibilisation centrale ............................................................................... 15
Réorganisation centrale ................................................................................................... 16
2.2.2 Syndrome régional complexe de type 1 comme complication post-AVC ................ 17
Syndrome douloureux régional complexe accompagnant ou non l’AVC .......................... 17
Syndrome douloureux régional complexe de type 1 secondaire à un AVC ...................... 18
Pathophysiologie périphérique du SDRC ......................................................................... 19
Pathophysiologie centrale du SDRC et réorganisation corticale ....................................... 20
2.3 Les facteurs de risques centraux liés au développement de la douleur à l’épaule post-
AVC ................................................................................................................................. 21
2.4 Conclusion ................................................................................................................. 22
3. Mécanismes périphériques et facteurs personnels impliqués dans la douleur à
l’épaule post-AVC ............................................................................................................ 24
3.1 Physiopathologie des troubles de tonus lies à l’AVC .................................................. 24

3
3.1.1 Hypotonie ............................................................................................................... 25
3.1.2 Hypertonie ............................................................................................................. 25
3.2 Troubles de contrôle moteur ...................................................................................... 27
3.2.1 Perte de fonctions motrices .................................................................................... 27
3.2.2 Recrutement musculaire inadéquat ........................................................................ 27
3.3 Biomécanique normale de l’épaule ............................................................................ 28
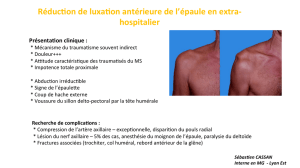
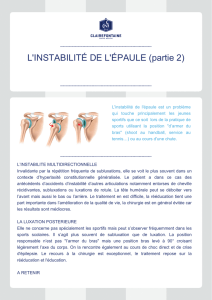
3.4 Subluxation gléno-humérale ...................................................................................... 29
3.4.1 Subluxation ............................................................................................................. 30
3.4.2 Lien entre la subluxation et la douleur ..................................................................... 30
3.5 Capsulite adhésive ..................................................................................................... 31
3.6 Lésions au niveau de la coiffe des rotateurs .............................................................. 32
3.7 Facteurs personnels pouvant encourager l’apparition de la douleur à l’épaule post-
AVC ................................................................................................................................. 34
3.8 Conclusion ................................................................................................................. 34
4. Évaluation et pronostic fonctionnel de la douleur à l’épaule post-AVC ...................... 36
4.1 Principaux questionnaires et échelles de la douleur ................................................... 36
4.1.1 Échelles de la douleur ............................................................................................ 37
Échelle visuelle analogue (EVA) ...................................................................................... 37
Échelle numérique (NRS) ................................................................................................ 38
Échelle verbale (VRS) ...................................................................................................... 38
Faces Pain Scale (FPS) ................................................................................................... 39
4.1.2 Questionnaire sur la douleur ................................................................................... 39
Questionnaire McGill sur la douleur ................................................................................. 39
Mesure de la douleur à l’épaule hémiplégique : Shoulder Q ............................................ 40
4.2 Décrire l’évaluation de l’épaule hémiplégique douloureuse ........................................ 41
4.2.1 Histoire du patient ................................................................................................... 41

4
4.2.2 Évaluation subjective .............................................................................................. 41
4.2.3 Évaluation objective ................................................................................................ 41
Observations générales et spécifiques ............................................................................ 41
Palpation .......................................................................................................................... 42
Mobilité ............................................................................................................................ 42
Force ............................................................................................................................... 43
Spasticité ......................................................................................................................... 43
Proprioception.................................................................................................................. 44
Sensibilité ........................................................................................................................ 44
Tests spécifiques : Neer .................................................................................................. 45
Transferts ........................................................................................................................ 45
Fonction sensori-motrices et d’autonomie fonctionnelle ................................................... 46
Imagerie........................................................................................................................... 47
4.3 Discuter du pronostic fonctionnel pour un patient post-AVC avec douleur à l’épaule . 49
4.3.1 Évolution de la douleur à travers le temps ............................................................... 49
4.3.2 Impact sur la fonction du membre supérieur ........................................................... 49
4.3.3 Impact psychologique et qualité de vie .................................................................... 50
4.4 Conclusion ................................................................................................................. 50
5. Prévention et traitement de la douleur à l’épaule post-AVC ...................................... 52
5.1 Prévention de la douleur à l’épaule post-AVC en physiothérapie ............................... 52
5.2 Traitement de la douleur à l’épaule post-AVC en physiothérapie ............................... 55
5.2.1 Soulagement de la douleur locale ........................................................................... 56
5.2.2 Traitement d’une épaule douloureuse lors d’une subluxation .................................. 57
5.2.3 Traitement d’une épaule douloureuse lors d’un problème de tonus......................... 59
Hypotonie ........................................................................................................................ 59
Hypertonie ....................................................................................................................... 60

5
5.2.4 Traitement d’une épaule douloureuse lors d’une atteinte de la coiffe des rotateurs . 61
5.2.5 Traitement d’une épaule douloureuse lors de douleur centrale ............................... 62
5.3 Modalités émergentes dans le traitement de la douleur à l’épaule post-AVC en
physiothérapie ................................................................................................................. 63
5.4 Multidisciplinarité dans la douleur à l’épaule post-AVC .............................................. 64
5.4.1 Interventions médicales et pharmacologiques à l’épaule douloureuse .................... 64
5.4.2 Interventions chirurgicales à l’épaule douloureuse .................................................. 66
5.4.3 Interventions en ergothérapie à l’épaule douloureuse ............................................. 67
5.4.4 Interventions en soins infirmiers à l’épaule douloureuse ......................................... 67
5.4.5 Interventions en psychologie pour le traitement de l’épaule douloureuse ................ 67
5.5 Conclusion ................................................................................................................. 67
6. Discussion ................................................................................................................ 69
6.1 Limites du travail ........................................................................................................ 69
6.2 Lien entre la pathophysiologie, la prévention, l’évaluation et le traitement de la douleur
à l’épaule post-AVC ........................................................................................................ 70
7. Conclusions .............................................................................................................. 74
8. Références ............................................................................................................... 75
ANNEXE 1 – ShoulderQ .................................................................................................. 87
ANNEXE 2 – Ability Q ...................................................................................................... 88
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
1
/
88
100%