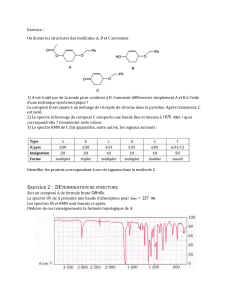
PREPARATION DU 2-METHYLBUT-2-ENE I - PRINCIPE II - MODE OPERATOIRE 1) Préparation

PREPARATION DU 2-METHYLBUT-2-ENE
I - PRINCIPE
On veut réaliser une réaction de déshydratation d’un alcool, le 2-méthylbutan-2-ol, en alcène,
le 2-méthylbut-2-ène.
II - MODE OPERATOIRE
1) Préparation
Dans un tricol de 100 mL, introduire successivement 31 mL de 2-méthylbutan-2-ol, quelques billes de verre (ou
grains de pierre ponce), et par petites quantités, 10 mL d’acide orthophosphorique à 85%.
Le ballon, placé dans un chauffe ballon, est surmonté de tous les accessoires nécessaires à une distillation
simple.
Le distillat sera recueilli dans un ballon « cœur » placé dans un bain de glace.
Chauffer graduellement jusqu’à ce que le débit de distillat soit négligeable. La température en tête de colonne ne
doit pas dépasser 55°C.
Décanter le distillat.
Laver avec une solution à 10% d’hydroxyde de sodium, puis avec de l’eau jusqu’à neutralité.
Sécher la phase organique avec du sulfate de magnésium anhydre et réaliser un test de séchage.
2) Purification
Rectifier le 2-méthylbut-2-ène préparé.
Peser le produit obtenu.
3) Caractérisation du 2-méthylbut-2-ène
Mesurer son indice de réfraction.
Réaliser un test chimique de caractérisation des alcènes.
Réaliser un spectre IR et une CPG.

III - DONNEES
- Acide orthophosphorique à 85% : corrosif, provoque de graves brûlures.
- Solution à 10% d’hydroxyde de soduim : solution corrosive pour la peau et les yeux.
- 2-méthylbutan-2-ol : M = 88 g.mol -1 Eb 760 = 102°C d = 0,809
solubilité dans l’eau : 14% en masse à 30°C
inflammable et nocif par contact ou inhalation
azéotrope à 27,5% d’eau Eb 760 = 87,4°C.
- 2-méthylbut-2-ène : M = 70 g.mol -1 Eb 760 = 38,5°C d = 0,662
solubilité dans l’eau : très peu soluble
très inflammable.
IV - COMPTE-RENDU
1) Présentation des résultats
a) Aspect du 2-méthylbut-2-ène rectifié.
b) Masse du 2-méthylbut-2-ène rectifié.
c) Indice de réfraction du 2-méthylbut-2-ène rectifié.
d) Courbe de rectification ; bilan de rectification.
2) Questions sur la préparation
a) Donner l’équation de la réaction de déshydratation.
b) Quel est le rôle de l’acide phosphorique ?
c) Justifier la nécessité de recueillir le distillat dans un bain de glace.
d) Calculer la masse théorique de produit.
e) En déduire le rendement de la manipulation en produit purifié.
f) Proposer un test chimique de caractérisation des alcènes. Ecrire l’équation de la réaction correspondante.
g) Quel isomère peut se former en petite quantité lors de la déshydratation ? (nom et formule)
3) IR et RMN - CPG
a) Interpréter le spectre IR du 2-méthylbut-2-ène. Donner la preuve de l’absence d’alcool dans le produit réalisé.
b) Interpréter le spectre RMN du 2-méthylbut-2-ène.
c) Attribuer les deux pics obtenus en CPG.

Spectres IR et RMN du 2-méthylbut-2-ène :
CHIMIE ORGANIQUE EXPERIMENTALE - M. Chavanne – A. Jullien – G.J. Beaudoin – E. Flamand
Edition BELIN, p. 660.


1
/
5
100%