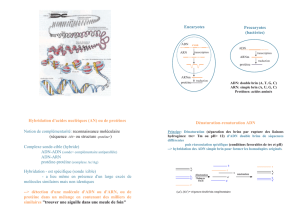
HYBRIDATIONS

HYBRIDATIONS
(Southern et Northern)
La sonde radioactive, dénaturée à la chaleur lorsque elle est double brin, est utilisée à une
concentration finale de l'ordre de 106 cpm/ml (105 cpm/ml pour les minisatellites). Avant toute utilisation,
les filtres sont déhybridés à la soude 0.4 N deux fois 20 min., puis neutralisés en T.E. Ils sont ensuite mis en
tubes à hybridation deux par deux dos à dos et entre deux drains (sinon la sonde radioactive ne passera pas
entre les deux filtres). Il est nécessaire de préincuber les filtres au moins 15 minutes avant d'ajouter la sonde
(préhybridation). Pour la préparation du tampon de préhybridation et d'hybridation voir "Préparation des
solvants et milieux" (ADN: 2% SDS; ARN: 5% SDS).
Pour un tube, prévoir entre 3ml (un filtre) 20 ml (8 à 10 filtres 20x30 dans tubes 35 cm) et 30 ml (30
ou 40 filtres taille Eurogem) de tampon .
Les températures d'hybridation, préhybridation, lavages sont fonctions des stringences cherchées.
La formule empirique permettant d'estimer la stabilité d'un duplex ADN:ADN en fonction de la
longueur (L) des fragments, la composition en nucléotides, la concentration en ions Na+ (en M) et
formamide (en %) du milieu d'hybridation est la suivante :
Tm = 81.5 + 0.41 (%G+C) + 16.6 log (Na+)- 0.63 (%form) - (300 + 2000 (Na+))/L
Temps de préhybridation : 15 min. minimum
Temps d'hybridation : la nuit
Pour des séquences parfaitement homologues, l'hybridation se fait à 65°C.
Conditions stringentes de lavage: 68°C- 0,1 SSC (0,1% SDS)
Les filtres sont ensuite mis en sac plastique soudable, et exposés avec un film Kodak XAR5 ou Fuji
RX avec écrans amplificateurs (nécessite alors une exposition à -70°C) ou sans écran amplificateur.
1) Hybridation dans un four
Cette méthode apporte une nette amélioration par rapport à l'hybridation en sac, dès lors que les
lavages sont effectués classiquement dans un bain-marie.
Les membranes sont interposées entre des drains, qui sont nécessaires à la bonne circulation du
tampon d'hybridation, l'ensemble est ensuite enroulé sur lui-même et disposé dans le tube.
Il n'est pas nécessaire de renouveler le tampon après la préhybridation.
Dans certains cas, les sondes utilisées contiennent des séquences répétées en plus de séquences
uniques. Il est alors nécessaire (et pas toujours suffisant), lors d'une hybridation sur filtre d'ADN
génomique humain, par exemple, de neutraliser les séquences répétées. Une méthode utilisée consiste à
ajouter un large excès (2000 fois) d'ADN génomique total soniqué. (protocole décrit par Blonden et al.,
dans NAR vol. 17, n° 14, p. 5611-562).
Deux choses changent par rapport au protocole habituel :
1- Après marquage de la sonde, de l'ADN total est ajouté, le mélange est dénaturé puis préincubé à
65°C avant l'hybridation.
2- Le tampon d'hybridation peut être différent.

2) Renaturation de la sonde avec l'ADN total
Après marquage et séparation sur sephadex G 75, ajouter 100 µg d'ADN de placenta (Sigma;
soniqué à une taille de 500-800 pb ou cassé par autoclavage 110°C, 10 minutes) en 6xSSC final, dénaturer
10 min. dans l'eau bouillante et laisser 1h30 min. à 65°C.
Le tampon d'hybridation est par exemple 0,125 M Na2HPO4 (pH : 7,2), 0,25 M NaCl, 1 mM EDTA,
2% SDS, 10% PEG 6000.
3) Déhybridation
A faire juste avant l'hybridation. Les membranes se conservent mieux à 4°C en sac d'exposition
soudé, le SDS de la solution de lavage empêche le développement de champignons.
1 ou 2 bains NaOH 0,4 N (20 minutes)
2 ou trois bains TE 10:1 pH : 8 ou 7.5 (20 minutes)
Changer les membranes de bain en les transférant une par une. En particulier dans le cas de
membranes neuves, éviter que des membranes se touchent sous peine de "décalcomanies".
Dans le cas de signaux récalcitrants sur blots de type hydrolyses de plasmides on peut faire le bains
de soude à 42°C, ou plonger la membrane dans SDS 0.5% 100°C et laisser refroidir, puis 2 bains de TE. Ce
traitement endommage la membrane. Pour un blot précieux, il sera préférable d’attendre que la radioactivité
fixée se soit atténuée (qq semaines ou qq mois).
1
/
2
100%