Risperidon Paliperidon DHPC -f

Zoug, juin 2013
Informations importantes concernant la sécurité de Risperdal®
(rispéridone), Risperdal Consta® (rispéridone), Invega® (palipéridone) et
Xeplion® (palmitate de palipéridone):
syndrome de l’iris hypotonique peropératoire (intraoperative floppy iris
syndrome, IFIS)
Docteur,
En accord avec Swissmedic, nous souhaitons attirer votre attention sur de nouvelles
informations importantes concernant la sécurité dans les informations professionnelles de
RISPERDAL® (rispéridone), RISPERDAL® CONSTA® (rispéridone), INVEGA®
(palipéridone) et XEPLION® (palmitate de palipéridone) au sujet du risque de
développement d’un syndrome d’iris hypotonique peropératoire (IFIS) au cours d’une
chirurgie de la cataracte.
Résumé
La présente lettre a pour but d’attirer votre attention sur le risque de développement
d’un syndrome d’iris hypotonique peropératoire (IFIS) chez les patients traités par les
médicaments susmentionnés pendant ou après une chirurgie de la cataracte.
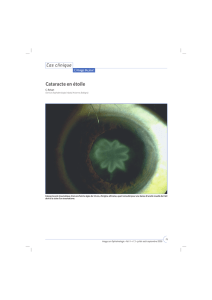
• L’IFIS est une complication peropératoire qui n’a été décrite que récemment dans
le cadre de la chirurgie de la cataracte. Il se manifeste par une triade
peropératoire spécifique à l’intensité variable (iris flasque qui ondule, myosis
peropératoire progressif et prolapsus potentiel de l’iris vers le cristallin et vers
l’incision des ouvertures latérales). L’IFIS est associé à une fréquence accrue de
complications de chirurgie de la cataracte telles que rupture de la capsule
postérieure du cristallin et perte du vitré.
• En cas de suspicion d’un IFIS, il convient le cas échéant d’adapter la technique
opératoire. De plus, il est conseillé d’adopter une procédure chirurgicale prudente
dans le cadre de l’opération de la cataracte.
• Dans le cadre de l’anamnèse médicamenteuse précédant la chirurgie de la
cataracte, il est recommandé de questionner les patients au sujet de l’utilisation
actuelle ou passée des médicaments susmentionnés.
• Selon les données post-marketing, la fréquence estimée des annonces d’un IFIS
en lien avec la rispéridone se situe entre 1/1000 et 1/10 000 (rare). Aucune
annonce n’a été faite pour la palipéridone, mais, selon l’estimation du fabricant,
son profil de sécurité est suffisamment proche de celui de la rispéridone pour
qu’elle soit mentionnée dans la présente mise en garde.
• La rubrique «Mises en garde et précautions» des informations professionnelles des
médicaments susmentionnés a été complétée de la manière suivante:

Des cas de syndrome d’iris hypotonique peropératoire (IFIS) ont été observés lors
d’opérations de la cataracte chez des patients traités par des médicaments dotés d’un
effet antagoniste sur les récepteurs α1-adrénergiques, y compris Risperdal et Risperdal
Consta ou par exemple tels qu’Invega et Xeplion.
L’IFIS peut augmenter le risque de complications oculaires pendant et après
l’intervention. Avant l’intervention, le chirurgien ophtalmologue doit être informé de la
prise actuelle ou antérieure de médicaments dotés d’un effet antagoniste sur les
récepteurs α1-adrénergiques. Le bénéfice potentiel de l’interruption du traitement par les
antagonistes α1 avant l’opération de la cataracte n’a pas été étudié et doit être évalué
par rapport au risque d’une interruption du traitement antipsychotique.
Autres informations et recommandations importantes pour la sécurité
Dans le cadre de la pharmacovigilance effectuée en routine par le fabricant, une
augmentation de la fréquence des annonces d’IFIS a été observée sous RISPERDAL. La
vérification de l’ensemble de la base de données de sécurité du fabricant a révélé 6 cas
d’IFIS lors de l’utilisation de rispéridone. Dans 2 des 6 cas, il existait un lien plausible
entre le traitement par rispéridone et l’IFIS. Chez ces deux patients ayant développé les
caractéristiques typiques d’un IFIS au cours d’une chirurgie de la cataracte, l’anamnèse
médicamenteuse ne comprenait pas d’autres antagonistes des récepteurs α1-
adrénergiques et la rispéridone était administrée à long terme. Dans l’un des deux cas,
l’opération de la cataracte réalisée 4 mois plus tard sur le deuxième œil, toujours sous
rispéridone, a à nouveau conduit à la survenue d’un IFIS.
La littérature spécialisée mentionne des cas d’IFIS survenus en lien avec l’utilisation
d’antipsychotiques dotés d’une activité antagoniste sur les récepteurs α-adrénergiques, y
compris la rispéridone. La rispéridone est un antagoniste monoaminergique sélectif
présentant une forte affinité pour les récepteurs α-adrénergiques; d’un point de vue
biologique, un lien avec la survenue d’un IFIS semble donc plausible.
Annonce en cas de suspicion d’effets indésirables médicamenteux
Nous vous prions d’adresser vos éventuelles annonces d’effets indésirables à l’aide du
formulaire d’annonce ad hoc au centre régional de pharmacovigilance. Le formulaire
d’annonce peut être téléchargé sur le site internet de Swissmedic (www.swissmedic.ch →
Accès direct à → Annonces d’effets indésirables → Pharmacovigilance → Formulaire
«Annonce d’effets indésirables suspectés d’un médicament»). On peut également le
trouver dans l’annexe du Compendium Suisse des Médicaments ou le commander auprès
de Swissmedic (tél. 031 322 02 23).
Contact
Janssen fait tout son possible pour permettre une utilisation efficace et en toute sécurité
de ses produits et s’efforce de vous faire parvenir les dernières informations en sa
possession sur ses produits.
Si vous avez des questions ou si vous souhaitez obtenir d’autres informations, veuillez
contacter notre département médical (tél. 058 231 34 34).
Avec nos salutations les meilleures
Irene Breitmaier, pharm. dipl. Werner Spitznagel
Head Medical Affairs CNS/IMID Head Regul. & Medical Compliance
Janssen-Cilag AG Janssen-Cilag AG
1
/
2
100%