L Gliomatose cérébrale V O

La Lettre du Neurologue - n° 5 - vol. VII - mai 2003
176
VOCABULAIRE
Gliomatose cérébrale
●S. Cartalat-Carel*, J. Honnorat*
L
a gliomatose cérébrale se définit comme une tumeur
gliale infiltrante, envahissant au moins deux lobes céré-
braux, sans masse tumorale individualisable, avec pré-
servation des structures nerveuses. Cette infiltration tumorale
touche l’encéphale de façon extensive et souvent bilatérale, plus
rarement les structures infratentorielles, et exceptionnellement la
moelle épinière. Longtemps, le diagnostic de cette affection n’a
pu être porté que rétrospectivement après analyse des cerveaux
des patients décédés, et les cas rapportés étaient exceptionnels.
Avec le développement de l’imagerie cérébrale par résonance
magnétique, le diagnostic peut être évoqué du vivant des patients
et le nombre de cas décrits a fortement augmenté. On distingue
deux types de gliomatose cérébrale : des gliomatoses secondaires
qui correspondent à l’évolution infiltrative à distance d’une lésion
tumorale primitive individualisable, et des gliomatoses primitives
dans lesquelles aucune masse tumorale n’est individualisable
dans le parenchyme cérébral.
HISTORIQUE
La définition et l’histogenèse des gliomatoses ont toujours été
très discutées. Nevin, en 1938 (1),décrit la première gliomatose
cérébrale sous la forme d’une tumeur gliale étendue à l’ensemble
du cerveau sans formation d’une masse tumorale. Son histogenèse
incertaine est responsable de son classement jusqu’en 1979 dans
les tumeurs embryonnaires indifférenciées. Depuis 1979, avec la
classification des tumeurs de l’Organisation mondiale de la santé,
la gliomatose fait partie des tumeurs neuroépithéliales.
INCIDENCE, ÂGE ET SEXE
Peu de données épidémiologiques sont disponibles à ce jour et
l’incidence des gliomatoses cérébrales est donc inconnue. Les
deux sexes semblent atteints de façon équivalente. L’âge de début
est variable, suivant les séries, entre 34 et 50 ans (2). Certains
suggèrent qu’il existe deux pics de fréquence, à 45 et 60 ans (3).
SIGNES CLINIQUES
Les signes cliniques révélateurs de la maladie sont le plus souvent
des céphalées d’apparition progressive dans le cadre d’une hyper-
tension intracrânienne ou des crises d’épilepsie (4). À la phase
d’état, s’y ajoutent des signes déficitaires qui sont fonction de la
localisation lésionnelle.
EXAMENS COMPLÉMENTAIRES
Depuis le développement de l’IRM cérébrale, le diagnostic de
gliomatose est devenu plus simple et le nombre de patients décrits
a augmenté significativement. En IRM, les séquences de choix
sont les séquences FLAIR (fluid attenuated inversion recovery)
et les séquences pondérées T2 qui montrent un hypersignal
diffus. Les séquences pondérées T1 ne permettent pas de faire
le diagnostic de gliomatose. Parfois, le scanner montre une hypo-
densité périventriculaire ou un aspect d’œdème cérébral diffus
(effacement des sillons et ventricules de petite taille). Un effet de
masse localisé sur un hémisphère peut être observé. En général,
il n’y a pas de prise de contraste. Si elle existe, elle reste discrète.
DIAGNOSTIC DIFFÉRENTIEL
La présentation clinique des gliomatoses cérébrales est non spé-
cifique et la présentation radiologique est souvent trompeuse,
simulant un grand nombre de maladies neurologiques non tumo-
rales comme les maladies inflammatoires du SNC, les leuco-
encéphalopathies, les artérites. L’analyse histologique est donc
indispensable au diagnostic.
DIAGNOSTIC HISTOPATHOLOGIQUE
En raison de l’absence de masse tumorale identifiable, les prélè-
vements biopsiques sont souvent de petite taille. De ce fait, le
diagnostic histologique est souvent difficile, aussi bien pour grader
que pour reconnaître la nature astrocytaire ou oligodendrogliale
de la prolifération tumorale.
PATHOGÉNIE
La pathogénie des gliomatoses demeure inconnue. S’agit-il d’une
tumeur dont les cellules migrent et envahissent progressivement l’en-
semble du parenchyme cérébral, ou bien existe-t-il plusieurs foyers
de prolifération en relation avec une anomalie gliale génétique ?
TRAITEMENT
La prise en charge thérapeutique de ces patients est difficile. La
chirurgie n’est naturellement pas possible du fait de l’extension
lésionnelle et de l’intrication des cellules tumorales avec les tissus
* Service du professeur Trouillas, hôpital neurologique Pierre-Wertheimer, Lyon.

sains. La radiothérapie est une alternative possible, mais elle
nécessite un large volume d’irradiation. Les doses proposées
varient de 45 à 60 Gy. La médiane de survie est faible (11,4 mois),
de même que les taux de survie à un an (45 %) et deux ans (30 %)
(3). L’utilisation de la chimiothérapie, associée ou non à la radio-
thérapie, semble plus prometteuse. Des temps médians sans
progression de 16 mois et une médiane de survie de 32 mois,
ainsi que des réponses radiologiques et cliniques complètes, ont
été rapportés dans une série de 33 patients traités par chimio-
thérapie (5).
■
RÉFÉRENCES BIBLIOGRAPHIQUES
1.
Nevin S. Gliomatosis cerebri. Brain 1938 ; 61 : 170-91.
2.
Herrlinger U, Felsberg J, Kuker W et al. Gliomatosis cerebri : molecular
pathology and clinical course. Ann Neurol 2002 ; 52 : 390-9.
3.
Elshaik MA, Stevens GHJ, Peereboom DM et al. Gliomatosis cerebri : treatment
results with radiotherapy alone. Cancer 2002 ; 95 (9) : 2027-31.
4.
Kim DG, Yang HJ, Park IA. Gliomatosis cerebri : clinical features, treatment,
and prognosis. Acta Neurochir 1998 ; 140 : 755-62.
5.
Napolitano M, Gervais H, Louis E et al. Up-front chemotherapy (temozolomide,
PCV) in 33 patients with gliomatosis cerebri. Neuro-oncology 2002 ; 4 (1) : S68.
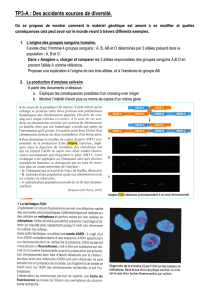
Figure 1. Patiente de 38 ans. Crises d’épilepsie généralisées associées à des céphalées en janvier 1998. En quelques mois s’installent une aphasie et un
déficit moteur de l’hémicorps droit, puis un syndrome frontal majeur et un mutisme. L’IRM montre un discret hyposignal de la capsule interne gauche en
séquence pondérée T1 (A). Les séquences pondérées T2 (B) et surtout les séquences FLAIR (C) permettent de préciser l’extension des lésions en montrant
un hypersignal diffus qui s’étend dans les régions fronto-pariétales gauche et dans la capsule interne. Ces séquences permettent également de visualiser
l’infiltration du corps calleux et de l’hémisphère droit. Lobectomie temporale droite en mai 1998 : oligodendrogliome infiltrant de grade II de l’OMS. La
patiente décède en février 1999.
Figure 2. Patient de 50 ans. Syndrome frontal progressif depuis plusieurs mois. L’IRM montre un hyposignal frontal droit en séquence pondérée T1 (A).
Aucune prise de contraste n’est visualisée. Les séquences pondérées T2 (B) et surtout les séquences FLAIR (C) permettent de préciser l’extension des
lésions en montrant un hypersignal diffus qui intéresse les deux régions frontales et le genou du corps calleux et qui s’étend le long des ventricules
latéraux jusque dans la région occipitale gauche. Biopsie frontale droite: oligoastrocytome de grade II de l’OMS. Chimiothérapie par témozolomide, 12 cures.
Stabilité clinique et radiologique 8 mois après la fin de la chimiothérapie.
La Lettre du Neurologue - n° 5 - vol. VII - mai 2003 177
1
/
2
100%