Ostéopathies médicamenteuses

La Lettre du Rhumatologue - n° 262 - mai 2000
21
ifférentes ostéopathies peuvent être engendrées par la
prise de médicaments. La plus fréquente et la plus pré-
occupante de ces ostéopathies est l’ostéoporose corti-
sonique, mais d’autres effets secondaires osseux méritent
d’être connus, afin d’éviter toute confusion entre les compli-
cations liées à la maladie elle-même et celles liées à son trai-
tement.
LES OSTÉOPOROSES
Ostéoporose cortico-induite
Il s’agit de la première cause d’ostéoporose secondaire, et
l’ef
fet délétère sur le tissu osseux des doses thérapeutiques de glu-
co
corticoïdes a été observé dès les premiers essais thérapeu-
tiques à partir de 1950. L’action néfaste des corticoïdes sur le
tissu osseux est complexe et relève de plusieurs processus (1,
2). Le plus important est l’inhibition très précoce de la fonc-
tion ostéoblastique qui réduit la capacité du tissu osseux à se
régénérer lors du cycle de remodelage osseux (3). Ce défaut
de formation est amplifié par une hyperrésorption osseuse de
pathogénie multiple (hyperparathyroïdie secondaire, diminu-
tion de sécrétion des hormones sexuelles, possible action
directe sur la vitamine D). L’hyperparathyroïdie secondaire
est liée à une moindre absorption du calcium par les cellules
intestinales induite par les glucocorticoïdes. La diminution de
la sécrétion des hormones sexuelles sous l’action des corti-
coïdes est liée à un blocage de la production hypophysaire de
LH, à une action directe sur les gonades, ainsi qu’à une baisse
de la production d’hormones sexuelles par les glandes surré-
nales (1, 2). Certains auteurs évoquent enfin une action directe
sur la vitamine D, mais cet effet est controversé.
La perte osseuse liée au traitement corticoïde a été étudiée par
toutes les méthodes de mesure de la masse osseuse. Celles-ci
permettent d’objectiver une diminution de la masse osseuse
qui varie de 10 à 40 % selon les types de mesure, la dose cumu-
lée de glucocorticoïdes et la maladie traitée (1, 2, 4). Les élé-
ments essentiels sont la précocité et la rapidité de la perte
osseuse (5 à 15 % après la première année de traitement en
fonction des études, de la dose, des maladies sous-jacentes et
des autres facteurs de risque associés). Cette perte porte prin-
cipalement sur l’os trabéculaire et est associée à des altéra-
tions microarchitecturales spécifiques de l’ostéoporose cor-
tico-induite (diminution globale et importante de l’épaisseur
des travées osseuses). La diminution de la masse osseuse est
cependant très variable d’un individu à l’autre et le pourcen-
tage de patients ne perdant pas de masse osseuse a été évalué
de 50 à 70 % selon les études (1, 2).
Si l’ostéoporose cortisonique est bien documentée avec les
corticoïdes de synthèse, aucune observation indiscutable d’os-
téoporose liée à la prise de cortisone naturelle (hydrocorti-
sone) n’a été décrite. Toutefois, certains auteurs (5) évoquent
la possibilité d’une diminution de la densité minérale osseuse
chez les patients mâles atteints de la maladie d’Addison, trai-
tés par hydrocortisone au long cours.
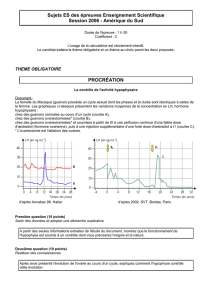
Les complications fracturaires de cette perte osseuse sont
des tassements vertébraux survenant chez plus d’un malade
sur trois et des fractures du col fémoral dont le risque est mul-
tiplié par deux (figure 1). Il ne semble pas exister de particu-
Ostéopathies médicamenteuses
!
R.M. Javier, J. Sibilia, J.L. Kuntz*
"La toxicité osseuse de certains médicaments
doit être parfaitement connue par le rhumato-
logue.
"
La recherche d’une exposition à ces médica-
ments doit être recherchée de façon systéma-
tique lors de l’interrogatoire de patients ayant
une ostéopathie déminéralisante.
"
La plus fréquente de ces ostéopathies est l’os-
téoporose cortisonique.
Mots-clés : Ostéopathies - Médicaments.
Points forts
*Service de rhumatologie, CHU Strasbourg.
MISE AU POINT
D

larité radiographique de l’ostéoporose cortisonique, même si
certains auteurs ont évoqué une fréquence accrue de bandes
d’ostéocondensation sous les plateaux vertébraux tassés (ano-
malies non spécifiques).
De façon générale, la perte osseuse est dose-dépendante
(particulièrement à partir de doses supérieures à 7,5 mg d’équi-
valent prednisone par jour) (4). La voie d’administration de la
corticothérapie peut jouer un rôle ; par exemple, les perfusions
intraveineuses semblent moins délétères, de même que les
voies locales. Par contre, les traitements à doses alternées ne
préviennent pas la perte osseuse. La dose minimale de corti-
coïdes n’entraînant pas de perte osseuse n’est pas déterminée
de façon certaine. Ces différents éléments ainsi que l’absence
de critères biologiques permettant de prédire l’intensité de la
perte chez un individu donné expliquent l’attitude pragma-
tique (logique bien que non consensuelle) qui consiste à mesu-
rer la densité minérale osseuse avant le début de tout traite-
ment corticoïde (même par voie inhalée). Si la densité minérale
osseuse est basse et si les risques de perte osseuse sont élevés
(dose importante, femme ménopausée, etc.), un traitement pré-
ventif est instauré d’emblée. Si la densité minérale osseuse est
normale, un nouveau contrôle densitométrique sera effectué
six à douze mois après le début de la corticothérapie.
Ostéoporose chez les transplantés
Le nombre de transplantations a augmenté considérablement
depuis l’arrivée d’immunosuppresseurs performants dans les
années 80, permettant ainsi de mettre en évidence l’importance
de l’ostéoporose chez les transplantés. Les conséquences frac-
turaires de cette ostéoporose entraînent une altération nette de
la qualité de la vie des patients transplantés. La perte osseuse
cortisonique est prépondérante, mais la responsabilité de la ciclo-
sporine a également été évoquée (6, 7, 8). Même si les données
de la littérature sont contradictoires, il semblerait que la ciclo-
sporine puisse entraîner une diminution des hormones sexuelles
chez l’animal et chez l’humain ainsi que, selon certains auteurs,
une inhibition limitée de la résorption osseuse (8). Le type d’or-
gane transplanté et la présence d’une atteinte osseuse préalable
à la transplantation interviennent également. Ainsi, la perte
osseuse paraît plus importante en cas de transplantation rénale
qu’en cas de transplantation hépatique ou cardiaque (9-11).
Ostéoporose induite par les analogues de la gona-
dolibérine
Les analogues de la gonadolibérine, ou hormone de libération
des gonadotrophines (GnRH), ont une action agoniste para-
doxale sur les hormones gonadotropes hypothalamo-hypo-
physaires FSH et LH. Ils sont principalement utilisés pour le
traitement de l’endométriose et des cancers hormono-dépen-
dants (cancer du sein avec métastases et cancer de la prostate)
(12). Chez la femme, l’action des analogues de la gonadoli-
bérine entraîne une baisse rapide des estrogènes circulants à
des taux de castrats. Chez des femmes traitées pour endomé-
triose, plusieurs études permettent de constater une perte
osseuse trabéculaire d’environ 5 % après six mois de traite-
ment, cette perte étant associée à une modification des mar-
queurs biochimiques du remodelage osseux évoquant une
situation postménopausique. Cette perte osseuse peut être
réversible, avec une récupération parfois partielle après l’ar-
rêt du traitement (12, 13). Chez l’homme, l’effet de ces inhi-
biteurs entraîne une baisse rapide de la testostéronémie se com-
pliquant d’une diminution de la masse osseuse (12, 14).
Plusieurs observations d’ostéoporoses fracturaires sont docu-
mentées chez des hommes traités pour un cancer de la pros-
tate, même si cette complication reste assez rare (15).
Ostéoporose à l’héparine
Une héparinothérapie prolongée pendant plusieurs mois à
fortes doses a été rendue responsable d’ostéoporoses fractu-
raires, notamment vertébrales. Ces accidents osseux ont sur-
tout été décrits initialement chez des femmes enceintes trai-
tées par héparine pour une thrombose, mais également chez
des patients (groupe de médecins américains) traités plus de
trois mois par de fortes doses d’héparine pour une atteinte
coronarienne (16-18). Une perte osseuse a également été
observée chez des patientes enceintes traitées par héparine à
faible dose en raison d’antécédents thromboemboliques iso-
lés ou dans un contexte d’hypercoagulabilité (déficit en pro-
téine C, en protéine S , syndrome des antiphospholipides) (19).
La pathogénie de cette ostéoporose, qui n’est pas constante
(30 à 40 % des patients traités), n’est pas totalement élucidée ;
certaines études ont démontré, in vitro, une augmentation de
la résorption ostéoclastique liée à l’hormone parathyroïdienne
engendrée par l’héparinothérapie. Les héparines de bas poids
moléculaire (HBPM) auraient un effet délétère moindre sur le
métabolisme osseux du rat que l’héparine (20).
Ostéoporose et hormones thyroïdiennes
Les traitements par hormone thyroïdienne visant à bloquer la
croissance des cancers thyroïdiens hormono-dépendants (soit
à une dose suppressive de la production de TSH) provoquent
La Lettre du Rhumatologue - n° 262 - mai 2000
22
MISE AU POINT
Figure 1. Fissure horizontale du col fémoral au cours d’une corticothé-
rapie prolongée.

La Lettre du Rhumatologue - n° 262 - mai 2000
23
MISE AU POINT
une perte osseuse, surtout corticale (col fémoral) (21-23). Mal-
gré d’importantes controverses selon les études, cette perte
osseuse est variable, mais elle serait plus importante chez les
femmes ménopausées ayant un taux sérique de TSH très bas
(23). Chez l’homme, quelques études suggèrent que l’effet
ostéopéniant de l’hormonothérapie suppressive est moindre,
voire nul (23). Par contre, lorsque le traitement hormonal thy-
roïdien est envisagé à doses purement substitutives (avec un
taux normal de TSH sérique), il n’y aurait pas de perte osseuse
accrue, même s’il a été observé une diminution précoce et tran-
sitoire de la masse osseuse lombaire et fémorale (23).
Autres médicaments
Méthotrexate. Une ostéopathie au méthotrexate a été évo-
quée initialement chez des enfants leucémiques traités à fortes
doses puis chez des patients atteints de polyarthrite rhuma-
toïde traités au long cours par de petites doses hebdomadaires
de méthotrexate, sans que pour autant une relation causale soit
établie (24). Une inhibition de l’ostéoformation avec une aug-
mentation de l’ostéorésorption ont pu être ainsi évoquées grâce
à des données histomorphométriques et biochimiques chez le
rat traité par méthotrexate (25). Cependant, une récente étude
densitométrique suggère qu’un traitement par méthotrexate à
petites doses hebdomadaires au long cours chez des patientes
atteintes de polyarthrite rhumatoïde n’entraînerait pas de perte
osseuse accrue (26).
Antivitamines K. Au cours d’études rétrospectives, une
carence en vitamine K a pu être associée à des fractures ostéo-
porotiques et, par la suite, plusieurs travaux ont montré des
résultats contradictoires concernant l’effet d’une anticoagula-
tion orale sur la densité minérale osseuse (27, 28). Alors que
la prise d’AVK pendant plus de douze mois apparaît au cours
d’une étude rétrospective (29) comme un facteur de risque
indépendant de fracture ostéoporotique, une récente étude
prospective, l’étude SOF (Study of Osteoporotic Fractures), a
permis de démontrer que les traitements anticoagulants oraux
(warfarine) ne diminuaient pas la masse osseuse et n’aug-
mentaient pas le risque fracturaire (30).
LES OSTÉOMALACIES
Ostéomalacie aux anticonvulsivants
Plusieurs anticonvulsivants (barbituriques, diphénylhydan-
toïnes) peuvent entraîner des ostéomalacies en perturbant le
métabolisme de la vitamine D (31,32).En effet, le mécanisme
le plus fréquemment invoqué dans la littérature est l’accélé-
ration du catabolisme hépatique de la vitamine D par le biais
d’une induction enzymatique sous la dépendance d’hydroxy-
lases du cytochrome P 450. Les métabolites inactifs sont donc
plus fréquents et une réduction des taux circulants de 25 (OH)
D3 est observée (33). Si une hypocalcémie est assez fréquente,
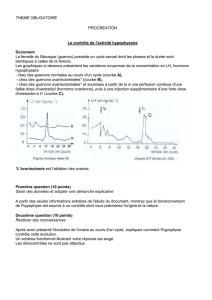
une véritable ostéomalacie (figure 2) n’est observée que lors
de traitements prolongés à fortes doses chez des sujets à risque,
ayant par exemple une exposition solaire réduite. Si l’ostéo-
malacie avérée reste rare, l’hypocalcémie chronique peut,
quant à elle, entraîner une hyperparathyroïdie secondaire avec
hyperostéoclastose et fragilisation de la trame osseuse.
Ostéomalacie par ingestion d’antiacides ou chéla-
teurs du phosphore
Certains antiacides ayant la propriété de chélater les phos-
phates dans la lumière intestinale (par exemple le gel d’hy-
droxyde d’alumine) lorsqu’ils sont ingérés à fortes doses et de
façon prolongée sont susceptibles d’entraîner une carence en
phosphates. Ces antiacides (plus particulièrement l’alumi-
nium) se liant de façon stable avec les phosphates dans la
lumière intestinale, le complexe phosphate antiacide est très
faiblement absorbé dans l’intestin. L’hypophosphatémie qui
en résulte peut se compliquer d’une véritable ostéomalacie
(34, 35). Cette complication reste malgré tout assez rare, car
les apports nutritionnels en phosphore sont importants et per-
mettent généralement de compenser l’effet des antiacides.
Figure 2. Fissure ou strie de Looser-Milkman du bord médial de l’omo-
plate (ostéomalacie).

La Lettre du Rhumatologue - n° 262 - mai 2000
24
MISE AU POINT
Toutefois, il faut souligner que les gels d’hydroxyde d’alu-
mine sont susceptibles de créer une ostéomalacie par effet
toxique direct de l’aluminium sur les ostéoblastes. Cet effet
direct expliquerait, pour certains auteurs, l’ostéopathie de type
aplastique constatée chez l’insuffisant rénal utilisant ces gels
d’alumine comme chélateurs du phosphore (36, 37). Ceci a
entraîné l’arrêt de l’utilisation de ces gels comme chélateurs
du phosphore dans de nombreux centres de néphrologie et
d’hémodialyse.
Ostéomalacie liée aux bisphosphonates
Le risque de frénation de la minéralisation osseuse par les bis-
phosphonates dépend du rapport entre l’activité antiostéo-
clastique et la toxicité sur la minéralisation pour la molécule
utilisée. Les bisphosphonates de première génération (étidro-
nate disodique) prescrits à de fortes doses (> 10 mg/kg/j) ou
pendant de longues périodes à plus faibles doses (supérieures
à six mois) peuvent conduire à une ostéomalacie par effet
toxique direct entraînant un défaut de minéralisation du tissu
ostéoïde. Cet effet de l’étidronate disodique a été constaté chez
des patients pagétiques traités à fortes doses ou pendant une
durée prolongée, principalement dans des foyers ostéolytiques
préexistants, sans doute par accumulation préférentielle de
l’étidronate dans ces zones d’hyperremodelage pagétique. Cli-
niquement, on a pu noter une augmentation des douleurs
osseuses, mais rarement des fractures. Les douleurs dispa-
raissent après arrêt de l’étidronate (et éventuellement un trai-
tement par calcitonine). Une reminéralisation de la zone claire
focale est observée en quelques mois (38-40).
Par contre, au cours des traitements de l’ostéoporose par l’éti-
dronate, aucune ostéomalacie histologique n’a pu être démon-
trée après sept ans de traitement cyclique (41). Les dernières
générations de bisphosphonates (qui ont un rapport
activité/toxicité beaucoup plus favorable) ont quant à elles
démontré qu’elles pouvaient être utilisées de façon continue
et à dose efficace sans risque sur la minéralisation grâce à des
études chez l’animal ainsi que chez l’homme, par exemple
pour l’alendronate et le pamidronate (42-44).
LA FLUOROSE OSSEUSE
Des fluoroses squelettiques d’origine médicamenteuse ont pu
être observées après l’administration prolongée de molécules
riches en fluor. En pratique, deux types de traitement ont été
incriminés :
–La poursuite de façon ininterrompue pendant plusieurs
années d’un anti-inflammatoire non stéroïdien contenant du
fluor (acide niflumique) est susceptible de provoquer une fluo-
rose squelettique (45,46). Dans ce cas, même l’utilisation très
prolongée de produit topique (pommade) a été incriminée.
–Des traitements antiostéoporotiques par fluorure de sodium
ou mono-fluorophosphate, ne respectant pas les règles de pres-
cription (maximum de deux ans de prescription à 25 mg de
fluor élément par jour), ont entraîné des fluoroses osseuses
avec, cliniquement, des douleurs rachidiennes et surtout des
douleurs des membres inférieurs (47-49).
Ces douleurs sont liées à des microfissures, parfois visibles à
la scintigraphie ou à l’IRM. Les anomalies radiographiques
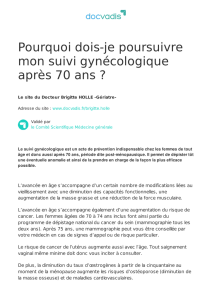
sont très variées : condensation à type d’ostéosclérose à pré-
dominance rachidienne et pelvienne (figure 3) associée à des
formations osseuses périostées irrégulières, à des calcifica-
tions ectopiques (tendons, ligaments, membrane interosseuse),
voire raréfaction osseuse avec rares fractures. Cette diversité
radiographique correspond aux différentes possibilités de
modifications histologiques décrites (augmentation de la poro-
sité des corticales, activité de remodelage accentuée, défauts
locaux de calcification et lacunes périostéocytaires tachetées).
Les hyperostoses liées à la prise de rétinoïdes
Les rétinoïdes (isotrétinoïne et acitrétine) qui sont utilisés en
dermatologie dans le traitement de l’acné, du psoriasis et de
l’ichtyose peuvent entraîner des effets secondaires osseux. Il
s’agit de périostose ou d’hyperostose (par ossification des
enthèses), surtout lors de traitements prolongés. Cette hyper-
Figure 3. Condensation osseuse corticospongieuse pelvirachidienne mar-
quée au cours d’une fluorose.

La Lettre du Rhumatologue - n° 262 - mai 2000
25
MISE AU POINT
ostose peut se manifester après six mois de traitement, mais,
le plus souvent, elle survient après dix-huit à vingt-quatre mois.
Cliniquement apparaissent des douleurs avec sensation de rai-
deur rachidienne associées à des douleurs périphériques, sur-
tout calcanéennes, évoquant parfois un rhumatisme psoria-
sique. Les troubles de l’ossification visibles radiologiquement
touchent plus particulièrement le calcanéum, le pelvis et le
rachis (50, 51) avec un aspect d’hyperostose engainante sié-
geant avec prédilection au rachis cervical. Lorsque le traite-
ment est arrêté, les symptômes s’améliorent assez vite et les
lésions radiologiques ont tendance à se stabiliser, mais ne
régressent pas.
LES IMPACTIONS ÉPIPHYSAIRES DES TRANS-
PLANTÉS
Une entité particulière a été décrite, principalement chez les
transplantés rénaux. Il s’agit d’impactions épiphysaires mul-
tiples survenant précocement après la transplantation (toujours
dans les six premiers mois), évoluant souvent de façon favo-
rable (52, 53).
Le tableau clinique est constitué de douleurs articulaires
vivaces, d’horaire mixte, réveillées à la pression des épiphyses,
avec parfois une tuméfaction des tissus mous en regard. Les
articulations concernées sont les genoux, les pieds et parfois
les chevilles, le tout de façon symétrique.
La radiographie standard permet de constater une raréfaction
trabéculaire hétérogène, avec parfois des appositions périos-
tées. La scintigraphie osseuse peut aider à déceler les atteintes
radiologiquement muettes grâce à la présence d’un ou plu-
sieurs foyers d’hyperactivité, mais c’est surtout l’IRM qui va
révéler les foyers d’œdème médullaire entourant des images
linéaires en hyposignal qui pourraient correspondre à des
impactions trabéculaires. Ainsi, l’aspect caractéristique est
celui de bandes d’impaction centro-médullaires localisées aux
principales épiphyses des membres inférieurs (53).
Ce tableau “clinico-radiologique” présente de nombreuses
analogies avec le tableau clinique nommé syndrome algique
polyarticulaire, probablement induit par la ciclosporine, décrit
chez des transplantés rénaux et cardiaques (54). Les auteurs
avaient insisté sur le rôle probable de la ciclosporine, dont l’ef-
fet ostéopéniant a déjà été abordé précédemment (voir cha-
pitre “Ostéoporose chez les transplantés”).
LES OSTÉONÉCROSES CORTICO-INDUITES
Des ostéonécroses épiphysaires et parfois métaphysaires sont
fréquemment observées au cours d’une corticothérapie, en par-
ticulier après plusieurs mois de traitement (figure 4). Ces
ostéonécroses sont souvent multiples et peuvent être asymp-
tomatiques. Leur pathogénie n’est pas univoque, mais l’is-
chémie secondaire à une hypertrophie adipocytaire intramé-
dullaire est souvent mise en exergue (55).
Ce sont les fortes doses de corticoïdes, avec en particulier une
posologie journalière souvent supérieure à 20 mg d’équiva-
lent prednisone par jour, ainsi qu’une dose cumulée en glu-
cocorticoïdes qui constituent les facteurs de risque les plus
importants de survenue d’une ostéonécrose (56). La patholo-
gie sous-jacente ainsi que les autres facteurs de risque inter-
viennent également (57, 58). Par exemple, l’ostéonécrose de
la tête fémorale cortico-induite est observée dans 4,5 % des
cas au cours de la transplantation rénale (fréquence des séries
les plus récentes utilisant des doses de corticoïdes modérées
conjointement à de la ciclosporine). Ces ostéonécroses cor-
tico-induites au cours de la transplantation rénale sont souvent
étendues d’emblée (57). Elles touchent plus particulièrement
Figure 4. Ostéonécrose aseptique de la tête fémorale au cours d’une cor-
ticothérapie.
 6
6
 7
7
1
/
7
100%