Lire l'article complet

coordonné par
le Pr C. Le Feuvre
8 | La Lettre du Cardiologue • n° 425 - mai 2009
CONGRÈS
RÉUNION
Les études d’influence
Congrès de l’ACC 2009
J.P. Kevorkian*
29-31 mars, Orlando, Floride, États-Unis
* Médecine interne B, hôpital Lariboi-
sière, Paris.
STICH (Surgical Treatment
for Heart Failure).
Inutile de compléter
par une réduction
ventriculaire, la revascularisation
chirurgicale des cardiopathies
ischémiques avec dysfonction
systolique sévère,
symptomatique
Compléter la revascularisation chirurgicale d’une
réduction ventriculaire par résection d’un large terri-
toire infarci ne diminue ni la mortalité ni la morbidité
des cardiopathies ischémiques dilatées compliquées
de dysfonction systolique sévère. L’étude STICH,
multicentrique, internationale, prospective, rando-
misée et ouverte, permet de comparer les résultats
de la revascularisation myocardique chirurgicale
seule avec ceux de la revascularisation myocar-
dique chirurgicale complétée d’une réduction du
volume ventriculaire chez 1 000 patients coronariens
âgés en moyenne de 62 ans, bi- ou tritronculaires
(80 % des cas), avec une fonction systolique très
altérée (FEVG moyenne 28 %), au stade NYHA II
à IV, malgré un traitement médical conventionnel
jugé satisfaisant (plus de 75 % des patients). Au
terme des 5 années de suivi, le taux d’événements
du critère principal (mortalité, hospitalisations
de causes cardiaques) n’est pas différent entre les
deux thérapeutiques chirurgicales (58 % d’événe-
ments dans le groupe revascularisation-réduction
contre 59 % dans le groupe revascularisation seule,
p = 0,9). Pour le même type de patients corona-
riens, on attend incessamment les résultats d’une
autre évaluation thérapeutique de l’étude STICH :
la comparaison prospective et randomisée entre le
traitement médical seul et le traitement médical
complété par la revascularisation chirurgicale.
JUPITER (Justification for
the Use of Statins in Primary
Prevention: an Intervention Trial
Evaluating Rosuvastatin)
Étude ancillaire 1. Rosuvastatine :
bénéfice cardiovasculaire proportionnel
à la baisse conjointe du LDL-c
et de la CRPus
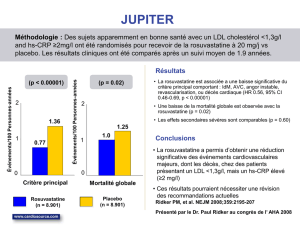
Dans l’étude prospective, randomisée contre placebo
JUPITER (N Engl J Med 2008;359:2195-207), 20 mg
quotidiens de rosuvastatine pendant 5 ans diminuent
significativement, très nettement et sans effet indé-
sirable notable, le LDL-c (– 50 %), la CRPus (– 37 %)
et les événements cardiovasculaires (– 44 %, 0,77 %
contre 1,36 % par an dans le groupe placebo) dans
une population d’adultes, essentiellement mascu-
line, sexagénaire, hypertendue (bien traitée) et obèse
(20 % de la population initialement évaluée), dont la
particularité est un taux élevé de CRPus (≥ 2 mg/l),
mais un taux faible de LDL-c (LDL-c < 1,30 g/l)
[n = 17 802]. Le bénéfice en prévention cardiovascu-
laire primaire apparaît supérieur au bénéfice théorique
attendu sans qu’il soit pourtant possible de dégager
le rôle de la baisse du LDL-c et/ou de la CRPus sous
l’effet de 20 mg par jour de rosuvastatine.
Dans cette nouvelle analyse de l’étude JUPITER,
prévue initialement, la diminution conjointe du
LDL-c (< 70 mg/dl) et de la CRPus (< 2 mg/l) offre
le bénéfice le plus élevé en termes de réduction du
risque cardiovasculaire. La rosuvastatine diminue
significativement de 65 % les événements cardio-
vasculaires lorsque, à la fois, les taux de LDL-c et
de CRPus sont respectivement inférieurs à 0,70 g/l
et à 2 mg/l (par comparaison avec le placebo). La
diminution des événements se limite à 36 % seule-
ment quand les deux objectifs ne sont pas atteints
conjointement sous l’effet de 20 mg de rosuvasta-
tine. Pour des valeurs encore plus basses de CRPus,

Placebo
RR = 1,0 (référence) LDL > 0,70 g/l
ou CRPus > 2 mg/l
RR = 0,64
LDL > 0,70 g/l
ou CRPus > 1 mg/l
RR = 0,59
LDL < 0,70 g/l
et CRPus < 2 mg/l
RR = 0,35
LDL < 0,70 g/l
et CRPus < 1 mg/l
RR = 0,21
0,08 p < 0,0001
0,06
0,04
0,02
0,00
Taux cumulé d'événements
0 1 2 3 4
Suivi (années)
Figure 1. Étude JUPITER. Événements artériels mortels et non mortels (IDM, AVC)
proportionnels à la baisse conjointe des taux de LDL-c et de CRPus.
Placebo 60 événements/8 901 patients
RR = 0,57, p = 0,007
– 43 %
Rosuvastatine 34 événements/8 901 patients
Suivi (années)
Taux cumulé d'événements
0,025
0,020
0,015
0,010
0,005
0,000
0 1 2 3 4
Figure 2. Étude JUPITER. Événements thrombo-emboliques veineux (thrombose veineuse,
embolie pulmonaire).
La Lettre du Cardiologue • n° 425 - mai 2009 | 9
CONGRÈS
RÉUNION
(LDL-c < 0,70 g/l et CRPus < 1 mg/l), la survie
sans survenue d’événements est encore meilleure
et marquée par une réduction de 79 % du risque
cardiovasculaire (figure 1).
Étude Ancillaire 2. Rosuvastatine :
efficacité préventive artérielle et…
veineuse
Dans cette analyse complémentaire de l’étude
JUPITER, prévue initialement, la rosuvastatine
diminue également et dans la même période (5 ans)
le taux des événements thromboemboliques veineux
(thrombose veineuse profonde et/ou embolie pulmo-
naire) confirmés par échodoppler, phlébographie,
tomodensitométrie ou angiographie-scintigraphie
pulmonaire (– 43 %, 34 événements contre 60 dans
le groupe placebo, p = 0,007) [figure 2]. L’effet
préventif thombo-embolique veineux s’observe prin-
cipalement en cas d’accidents secondaires (cancer,
hospitalisation récente, chirurgie ou traumatisme)
[– 48 %, p = 0,03], sans élévation des événements
hémorragiques (258 dans le groupe rosuvastatine
contre 275 dans le groupe placebo, p = 0,45).
Pour résumer, en prévention primaire, dans la
population particulière de l’étude JUPITER, 20 mg
quotidiens de rosuvastatine permettrait d’éviter
un événement artériel ou veineux dans les 5 ans
pour 21 voire 18 patients traités (si l’on inclut la
mortalité totale).
AURORA (A study to evaluate
the Use of Rosuvastatin
in subjects On regular
Haemodialysis: an Assessment
of survival and cardiovascular
events). Hémodialysés
chroniques : un pronostic très
sévère malgré la rosuvastatine ?
La rosuvastatine (10 mg/j) diminue de façon signi-
ficative et importante le taux de LDL-c (– 43 %
contre 1,9 % dans le groupe placebo) des hémodia-
lysés chroniques, mais n’améliore pas leur pronostic
cardiovasculaire au terme de trois années de suivi.
Les 2 776 hémodialysés chroniques (depuis 12 ans
en moyenne) de l’étude AURORA sont âgés en
moyenne de 64 ans avec un taux de LDL-c moyen
initial à 1 g/l. Dans cette étude prospective, rando-
misée, multicentrique et internationale, le taux
d’événements cardiovasculaires mortels et non
mortels annuels n’est pas significativement diffé-
rent entre la rosuvastatine et le placebo (9,2 %
dans le groupe rosuvastatine et 9,5 % dans le
groupe placebo, p = 0,59). L’interruption de la
rosuvastatine dans la moitié des cas peut expliquer
l’échec de la statine. Les hémodialysés chroniques

coordonné par
le Pr C. Le Feuvre
1,0
0,9
0,8
0,7
0,6
0,5
0 200 400 600 800
NT-pro-BNP
à la valeur cible
Suivi clinique seul
p < 0,001
Temps (jours)
Survie (%)
Figure 3. Mortalité par insuffisance cardiaque dans le sous-groupe des patients à la
valeur-cible de Pro-BNP (diminution d’au moins 75 %).
10 | La Lettre du Cardiologue • n° 425 - mai 2009
CONGRÈS
RÉUNION
constituent une population de patients particuliè-
rement graves (mortalité totale annuelle de 13,5 %
dans le groupe rosuvastatine et de 14 % dans le
groupe placebo, p = 0,51) pour lesquels nous ne
disposons pas encore de moyens thérapeutiques
suffisamment efficaces.
OMEGA (Optima Micare
Eliminates OMEGA-3 Benefits?).
Aucune prévention
de la mort subite
par les AG-Ω-3
en post-SCA
Après un syndrome coronarien aigu (SCA) avec ou
sans sus-décalage de ST, l’adjonction d’acides gras
oméga-3 (AG-Ω-3, 1g/j) au traitement conven-
tionnel ne permet pas de diminuer le taux de mort
subite à un an. Les 3 827 patients coronariens
remarquablement bien traités (angioplastie dans
78 % des cas, traitement médical optimal dans plus
de 90 % des cas) de l’étude allemande OMEGA,
prospective, en double insu, multicentrique, contre
placebo (huile d’olive, 1 g/j), ne tirent donc aucun
bénéfice des AG-Ω-3 (1,5 % de mort subite dans
les deux groupes, p = 0,84).
PRIMA (Can Pro-Brain
Natriuretic Peptide Guided
therapy of Chronic Heart Failure
Improve Heart Failure Morbidity
and Mortality ? Main Outcome
of the PRIMA-Study).
Guider le traitement
de l’insuffisance cardiaque
chronique par le Pro-BNP :
inutile ?
Dans l’étude néerlandaise PRIMA, prospective,
randomisée, en insu simple et multicentrique, l’adap-
tation thérapeutique guidée par les taux plasma-
tiques de Pro-BNP ne fait pas mieux que la clinique
pour le pronostic à un an de 345 insuffisants
cardiaques (FEVG moyenne = 33 %), avec notamment
une mortalité comparable dans les deux groupes
(26,5 % dans le groupe Pro-BNP contre 33,3 % dans
le groupe clinique). Les taux plasmatiques moyens
de Pro-BNP dans les deux groupes sont comparables
à l’inclusion et à la sortie de l’hôpital (8 034 pg/ ml
et 2 958 pg/ ml dans le groupe Pro-BNP contre
8 169 pg/ml et 2 932 pg/ ml dans le groupe clinique).
Néanmoins, en cas de diminution d’au moins 75 %
du Pro-BNP, le pronostic du groupe Pro-BNP est
significativement meilleur avec un taux de mortalité
significativement plus faible (10,9 % contre 33,3 %,
p < 0,001) [figure 3]. Le pronostic de l’insuffisant
cardiaque est donc bien inversement proportionnel
aux taux plasmatiques de Pro-BNP. D’autres études
sont probablement nécessaires pour définir plus clai-
rement la place d’un marqueur biologique comme
le Pro-BNP dans le traitement de l’insuffisance
cardiaque. La seule étude PRIMA est insuffisante
pour porter un jugement définitif.
TIPS (The Indian Polycap Study).
Polypilule : un comprimé
de 5 médicaments
minidosés pour
une maxiprotection
cardiovasculaire (en théorie)
La “polypilule”, un comprimé quotidien chargé
de 5 médicaments minidosés dont 3 anti-HTA,
1 hypocholestérolémiant et 1 antiagrégant plaquet-

0,4
0,3
0,2
0,1
0,0
0,15
0,10
0,05
0,0
0 1 2 3 4
RR = 0,89 (– 11 %), p = 0,014
RR = 0,72 (– 28 %), p = 0,00002
Aspirine
Clopidogrel + aspirine
Aspirine
Clopidogrel + aspirine
Années
Taux cumulé d'événements
Taux cumulé d'événements
Taux cumulé d'événements
Critère principal
Mortalité cardiovasculaire, IDM, AVC, embolies
AVC
0 1 2 3 4 Années
0,05
0,04
0,03
0,02
0,01
0,0
RR = 0,77 (– 23 %), p = 0,067
Aspirine
Clopidogrel + aspirine
IDM
0 1 2 3 4 Années
Figure 4. Étude ACTIVE-A. Bénéfice de l’association clopidogrel-aspirine pour la préven-
tion des événements cardiovasculaires graves de la fibrillation auriculaire.
La Lettre du Cardiologue • n° 425 - mai 2009 | 11
CONGRÈS
RÉUNION
taire (hydrochlorothiazide 12,5 mg, aténolol
50 mg, ramipril 5 mg, simvastatine 20 mg, aspi-
rine 80 mg), pourrait se révéler particulièrement
efficace en prévention cardiovasculaire primaire,
diminuant, en théorie, le risque cardiovasculaire
de 50 à 60 % chez des individus d’âge moyen avec
au moins un facteur de risque (HTA, diabète de
type 2, tabagisme actif, surcharge abdominale)
et sans dyslipidémie (LDL-c < 1,3 g/l).
Dans l’étude TIPS, en prévention primaire, la penta-
thérapie en minidoses fait mieux que les bi-, les tri-
et les quadrithérapies des mêmes principes actifs
aux mêmes posologies sur tous les paramètres
tensionnels et lipidiques chez 2 503 Indiens (44 %
de femmes, âge moyen 54 ans), randomisés en neuf
groupes parallèles (polypilule, n = 400). Les bénéfices
se font sans surcroît d’effets indésirables et notam-
ment d’interférences médicamenteuses, telle la dimi-
nution d’efficacité antihypertensive par l’aspirine
comme le montrent les diverses combinaisons médi-
camenteuses de l’étude (notamment trithérapie anti-
HTA avec ou sans aspirine). Comparée au placebo,
la baisse de la pression artérielle systolique est la
plus forte sous l’effet de la polypilule (– 7,4 mmHg
contre – 6,3 mmHg en trithérapie, – 4,7 mmHg en
bithérapie et – 2,2 mmHg en monothérapie). La
diminution du LDL-c est un peu plus faible dans le
groupe polypilule (0,28 g/l contre 0,33 g/l dans le
groupe simvastatine seule, p = 0,04). La fréquence
cardiaque est comparable entre le groupe polypilule
et les groupes aténolol. Sur la base de ces éléments
obtenus après trois mois d’étude, le bénéfice théo-
rique de la polypilule pourrait donc permettre de
réduire de plus de 60 % les événements cardiovas-
culaires en prévention primaire (tableau).
ACTIVE-A (Atrial fibrillation
Clopidogrel Trial with Irbesartan
for prevention of Vascular
Events-Af). Association
clopidogrel-aspirine : prévention
efficace des accidents
emboliques de la FA
En 2006, dans l’étude ACTIVE-W, l’association clopi-
dogrel-aspirine se révélait moins efficace que l’AVK
pour la prévention des accidents emboliques de la FA.
Un biais en faveur de l’AVK rendait cette conclusion
discutable. En effet, l’analyse post hoc révélait un
surcroît d’événements emboliques dans un groupe
Tableau. Bénéfice théorique de la “polypilule” sur le pronostic cardiovasculaire des sujets à
risque cardiovasculaire moyen.
Événements coronaires (%) AVC (%)
Simvastatine (20 mg/j) 27 8
Pression artérielle (3 anti-HTA ½ doses) 24 33
Aspirine (100 mg/j) 32 16
Association 62 48

TAY2215 - 03/09 © Tous droits réservés Pfi zer SAS 2009 au capital de 38 200 euros. RCS Paris 433 623 550 - Locataire gérant de Pfi zer Holding France.
DENOMINATION : TAHOR
®
10 mg, 20 mg, 40 mg ou 80 mg comprimés pelliculés. COMPOSITION : Comprimé pelliculé dosé à 10, 20, 40 mg ou 80 mg d’atorvastatine (sous forme calcique trihydratée) : boîte de
28, 50 ou 90 comprimés sous plaquette thermoformée. DONNÉES CLINIQUES : • Indications thérapeutiques : Indications biologiques : Réduction des hypercholestérolémies pures (type IIa) ou mixtes (type IIb
et III) en complément d’un régime adapté et assidu. Hypercholestérolémie familiale homozygote, en addition à d’autres traitements hypolipémiants (notamment LDL aphérèse) ou lorsque de tels traitements ne sont
pas disponibles. Les comprimés à 80 mg sont réservés aux formes sévères d’hypercholestérolémie notamment aux formes familiales homozygotes. Indications basées sur des études cliniques d’intervention : Réduction des événements coronaires chez des patients hypertendus
traités avec 3 facteurs de risque en prévention primaire, avec ou sans hyperlipidémie associée. Prévention des évènements coronaires et cérébrovasculaires chez des patients diabétiques de type 2 avec un autre facteur de risque, avec ou sans hyperlipidémie associée • Posologie
et mode d’administration : Prescription en association avec le régime, en prise unique à tout moment de la journée, indépendamment des repas. Posologie initiale : 10 mg/jour. La réponse thérapeutique s’observe en 2 semaines et est habituellement maximale après 4 semaines.
Cette dose permet un contrôle satisfaisant chez la majorité des patients. Si nécessaire, adaptation posologique à intervalle d’au moins 4 semaines, en fonction de l’évolution de la cholestérolémie. Posologie usuelle : 10 voire 20 mg/j dans les hypercholestérolémies modérées.
Formes sévères (notamment dans les formes familiales homozygotes) : des posologies plus élevées peuvent être nécessaires. Dose maximale recommandée : 80 mg. Insuffi sant rénal, sujet âgé : il n’est pas nécessaire d’ajuster les doses. Traitements associés : l’atorvastatine peut
être associée aux chélateurs des acides biliaires. • Contre-indications : Ce médicament ne doit jamais être prescrit dans les cas suivants : hypersensibilité à l’un des constituants du médicament; affection hépatique évolutive; élévation prolongée des transaminases sériques; en
association avec l’itraconazole, le kétoconazole, la télithromycine, le stiripentol et la delavirdine; chez la femme qui allaite. Ce médicament est généralement déconseillé en cas d’association aux fi brates. • Mises en garde spéciales et précautions particulières d’emploi :
Interrompre le traitement en cas de découverte d’une grossesse. Tenir compte de la présence de lactose. Surveillance hépatique : avant puis régulièrement après l’instauration du traitement ainsi qu’en cas de signes ou de symptômes évocateurs d’une altération hépatique.
Surveillance des transaminases plus fréquente en cas de prescription des doses les plus élevées. Interrompre le traitement en cas d’augmentation persistante des transaminases ALAT ou ASAT au-delà de 3 fois la limite supérieure de la normale. Effets musculaires : Comme les
autres inhibiteurs de l’HMG-CoA réductase, l’atorvastatine peut affecter les muscles squelettiques et entraîner des myalgies, myosites et myopathies, pouvant rarement évoluer vers une rhabdomyolyse, caractérisée par des taux élevés de CPK (plus de 10 fois la LSN), une myoglobinémie
et une myoglobinurie et pouvant entraîner une insuffi sance rénale, et être fatale dans certains cas. Chez les patients asymptomatiques traités par statine, pas de recommandation de dosage régulier des taux de CPK ou d’autres enzymes musculaires. Chez les patients présentant
des facteurs prédisposant à une rhabdomyolyse et chez ceux présentant des symptômes musculaires pendant un traitement par une statine, recommandation de dosage des CPK avant toute initiation d’un traitement par statine. Avant initiation du traitement : Contrôler le taux de
CPK dans les situations suivantes : insuffi sance rénale, antécédent personnel ou familial de maladies musculaires génétiques, antécédent personnel de toxicité musculaire lors d’un traitement par une statine ou un fi brate, abus d’alcool, hypothyroïdie, patients âgés (> 70 ans). Dans
ces situations, réévaluer régulièrement le bénéfi ce/risque du traitement et assurer une surveillance clinique régulière. Ne pas débuter le traitement si le taux basal de CPK est signifi cativement élevé (plus de 5 fois la LSN). Mesure de la CPK : Ne pas mesurer la CPK après un exercice
physique important ni en présence d’une autre cause possible d’augmentation. En cas d’élévation signifi cative de la CPK (plus de 5 fois la LSN) avant traitement, recontrôler systématiquement dans les 5 à 7 jours pour confi rmer les résultats. Si le taux initial de CPK
> 5 fois la normale est confi rmé, ne pas initier le traitement. Pendant le traitement : demander aux patients de signaler rapidement toute douleur musculaire inexpliquée, crampe ou faiblesse musculaire, en particulier si elles s’accompagnent de malaise ou de fi èvre ; en cas d’apparition
de symptômes sous traitement effectuer un dosage de CPK ; interrompre le traitement si le taux CPK est signifi cativement élevé (plus de 5 fois la LSN) ; si les symptômes musculaires sont sévères et provoquent une gêne quotidienne envisager l’arrêt du traitement, même si le taux
de CPK ne dépasse pas 5 fois la LSN ; si les symptômes disparaissent et que le taux de CPK redevient normal envisager la réintroduction de l’atorvastatine ou d’une autre statine à la dose la plus faible sous étroite surveillance ; interrompre le traitement en cas d’élévation cliniquement
signifi cative du taux de CPK (plus de 10 fois la LNS) ou de diagnostic ou de suspicion de rhabdomyolyse. Dans le traitement des hypercholestérolémies familiales homozygotes, il n’existe à l’heure actuelle que peu de données chez l’enfant. • Interactions avec d’autres médicaments
et autres formes d’interaction : Associations contre-indiquées : itraconazole, kétoconazole, stiripentol, delavirdine, télithromycine. Association déconseillée : fi brates, gemfi brozil. Associations nécessitant des précautions d’emploi : anticoagulants oraux, vérapamil, diltiazem,
erythromycine, clarithromycine, ciclosporine, inhibiteurs de protéases. Association à prendre en compte : jus de pamplemousse. • Effets indésirables : Les évènements indésirables ci-dessous sont listés selon la classifi cation MedDRA par système-organe et par ordre de fréquen-
ces : Très fréquents (≥ 1/10), fréquents (≥ 1/100 et < 1/10), peu fréquents (≥ 1/1000 et < 1/100), rares (≥ 1/10 000 et < 1/1000), très rares (< 1/10 000). Les effets indésirables sont généralement discrets et transitoires. Affections hématologiques et du système lymphatique :
Peu fréquent : Thrombocytopénie. Affections du système immunitaire : Peu fréquent : Réaction d’hypersensibilité (urticaire). Troubles du métabolisme et de la nutrition : Peu fréquents : Hypoglycémie, hyperglycémie, anorexie, prise de poids. Affections psychiatriques : Fréquent :
insomnie. Affections du système nerveux : Fréquents : Hypoesthésie, paresthésie, vertiges, céphalées. Peu fréquents : Neuropathie périphérique, amnésie. Affections de l’oreille et du labyrinthe : Peu fréquents : Acouphènes. Affections gastro-intestinales : Fréquents : Nausées,
diarrhées, douleurs abdominales, dyspepsie, constipation, fl atulences : Peu fréquents : Vomissements Rare : Pancréatite. Affections hépatobiliaires : Rares : Hépatite, ictère cholestatique. Affections de la peau et des tissus sous-cutanés : Fréquents : Prurit, éruption. Peu fréquents :
Alopécie. Rare : Eruption bulleuse. Très rares : Oedème de Quincke, syndrome de Stevens-Johnson, syndrome de Lyell. Affections musculo-squelettiques et systémiques : Fréquents : Myalgie, arthralgie, douleur dorsale (cf. rubrique Mises en garde et précautions
particulières d’emploi). Rares : Myosite, crampes musculaires (cf. Mises en garde et précautions particulières d’emploi). Très rares : Rhabdomyolyse, myopathie, tendinopathies parfois compliquées de rupture (cf Mises en garde et précautions particulières d’emploi). Affections des
organes de
reproduction et du sein : Peu fréquent : Impuissance. Troubles généraux et anomalies au site d’administration : Fréquents : Asthénie, douleurs thoraciques. Peu fréquent : Malaise. Rares : Œdème, oedème périphérique. Investigations : Fréquents : Elévation des enzymes
hépatiques : ASAT, ALAT (principalement en relation avec une cholestase), augmentation des CPK (cf. rubrique Mises en garde et précautions particulières d’emploi). PROPRIETES PHARMACOLOGIQUES : • Propriétés pharmacodynamiques : HYPOCHOLESTEROLEMIANT ET
HYPOTRIGLYCERIDEMIANT
/ INHIBITEUR DE L’HMG-CoA REDUCTASE. Code ATC : C10 AA05. Prévention des complications cardiovasculaires : Dans l’étude Collaborative Atorvastatin Diabetes Study (CARDS), l’effet de l’atorvastatine sur les évènements coronaires et
cérébrovasculaires mortels et non mortels a été évalué chez 2838 patients atteints de diabète de type 2 âgés de 40 à 75 ans, sans antécédent de maladies cardiovasculaires et avec un taux de LDL ≤ 4,14 mmol/l (160 mg/dl) et de TG ≤ 6,78 mmol/l (600mg/dl). Par ailleurs, tous
les patients avaient au moins un des facteurs de risque cardiovasculaire suivants : hypertension, tabagisme, rétinopathie, microalbuminurie ou macroalbuminurie. Dans cette étude randomisée, en double aveugle, multicentrique, contrôlée versus placebo, les patients recevaient soit
de l’atorvastatine à la dose
de 10 mg/jour (n = 1428) soit un placebo (n = 1410) durant une période moyenne de 3,9 ans. L’effet du traitement par atorvastatine sur le critère primaire ayant atteint le seuil d’arrêt de l’étude prédéfi ni pour l’effi cacité, CARDS a été arrêtée 2 ans avant la
date prévue. L’atorvastatine a réduit signifi cativement: la fréquence des évènements cardiovasculaires majeurs (critère composite associant l’infarctus du myocarde sévère mortel et non mortel, l’infarctus du myocarde asymptomatique, la mort d’origine coronaire aiguë, l’angor instable,
le pontage coronarien par greffe, l’angioplastie transluminale percutanée, la revascularisation, l’AVC) de 37% (p=0,0010), (placebo 9,0%, atorvastatine 5,8%) ; la fréquence des infarctus du myocarde sévères mortels et non-mortels et des infarctus du myocarde asymptomatiques de 42%
(p=0,0070), (placebo 4,5%, atorvastatine 2,7%) ; la fréquence des AVC mortels et non mortels de 48% (p=0,0163), (placebo 2,8%, atorvastatine 1,5%). L’incidence globale des effets indésirables ou des effets indésirables sévères était similaire dans les deux groupes. PRESENTATION
ET NUMERO D’IDENTIFICATION ADMINISTRATIVE : Modèle ville : TAHOR
®
10 mg, comprimé pelliculé, boîte de 28 comprimés : AMM n° 343 067.5 ; boîte de 90 comprimés : AMM n° 371 992.1. TAHOR® 20 mg, comprimé pelliculé, boîte de 28 comprimés : AMM n° 343 068.1 ;
boîte de 90 comprimés : AMM n° 371 993.8. TAHOR
®
40 mg, comprimé pelliculé, boîte de 28 comprimés : AMM n° 343 069.8 ; boîte de 90 comprimés : AMM n° 371 994.4 TAHOR
®
80 mg, comprimé pelliculé, boîte de 28 comprimés : AMM n° 355 575.0 ; boîte de
90 comprimés : AMM n° 371 995.0. Modèle hôpital : TAHOR
®
10 mg, comprimé pelliculé, boîte de 50 comprimés : AMM n° 560 302.2. TAHOR
®
20 mg, comprimé pelliculé, boîte de 50 comprimés : AMM n° 560 304.5. TAHOR
®
40 mg, comprimé pelliculé, boîte de 50 comprimés :
AMM n° 560 306.8. TAHOR
®
80 mg, comprimé pelliculé, boîte de 50 comprimés : AMM n° 355 576.7. PRIX : TAHOR
®
10 mg : 18,82 € (28 cpr) ; 55,32 € (90 cpr). TAHOR
®
20 mg : 37,72 € (28 cpr) ; 109,69 € (90 cpr). TAHOR
®
40 mg : 43,08 € (28 cpr) ; 126,89 € (90 cpr).
TAHOR
®
80 mg : 43,08 € (28 cpr) ; 126,89 € (90 cpr). CTJ : 0,67 € (cp 10 mg, bte de 28), 0,61 € (cp 10 mg, bte de 90) ; 1,35 € (cp 20 mg, bte de 28), 1,22 € (cp 20 mg, bte de 90) ; 1,54 € (cp 40 mg, cp 80 mg, bte de 28), 1,41 € (cp 40 mg, cp 80 mg,
bte de 90). CONDITIONS DE PRESCRIPTION ET DELIVRANCE : Liste I. Remb. Séc. Soc. à 65% - Collect. - Seul TAHOR
®
10 mg est remboursé dans les indications basées sur des études cliniques d’intervention. EXPLOITANT : Pfi zer – 23-25, avenue du Dr
Lannelongue – 75014 Paris –Tél. (information médicale) : 01 58 07 34 40. ® : marque déposée. Date de révision d’AMM: 22/03/2006. Pour plus d’informations, se référer au Résumé des Caractéristiques du Produit. Version n° 001-03/08.
Tahor_ML_180x130.indd 1 5/03/09 10:20:11
coordonné par
le Pr C. Le Feuvre
CONGRÈS
RÉUNION
de patients antérieurement traités par AVK et rando-
misés dans le groupe clopidogrel-aspirine.
L’étude ACTIVE-A, randomisée, en double-insu,
permet de comparer l’aspirine seule (75 à 100 mg/j)
et l’association clopidogrel-aspirine (75 mg/j-75 à
100 mg/j) pour la prévention des accidents de la FA à
risque élevé (au moins un facteur de risque), chez des
patients jugés inéligibles à la prise d’AVK (n = 7 554).
Au terme de quatre années de suivi, l’association
diminue significativement la mortalité cardiovascu-
laire, les AVC, les IDM et les embolies systémiques
(– 11 %, p = 0,014). Le bénéfice est très net pour
les AVC (– 28 %, p = 0,00002) et les IDM (– 23 %,
p = 0,067) [figure 4, cf. p. 11]. Le revers de la médaille
est un surcroît d’accidents hémorragiques (9,7 % par
an contre 5,7 % par an dans le groupe aspirine seule,
+ 58 %, p < 0,0001). Il faudrait donc traiter 1 000 FA
pendant trois ans par l’association pour éviter 28 AVC
(dont 17 invalidants ou mortels) et 6 IDM au prix de
20 accidents hémorragiques sévères. ■
12 | La Lettre du Cardiologue • n° 425 - mai 2009
Découvrez
l’article
d’A. Marquand
sur les
28es Journées
de l’hypertension
artérielle sur
www.edimark.fr
1
/
5
100%