– UE:7 immunologie–

2016-2017 Immunité innée
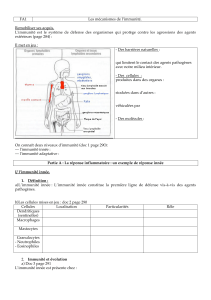
Les composantes humorales, moléculaires et cellulaires de l'immunité innée
– UE:7 immunologie–
L'immunité innée, l'autre immunité spécifique
Indiquer ici, dans cette police s'il y a une annexe en fin d'heure
Semaine : n°X (du 30/01/17 au
05/02/17)
Date : 30/01/2017
Heure : de 14h00 à
15h00 Professeur : Pr. Carnoy
Binôme : n°4 Correcteur : n°32
Remarques du professeur (Diapos disponibles sur moodle)
•revoir les cours pour Tp
PLAN DU COURS
III. La composante moléculaire
A) Les lectines de type C
B) Les TLRs « troll-like receptors »
C) Les NLRs « NOD-like receptors »
D)Les RLRs « RIG-like receptors »
IV. La composante cellulaire de l'immunité innée
A) La phagocytose = étape essentielle de l'immunité innée cellulaire
1/8

2016-2017 Immunité innée
III. La composante moléculaire
Dans l'immunité innée, la distinction entre le soi et le non-soi se fait grâce a des récepteurs innés (PRR)
qui reconnaissent des motifs universels (les MAMPS = ligands issus du monde microbiens)
Les récepteurs sont les PRR il y a 4 types :
–les lectines de type C (CLR)
–les Troll-like receptors (TLR)
–les Nod-like receptors (NLR)
–les Rig-like receptors (RLR)
Leur localisation est multiple : membranaire et intracellulaire
Ils sont solubles et capables de reconnaître des motifs microbiens
Membranaire Intracellulaire
–récepteurs scavengers
–récepteurs du complément
–lectines de type C
–TLRs
Endosomes Cytoplasmiques
- TLRs - NLRs (NOD et inflammasomes)
- RLRs (RIG et MDAS)
Nombreux types cellulaires : cellules immunitaires, cellules épithéliales, endothéliales, ..
A) Les lectines de type C
Lectines de type C = calcium dépendante
–lectines membranaires caractérisées par un domaine de reconnaissance des carbohydrates =CRD
« carbohydrate recognition domain »
–réagissent avec des motifs comportant un mannose, un galactose, ou fucose, Ca2+ dépendant
–reconnaissent des antigènes du soi et des pathogènes (glycolipides et glycoprotéines)
–favorisent phagocytose et présentation antigénique (macrophages et cellules dendritiques)
–régulent la signalisation, l'adhésion cellulaire et la migration cellulaire
Quelques exemples
:
–récepteurs au mannose (MR) 8CRD
–dectine : récepteur au β-glucane (paroi des champignons)
–DC-SIGN :
➢cellule capable de reconnaître le virus du VIH, virus immunodéficience (gp120), mycobacterium
tuberculosis, schistosoma mansoni => rôle de reconnaissance de pathogènes
➢récepteurs à la surface des cellules endothéliales (ICAM-2) et les lymphocytes T (ICAM-3) => le rôle
d'adhésion
B) Les TLRs « toll like receptors »
Initialement découverts dans la drosophile : protéine Troll impliquée dans la morphogenèse et la résistance anti-
fongique
Expérience
: Ils ont muté un gène appelé « toll », la drosophile se développait normalement mais elle était très
sensible aux champignons. Chez cet insecte on a eu une perte complète de la résistance aux champignons, c'est la
découverte d'un gène de résistance au microbe = gène Toll.
2/8

2016-2017 Immunité innée
On a ensuite retrouvé l’équivalence chez l'homme qui est le Toll-Like
–Ce sont des récepteurs transmembranaire
–10 récepteurs identifiés (chez l'homme)
–reconnaissance des ligands microbiens,
–certains TLRs nécessitent des protéines accessoires pour reconnaître le ligand (TLR4)
–phylogénétiquement très conservé : Ce gène a été préservé dans l'évolution , on en retrouve 4 copies chez
la drosophiles
Ce sont des protéines Trans-membranaires :
–1 domaine extracellulaire riche en leucine (LRR)
–1 domaine riche en cystéine
–1 domaine Trans-membranaire
–1 domaine intra-cytoplasmique (semblable à Il-1R) = toll/Il-1 receptor homologie domain (TIR)
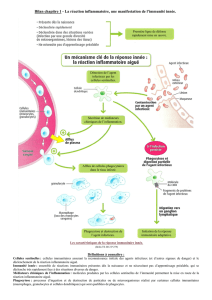
Ces récepteurs sont impliqués dans la réponse inflammatoire :
–production cytokines inflammatoires
–métabolisme oxydatif
–activation et maturation des cellules présentatrices d'antigènes
Localisation :
–sur leucocytes circulants : monocyte/ macrophage, cellules dendritiques, lymphocyte B
–sur cellules non immunitaires : adipocytes, cellules épithéliales intestinales, cellules endothéliales
dermiques
On peut avoir :
–des homo-dimères (TLR-4, TLR-5, TLR-5) sur la membrane plasmique
– des hétéro-dimères (TLR-2/TLR-1 ou 6) associés sur la membrane plasmique
–TLR associés aux endosomes : capables de reconnaître des acides nucléiques simple brin dans les
endosomes, si on en retrouve c'est synonyme d'infection virale
Fonctionnement : une fois le ligand associé à son récepteur on a 2 voies possibles :
1ére voie Myd88
:
Myd= adaptateur qui va venir se fixer sur les récepteurs TIR et va s'associer avec une protéine IRAK-4 qui est une
protéine kinase : transmission du signal grâce aux adaptateurs au reste de la cellule qui va entrainer une activation
de NFkB qui est un facteur de l'inflammation (facteur de transcription) qui va rentrer dans le noyau, interagir avec
les promoteurs et activer des gènes cibles (notamment les cytokines inflammatoires).
3/8

2016-2017 Immunité innée
Plus fréquentes IL-1, TNF, IL-12
Voie utilisée par la majorité des TLR sauf TLR 3
2éme voie TRIf pour TLR 3 et TLR4
TLR4 peut utiliser les 2 voies.
Le facteur de transcription impliqué dans l'activation de la cellule ne va pas être le même. On va activer les
facteurs de transcriptions IRF 3 et IRF7 : ce sont les facteurs de transcription spécifiques de réponse anti-virale
(lorsqu'ils sont activés on a une réponse anti-virale). On voit cette réponse anti-virale par la production
d'interférons de type 1 : IFN-α, IFN-β.
Utilisation des TLR à des fins thérapeutiques : immuno-intervention
✔ligands de TLR comme adjuvants en vaccination :
Agoniste de TLR4 : adjuvant ASO4 (GSK)= monophosphoryl lipid A + alun
vaccin HPV (CEVARIX), HBV (FENDRIX)
✔Traitement verrues génitales externes de l'adulte, carcinome basocellulaire superficiel de l'adulte : agoniste
de TLR7 imiquinod (aldara)
4/8

2016-2017 Immunité innée
C) Les NLRs « NO-like receptors »
Ce sont des récepteurs intracellulaires uniquement, composés de domaines riches en leucine.
Ils ont un domaine centrale impliqué dans l'oligomérisation et fixation de nucléotides (ATP, ADP) et
reconnaissance MAMP, DAMP ainsi qu'un domaine de recrutement et d'activation des caspases.
Un ligand va pouvoir activer plusieurs types de récepteurs.
20 gènes de NLR (NAIP, NLRP...)
NOD2 = muramyl dipeptide (MDP) : les mutations dans NOD2 créent des susceptibilités pour la maladie de
Crohn, constituant de la paroi des bactéries
NOD1 = muropeptides (iE-DAP), constituant de la paroi des bactéries
Fonctions des NLR
:
–activation des gènes anti-microbiens
–quand ces motifs sont activés ils vont s'agréger et former un inflammasome qui active la caspase-1
(protéase qui est intégrée dans l'inflammasome et qui va couper des morceaux de pro-cytokines) =>
production d'IL-1B et d'IL-18 qui induisent l'état inflammatoire
Le stress, le potassium, des espèces réactives de l'oxygène (ROS) sont capables d'activer les NLRP3 => le
stress cellulaire est capable d'activer des NLR
Mutation de NLRP3 => syndrome anti-inflammatoire
L'auto-inflammasome peut être activé par le froid et provoquer des états inflammatoires constants (=
maladies auto-inflammatoires)
/!\ différent de la maladie auto-immune !!
5/8
 6
6
 7
7
 8
8
1
/
8
100%