L’ Le cancer épidermoïde de l’anus : actualités thérapeutiques en 1998 A

ACTUALITÉ THÉRAPEUTIQUE
52
La Lettre du Cancérologue - volume VII - n° 2 - mars-avril 1998
objectif du traitement des cancers épidermoïdes
du canal anal est d’obtenir une guérison tout en
conservant intact le système ano-sphinctérien.
Dans les années 80, la radiothérapie s’est imposée comme le
traitement de référence des cancers du canal anal, remplaçant
le traitement par amputation abdomino-périnéale antérieure-
ment proposé (tableau I), cette chirurgie mutilante étant réservée
aux échecs de la radiothérapie.
La radiothérapie exclusive des cancers épidermoïdes du canal
anal permet une survie à 5 ans de l’ordre de 50 à 60 % pour un
taux de contrôle local de 60 à 80 % (1). Ces résultats dépen-
dent du volume tumoral exprimé selon le stade TNM de la
classification de l’UICC ou du RTOG (tableau II).
Pour les T1-T2, le taux de survie à 5 ans est de 70 à 85 % et le
taux de contrôle locorégional de 70 à 90 % (1) ; cette survie à
5 ans est, pour les T3-T4, de 50 à 60 % pour un taux de contrôle
locorégional de 30 à 50 %.
Dans ces formes étendues, Nigro (2) a démontré l’efficacité
d’une irradiation pelvienne préopératoire à la dose de 30 Gy en
15 fractions, associée à une chimiothérapie par le 5 fluoro-ura-
cile (5-FU) en perfusion continue et la mitomycine C (MMC).
Depuis lors, sur de petites séries, de nombreux auteurs ont
retrouvé des taux de réponse complète de l’ordre de 75 à 90 %
pour des survies à 4 ans de 75 à 80 % (3).
À partir de ces données, quatre questions se sont posées :
– L’association radiochimiothérapie est-elle supérieure à la
radiothérapie seule ?
– La MMC est-elle indispensable au sein de la chimiothérapie
initiale avec le 5 FU ?
– 5-FU-MMC est-elle la meilleure chimiothérapie ?
– Quelle est la “bonne” dose de radiothérapie ?
SUPÉRIORITÉ DE LA CHIMIORADIOTHÉRAPIE SUR
LA RADIOTHÉRAPIE EXCLUSIVE ?
Deux essais randomisés comparant radiothérapie exclusive et
radiochimiothérapie concomitante viennent de répondre par-
tiellement à la question :
L’essai de l’UKCCCR Anal Cancer Trial Working Party
(4)
Cinq cent quatre-vingt-cinq patients porteurs de carcinomes
épidermoïdes du canal anal ont été inclus dans cet essai rando-
* Centre de radiothérapie et d’oncologie médicale, Hôpital des Peupliers,
Croix-Rouge française, Paris.
Le cancer épidermoïde de l’anus :
actualités thérapeutiques en 1998
●
Th. Bouillet*
L’
Séries Nombre Survie 5 ans (%) Rechute locale (%)
de patients
Harcastle 1968 92 48 27
Greenall 1984 103 55 27
Boman 1984 114 71 40
Frost 1984 109 62 27
Tableau I. Résultats chirurgicaux. Amputation abdomino-périnéale.
Comparaison difficile avec les traitements conservateurs car :
–
classification anatomopathologique et
–
patients selectionnés pour les séries chirurgicales.
Au total chirurgie :
– perte du sphincter,
– morbidité postopératoire de 5 à 8 %,
– 50 à 60 % de survie à 5 ans,
– 30 % de rechutes pelvi-périnéales.
Stade tumoral RTOG UICC
T1 < 1/3 circonférence < 2 cm
ou longueur dans la plus
du canal et grande dimension
pas d’infiltration
du sphincter externe
T2 > 1/3 circonférence taille de 2 à 5 cm
ou longueur dans la plus
du canal grande dimension
ou infiltration
du sphincter externe
T3 extension rectum taille > 5 cm
ou peau
T4 atteinte idem (vessie,
structures voisines urètre,vagin)
N0 pas de métastase idem
ganglionnaire
N1 envahissement GG envahissement des
Tableau II. Deux classifications : UICC, RTOG.
UICC : ne tient pas compte de l’envahissement en circonférence ;
reste lourde sur la classification des ganglions.
RTOG : plus clinique et échographique.
En fait, barrière = 4 à 5 centimètres.
vol VII/n°2 avr. 23/04/04 10:03 Page 52

53
La Lettre du Cancérologue - volume VII - n° 2 - mars-avril 1998
misé. Tous les patients, quelle que soit la taille de la tumeur,
étaient inclus en dehors des situations métastatiques et des
lésions accessibles à une chirurgie conservatrice locale par
simple excision classées T1N0.
Les 585 patients ont été traités soit par une irradiation exclusive
à la dose de 45 Gy en 20 à 25 fractions sur 4 à 5 semaines
(290 patients), soit par la même irradiation associée à une chi-
miothérapie par 5-FU (1 g/m24 jours de suite ou 750 mg/m2
5 jours de suite) en perfusion continue les première et cinquième
semaines de radiothérapie et MMC 12 mg/m2à J1 (295 patients).
Les réponses étaient évaluées cliniquement six semaines après
la fin de la radiothérapie à 40-45 Gy. En cas de réponse com-
plète ou de réponse supérieure à 50 %, un complément par
irradiation externe de 15 Gy ou par curiethérapie de 25 Gy
était réalisé. Les non-répondeurs ou les répondeurs inférieurs à
50 % à la dose de 40 à 45 Gy étaient opérés.
Les résultats de cet essai randomisé sont donnés avec un recul
moyen de 42 mois (28 à 62 mois) (tableau III).
Il n’y a pas d’arrêt du traitement plus fréquent en cours de
radiothérapie dans le groupe chimiothérapie plus radiothérapie
que dans le groupe radiothérapie exclusive. Les taux de toxicité
chronique à distance de la radiothérapie et de morbidité post-
opératoire en cas de chirurgie de sauvetage sont identiques
dans les deux bras.
Les taux de réponse complète et supérieure à 50 % à 45 Gy
sont de 30 et 62 % dans le groupe radiothérapie seule contre
39 et 53 % dans le groupe chimioradiothérapie.
Le taux d’échec ou de réponse inférieure à 50 % est le même,
respectivement de 9 % dans le groupe radiothérapie et de 8 %
dans le groupe radiochimiothérapie.
Le taux de rechute à 3 ans est de 39 % dans le bras radiochi-
miothérapie contre 61 % dans le bras radiothérapie seule
(p < 0,0001). La plupart de ces rechutes surviennent dans les
18 mois au décours du traitement.
Vingt patients ont eu une colostomie ou une amputation abdo-
mino-périnéale pour morbidité, radionécrose ou problème
fonctionnel (10 dans le groupe radiochimiothérapie, 10 dans le
groupe radiothérapie).
Il y a eu, à la date de l’analyse, 236 décès dont 180 par cancer,
65 % pour maladie locorégionale et 40 % pour métastase.
La survie globale à 3 ans est identique dans les 2 traitements
comparés (58 % radiothérapie seule et 65 % radiochimiothérapie).
En revanche, le taux de décès par cancer est à 3 ans de 28 %
dans le bras radiochimiothérapie contre 39 % dans le bras
radiothérapie seule, avec un risque relatif de décès égal à 0,71
(p = 0,02).
Essai randomisé de l’EORTC
(5)
Cent dix patients porteurs de lésions T3-T4 N0-3 ou T1-T2
N1-3 épidermoïdes du canal anal ont été traités selon deux
bras de randomisation. Le bras radiothérapie exclusive déli-
vrait 45 Gy sur cinq semaines sous forme de 5 fractions de
1,80 Gy chacune, les patients étant réévalués après six
semaines de repos, avec un complément de radiothérapie en
cas de réponse partielle supérieure à 50 % ou de réponse com-
plète, ou une chirurgie en cas d’échec.
Le bras chimioradiothérapie comportait la même radiothérapie
plus une chimiothérapie par 5-FU en perfusion continue
(750 mg/m2/j 5 jours de suite) les première et quatrième
semaines de radiothérapie et MMC (15 mg/m2) à J1.
Les résultats retrouvent une amélioration du taux de contrôle
locorégional et de survie sans progression. Le taux de réponse
complète en fin de radiothérapie est de 54 % pour le groupe
radiothérapie seule et de 80 % pour le groupe radiochimiothé-
rapie (p = 0,02).
De même, le taux de contrôle locorégional et le taux de
conservation sphinctérienne à 5 ans sont augmentés respective-
ment de 18 % (p = 0,02) et de 32 % (p = 0,002) par l’addition
de chimiothérapie.
Si le nombre de rechutes locorégionales est diminué par
l’adjonction de la chimiothérapie (25 dans le bras radiothé-
rapie seule contre 15 dans le bras radiochimiothérapie), le taux
d’évolution métastatique est identique dans les deux bras (res-
pectivement 11 et 9).
En termes de survie, l’adjonction de la chimiothérapie améliore
la survie sans récidive (p = 0,05) mais sans amélioration de la
survie globale qui est, en mode actuariel à 5 ans, de 56 % pour
l’ensemble de la population, sans différence dans les deux bras
(tableau IV).
Les toxicités aiguë et chronique sont identiques dans les deux
bras.
Ces deux essais UKCCCR et EORTC retrouvent une améliora-
tion du taux de contrôle locorégional et du taux de conserva-
tion ano-sphinctérienne ainsi qu’une diminution du risque de
décès par cancer de l’anus, mais sans modification du risque
métastatique et sans amélioration du taux de survie globale,
tous résultats obtenus sans augmentation du taux de complica-
tions postradiques.
LA MITOMYCINE C (MMC) EST-ELLE INDISPENSABLE ?
La chimiothérapie utilise des protocoles 5-FU et MMC, selon
les travaux de Nigro (2), et reproduits dans plusieurs essais
non randomisés (3).
Néanmoins, la MMC ayant un certain nombre d’effets secon-
daires, son utilité a été discutée et un essai randomisé de phase
III évaluant son apport a été publié par le RTOG/ECOG (6).
RP > 50 % RC Rechute Survie Taux de décès
locorégionale à 3 ans par cancer
à 3 ans à 3 ans
RT 62 % 30 % 61 % 58 % 39 %
RT + CT 53 % 39 % 39 %, p < 0,0001 65 % 28 %, p = 0,02
Tableau III. Résultats de l'essai de l'UKCCCR Anal Cancer Trial
Working Party.
RC Récidive locorégionale
RT 54 % 48 %
RT + CT 80 %, p = 0,02 29 %, p = 0,02
Tableau IV. Résultats de l’essai EORTC.
vol VII/n°2 avr. 23/04/04 10:03 Page 53

ACTUALITÉ THÉRAPEUTIQUE
54
La Lettre du Cancérologue - volume VII - n° 2 - mars-avril 1998
Dans cet essai, 310 patients ont été randomisés en deux bras,
radiothérapie plus 5-FU contre radiothérapie plus 5-FU-MMC.
Sur les 291 patients évaluables, 145 avaient reçu une irradia-
tion de 45 à 50,4 Gy associée à une administration de 5-FU en
perfusion continue (1 g/m2quatre jours de suite), les première
et quatrième semaines de radiothérapie. L’autre groupe de
146 patients a reçu la même radiothérapie, mais associée à 5-FU-
MMC à J1 et J28 avec chaque début de 5-FU.
Les patients ont été réévalués 4 à 6 semaines après la fin de
cette radiochimiothérapie à 45-50 Gy avec biopsie systéma-
tique du site tumoral initial. Si cette biopsie revenait négative,
le patient était simplement surveillé ; si la biopsie revenait
positive, les patients recevaient un traitement complémentaire
sous forme de 9 Gy en 5 fractions de 1,80 Gy chacune sur le
site tumoral résiduel, associé à une chimiothérapie par 5-FU en
perfusion continue et cisplatine (tableau V).
Six semaines plus tard, les patients étaient à nouveau biopsiés ;
si cette biopsie restait positive, une amputation abdomino-péri-
néale était réalisée.
En termes de toxicité, il existe une augmentation de la toxicité
aiguë, en particulier hématologique, dans le groupe 5-FU-
MMC. Dans le groupe 5-FU, 7 % des patients ont une toxicité
grade IV sans toxicité fatale contre 23 % de toxicité grade IV
et 2,7 % de décès par toxicité (4 patients) dans le groupe 5-FU-
MMC (p < 0,001). Les toxicités chroniques sont identiques
dans les deux bras.
L’analyse des réponses locorégionales se fait selon le taux de
biopsie négative après irradiation et selon le taux de colosto-
mie à terme.
Le taux de biopsie négative après 45-50 Gy est de 86 % dans
le bras radiothérapie et monochimiothérapie par 5-FU seul
contre 92 % dans le bras 5-FU-MMC (p = 0,135).
En revanche, à 4 ans, 9 % des patients 5-FU-MMC contre
23 % des patients 5-FU seul sont porteurs d’une colostomie
(p = 0,002). Là aussi, la quasi-totalité des rechutes pelviennes
est enregistrée dans les 2 ans.
Cette diminution du taux de colostomie est significative dans le
groupe des tumeurs T3-T4 (p = 0,019), avec un taux de colosto-
mie de 29 % pour le bras 5-FU seul contre 13 % pour le bras
5-FU-MMC. Par contre, le taux de colostomie à 4 ans dans le
groupe des tumeurs classées T1-T2 est respectivement de 15 %
et de 7 % pour le bras radiothérapie + 5-FU et le bras radiothé-
rapie + 5-FU-MMC (p = 0,14). Cet effet du volume tumoral
n’est pas retrouvé dans le bras 5-FU-MMC, avec un taux de
colostomie identique dans les groupes T3-T4 et T1-T2.
En termes de survie sans rechute, les deux groupes sont égale-
ment différents avec, à 4 ans, 73 % de patients en vie sans
rechute dans le groupe 5-FU-MMC contre 51 % dans le groupe
5-FU seul (p = 0,0003). Par contre, la survie globale est la
même (p = 0,31).
Vingt-cinq patients sur 28 en échec après une première radio-
chimiothérapie ont reçu un sauvetage par 5-FU, platine et
radiothérapie avec des biopsies rendues négatives dans 55 %
des 22 cas biopsiés et des taux de survie à 4 ans sans colosto-
mie et sans rechute respectivement de 32 et 50 %.
Cet essai de phase III randomisé démontre l’importance de la
mitomycine C avec une amélioration du taux de contrôle loco-
régional, une amélioration du taux de conservation sphincté-
rienne et une amélioration du taux de survie sans rechute à
4 ans, mais sans modification du taux global de survie. Cette
amélioration du pronostic semble surtout obtenue dans les
lésions classées T3-T4.
Cet essai retrouve également la possibilité d’un rattrapage par
une chimiothérapie 5-FU, cisplatine combinée à la radiothérapie.
UNE AUTRE CHIMIOTHÉRAPIE EST-ELLE SUPÉRIEURE
À L’ASSOCIATION 5-FU- MITOMYCINE C ?
Les résultats des associations 5-FU-MMC-radiothérapie res-
tent modestes, en particulier dans les grosses lésions avec plus
de 35 % de rechutes locorégionales à 2 ans (4, 5) et plus de
10 % de rechutes métastatiques (4). Les résultats obtenus avec
d’autres drogues en chimiothérapie d’induction ou en associa-
tion radiosensibilisante dans les cancers bronchiques et les
cancers ORL avec, en particulier, le cisplatine et les taxanes
ont amené un certain nombre d’auteurs à évaluer d’autres asso-
ciations chimiothérapiques.
Le cisplatine (CDDP) donne des taux de réponse de 55 % sur
des patients porteurs de carcinome épidermoïde de l’anus en
rechute locale ou métastatique (7), et de 82 % dont 27 % de
réponses complètes en situation néo-adjuvante (8).
L’association CDDP-5-FU-radiothérapie permet un rattrapage
dans 55 % des cas de patients en échec d’une première ligne
5-FU-MMC-radiothérapie (6).
Trois phases II ont été publiées sur 5-FU-CDDP combiné à la
radiothérapie.
L’ECOG (9) a réalisé une association radiochimiothérapique
concomitante associant 2 cycles de 5-FU et CDDP à une irra-
diation à 60 Gy avec, sur 19 patients évaluables, 15 réponses
complètes (79 %).
L’essai du groupe des tumeurs digestives de la FFNCLCC (10)
a associé 4 cycles de chimiothérapie 5-FU-CDDP (5-FU
800 mg/m2/j 4 jours de suite en perfusion continue et cisplatine
80 mg/m2à J1) : 2 avant la radiothérapie et 2 pendant. La
radiothérapie était réalisée de façon concomitante avec les
cycles 3 et 4 à la dose de 45 Gy sous forme de 5 fractions
hebdomadaires de 1,80 Gy chacune. Quatre à 6 semaines de
repos étaient ménagées avant un complément d’irradiation
de 15 à 20 Gy.
Sur 29 patients évaluables, le taux de réponse à la chimiothérapie
d’induction après 2 cycles est de 72 %, dont 11 % de réponse
complète. Le taux de réponse après radiochimiothérapie avant
complément d’irradiation est de 90 % pour 96 % de réponses
complètes à la fin du complément d’irradiation.
La phase II du MD Anderson utilise une radiothérapie associée
à une chimiothérapie quotidienne en continue (11). Soixante-
Toxicité Biopsie Colostomie Survie à 4 ans
de grade 4 négative sans rechute
RT + 5-FU 7 % 86 % 23 % 51 %
RT + 5-FU + MMC 23 %, p<0,001 92 %, p = 0,135 9 %, p = 0,002 73 %, p = 0,0003
Tableau V. Essai intergroupe sur le rôle de la mitomycine C.
vol VII/n°2 avr. 23/04/04 10:03 Page 54

55
La Lettre du Cancérologue - volume VII - n° 2 - mars-avril 1998
deux patients ont été traités par 5-FU (250 mg/m2/j en perfu-
sion continue sur 24 heures) et CDDP (4 mg/m2/j) associés à
une radiothérapie à la dose de 55 Gy sous forme de 5 fractions
hebdomadaires de 1,80 Gy chacune.
Il n’y a aucun arrêt du traitement pour toxicité hématologique
et pas de toxicité létale. Avec un suivi moyen de 34 mois, le
taux de réponse observé est de 84 % (52 patients), pour un
taux de contrôle actuariel à 5 ans de 76 %.
Au total, si dans ces essais de 5-FU-CDDP adjuvant ou radio-
sensibilisant, phases II incluant peu de malades, les taux de
réponse au contrôle locorégional semblent supérieurs à ceux
obtenus avec l’association classique 5-FU-MMC, et ce pour
une toxicité inférieure, il reste néanmoins à prouver, sur un
essai de phase III randomisé, un éventuel bénéfice, en particu-
lier une éventuelle modification du taux d’évolution métasta-
tique et de survie globale.
QUELLE EST LA BONNE DOSE DE RADIOTHÉRAPIE ?
La crainte la plus importante concernant l’utilisation des asso-
ciations radiochimiothérapiques est de voir augmenter les taux
de toxicités chroniques. Les séries d’association radiochimio-
thérapie 5-FU-MMC sont prévues avec une dose de radiothé-
rapie réduite aux environs de 45 à 50 Gy (3, 6, 12).
Cependant, des séries analysées sur un mode rétrospectif
retrouvent une corrélation entre la dose délivrée et le taux de
contrôle locorégional pelvien. Ainsi, Nigh (13) rapporte un taux
de contrôle pelvien de 64 % pour une dose de moins de 45 Gy,
de 77 % entre 45 et 55 Gy et de 92 % au-delà de 55 Gy. De
même, Hughes (14), en radiothérapie associée à du 5-FU en
continu, rapporte un contrôle pelvien de 50 % en cas de dose de
45 à 49 Gy contre 90 % pour des doses de plus de 55 Gy.
Outre cet effet dose, la durée totale du traitement a probable-
ment également une influence sur le taux de contrôle loco-
régional.
Les essais actuels laissent une période de repos de 4 à
6 semaines entre le premier temps d’irradiation à 40-45 Gy et
le complément d’irradiation de 15 à 20 Gy, augmentant de
façon importante la durée totale du traitement pouvant altérer
le taux de contrôle locorégional.
Ainsi, Allal (15), sur une série de 137 patients traités par radio-
thérapie exclusive ou radiochimiothérapie concomitante,
retrouve un taux de contrôle locorégional à 5 ans de 76 %
avec, comme facteur de risque de rechute locorégionale, une
taille tumorale supérieure à 1/3 de la circonférence du canal
anal (67 vs 90 %), un envahissement ganglionnaire (64 vs
81 %), une durée totale de traitement supérieure à 75 jours
(69 vs 85 %). En analyse multivariée, seule la durée totale du
traitement reste à la limite de la significativité (p = 0,09)
comme facteur de risque de rechute locorégionale.
Dose totale élevée, durée de traitement court, chimiothérapie
concomitante ont été testées par le RTOG (16) dans un essai
de phase II sur 20 patients porteurs de lésions supérieures à
2 cm et traités à 60 Gy sous forme de 5 fractions hebdoma-
daires sur 6,5 semaines, associés à deux cycles de chimiothé-
rapie par 5-FU et MMC. Seuls 10 jours de repos étaient permis
en cas de réaction cutanée sévère ; 50 % des patients ont pu
réaliser l’ensemble du traitement sans interruption, et les 50 %
restants ont eu une interruption d’une moyenne de 11 jours (de
7 à 19 jours). Le taux de colostomie à un an est de 11 %, à
comparer au même protocole antérieurement publié par le
même groupe RTOG, avec une période systématique d’arrêt
du traitement de 2 semaines à la dose de 36 Gy et un taux de
colostomie à un an de 23 %.
Une dose de 60 à 65 Gy sur 7 à 9 semaines semble donc être la
“bonne dose-étalement”.
ASSOCIATION CANCERS DE L'ANUS ET HUMAN
PAPILLOMAVIRUS (HPV)
La présence de human papillomavirus est associée à des carci-
nomes ano-génitaux intra-épithéliaux infiltrants. Les modes
d'action biologiques des oncogènes E6 et E7 des HPV agressifs
sont connus et ouvrent la perspective d’une vaccination (17).
Un groupe scandinave (18) a publié une étude de cohorte por-
tant sur 417 patients porteurs de cancers du canal anal, sur
534 patients porteurs d'adénocarcinomes du rectum et sur
554 sujets sains servant de contrôle.
Une recherche systématique de possibles facteurs de risque de
cancers de l'anus a été réalisée, interrogatoire associé à une
recherche de human papillomavirus par PCR sur les biopsies
tissulaires.
Au sein de la population féminine en analyse multivariée, il
existe une corrélation entre le risque de cancer anal et le
nombre de partenaires, la notion de rapports ano-génitaux,
l'âge (< 30 ans) pour le premier rapport ano-génital, les antécé-
dents personnels de maladie sexuellement transmissible ou de
carcinome cervical in situ.
Au sein de la population masculine en analyse multivariée, il
existe une corrélation entre l'incidence des cancers de l'anus,
d'une part et, d'autre part, le nombre de partenaires de sexe
féminin et les antécédents de maladie sexuellement transmis-
sible.
Quinze pour cent des patients de sexe masculin porteurs de
cancers de l'anus déclaraient des rapports homosexuels contre
aucun parmi les cas contrôles (p < 0,001).
Une recherche d'HPV a été réalisée en PCR pour 394 des
417 patients porteurs de cancers de l'anus et pour 20 des cas
contrôles porteurs de cancers du rectum.
Trois cent quarante des 388 PCR réussies sur les tissus de
cancer anal sont positives pour l'HPV, dont 283 positives pour
l'HPV 16.
Quatre-vingt-treize pour cent des tissus issus de 304 femmes
porteuses de tumeurs anales sont positifs pour l'HPV contre
69 % sur les biopsies tumorales issues de 84 hommes porteurs
de cancers de l'anus (p < 0,001).
Aucune des PCR réalisées sur les 20 cancers du rectum n'a été
positive pour l'HPV.
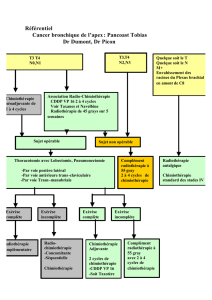
CONCLUSION
Il existe dès lors deux formes de tumeurs du canal anal en
fonction des critères de pronostic ; ceux-ci sont au mieux définis
par l’examen clinique et par l’échographie endo-anale (EEA)
(19), qui permet d’évaluer l’extension en profondeur et l’enva-
vol VII/n°2 avr. 23/04/04 10:03 Page 55

ACTUALITÉ THÉRAPEUTIQUE
56
La Lettre du Cancérologue - volume VII - n° 2 - mars-avril 1998
hissement ganglionnaire.
Les petites tumeurs de moins de 3 cm, d’extension inférieure au
tiers de la circonférence et sans envahissement ganglionnaire,
classées T1 ou T2, sont susceptibles d’être traitées par radio-
thérapie seule.
Les grosses tumeurs supérieures à 4 cm avec envahissement
ganglionnaire, classées T3 ou T4 en EEA, doivent être traitées
par radiochimiothérapie à pleine dose de radiothérapie
(60-65 Gy) sur une période inférieure à 9 semaines associée à
une chimiothérapie de type 5-FU-mitomycine C ou cisplatine,
sous forme de deux cycles d’induction et de deux cycles
concomitants à la radiothérapie. L’examen clinique et l’EEA
doivent être répétés après les deux cycles de chimiothérapie
d’induction, une absence de réponse semblant être un élément
de mauvais pronostic.
Dans les deux populations, qu’elles soient traitées par radiothé-
rapie seule ou radiochimiothérapie selon les facteurs pronos-
tiques, une réévaluation clinique et échographique doit être sys-
tématique à 45 Gy, une absence de réponse à ce niveau de dose
devant faire évoquer un échec du traitement conservateur.
Selon Peiffert (20), une non-réponse au décours du premier
temps d'irradiation externe à 45 Gy est corrélée à un taux faible
de contrôle locorégional et de survie.
Dès lors, l'échec du premier temps d'irradiation externe doit
faire discuter d'emblée une chirurgie mutilante (4, 5, 20) ou une
radiochimiothérapie de sauvetage (6).■
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Schlienger M., Touboul E., Balosso J. et coll. Cancers épidermoïdes du canal
anal : traitements et résultats. Cancérologie Aujourd’hui 1995 ; 4 : 196-206.
2. Nigro N.D. An evaluation of combined therapy for squamous cell cancer of
the anal canal. Dis Colon rectum 1984 ; 27 : 763-6.
3. Martenson J.A., Lipsitz S.R., Lefkopoulou M. et coll. Results of combined
therapy for patients with anal cancer (E7283). Cancer 1995 ; 76 : 1731-6.
4. UKCCCR. Anal Cancer Trial Working Party. Epidermoid anal cancer
results from the UKCCCR randomized trial of radiotherapy alone versus
radiotherapy, 5-fluorouracil and mitomycin. Lancet 1996 ; 348 : 1049-54.
5. Bartelink H., Roelofsen F., Eschwege F. et coll. Concomitant radiotherapy
and chemotherapy is superior to radiotherapy alone in the treatment of locally
advanced anal cancer : results of a phase III randomized trial of the European
Organization for Research and Treatment of Cancer Radiotherapy and
Gastrointestinal Cooperative Groups. J Clin Oncol 1997 ; 15 : 2040-9.
6. Flam M., John M., Pajak T.F. et coll. Role of mitomycin in combination with
fluorouracil and radiotherapy, and of salvage chemoradiation in the definitive
nonsurgical treatment of epidermoid carcinoma of the anal cancer : results of a
phase III randomized Intergroup Study. J Clin Oncol 1996 ; 14 : 2527-39.
7. Mahjoubi M., Sadek H., Francois E. et coll. Epidermoid anal carcinoma :
activity of cisplatin and continuous 5-fluorouracil in metastatic and/or local
recurrent disease. Proc Am Soc Clin Oncol 1990 ; 9 : 114.
8. Brunet R., Sadek H., Vignoud J. et coll. Cisplatin and 5-fluorouracil for the
neoadjuvant treatment of epidermoid anal canal carcinoma. Proc Am Soc Clin
Oncol 1990 ; 9 : 104.
9. Martenson J., Lipsitz S., Wagner H. et coll. Initial results of a phase II trial
of high dose radiation therapy, 5-fluorouracil and cisplatin for patients with
anal cancer (E4292). Int J Radiat Oncol Biol Phys 1996 ; 35 : 745-9.
10. Peiffert D., Seitz J.F., Rougier P. et coll. Preliminary results of a phase II
study of high-dose radiation therapy and neoadjuvant plus concomitant
5-fluorouracil with CDDP chemotherapy for patients with anal canal cancer :
a French cooperative study. Ann Oncol 1997 ; 8 : 575-81.
11. Paleologo F., Goswitz M., Skibber J. et coll. Results of radiation and
continuous infusion 5-fluorouracil and cisplatin for anal cancer. Int J Radiat
Oncol Biol Phys 1997 ; 39 (suppl. 2) : 135.
12. Cummings B., Keane T., O’Sulliman B. et coll. Epidermoid anal cancer :
treatment by radiation alone or by radiation and 5-fluorouracil with or without
mitomycin C. Int J Radiat Oncol Biol Phys 1991 ; 21 : 1115-25.
13. Nigh S., Smalley S., Elman A. et coll. Conservative therapy for anal
carcinoma : an analysis of prognostic factors. Int J Radiat Oncol Biol Phys
1991 ; 21 (suppl. 1) : 1994.
14. Hughes L., Rich T., Delclos L. et coll. Radiotherapy for anal cancer :
experience from 1979-1987. Int J Radiat Oncol Biol Phys 1989 ; 17 : 1153-60.
15. Allal A., Mermillod B., Roth A. et coll. The impact of treatment factors on
local control in T2-T3 anal carcinomas treated by radiotherapy with or without
chemotherapy. Cancer 1997 ; 79 : 2329-35.
16. John M., Pajak T., Kreig R. et coll. Dose escalation without split-course
chemoradiation for anal cancer : results of a phase II RTOG Study. Int J Radiat
Oncol Biol Phys 1997 ; 39 (suppl. 2) : 136.
17. Alani R.M., Munger K. Human papillomaviruses and associated
malignancies. J Clin Oncol 1998 ; 16 : 330-7.
18. Frisch M., Glimelius B., Van Der Brule A. et coll. Sexually transmitted
infection as a cause of anal cancer. N Engl J Med 1997 ; 19 : 1350-8.
19. De Parades V., Parisot C., Bouillet T. Echographie endo-anale et cancer
du canal anal. Hépato-Gastro 1996 ; 3 : 477-80.
20. Peiffert D., Bey P., Pernot M. et coll. Conservative treatment by
irradiation of epidermoid cancers of the anal cancer : prognostic factors of
tumoral control and complications. Int J Radiat Oncol Biol Phys 1997 ; 37 :
vol VII/n°2 avr. 23/04/04 10:03 Page 56
1
/
5
100%