corrigé - Académie de Nancy-Metz

1
Épreuve commune de Sciences Physiques 2013 – Niveau 4ème - Collège CHARLET – Remiremont
Collège CHARLET – REMIREMONT
SCIENCES PHYSIQUES
Classe de 4éme
Épreuve commune 2013 – durée : 1h00
CHIMIE : LA POLLUTION LIEE AUX TRANSPORTS
1- Lis attentivement le document ci-dessous.
En Île-de-France, la pollution de l’air est principalement liée aux activités de transport, le transport routier
apparaît ainsi comme le secteur émettant le plus de monoxyde de carbone, d’oxydes d’azote et de fumées.
Pour les émissions de dioxyde de carbone, le secteur des transports n'intervient qu'à hauteur de 28%, c'est le
secteur du chauffage qui prédomine avec 44,5% des émissions.
Les secteurs liés à la combustion, notamment l’industrie de l’énergie, sont majoritaires pour les émissions de
dioxyde de soufre.
a- D’après le document précédent, nomme 2 gaz polluants de l’air : oxydes d’azote, dioxyde de carbone,
monoxyde de carbone.
b- Indique la principale source de pollution au dioxyde de carbone. Le chauffage
c- Les transports routiers ne rejettent-ils que des gaz ? Sinon précise sous quelle autre forme se trouvent
les rejets. Précise de quoi est formé ce rejet.
Non, ils rejettent également des fumées qui sont formées de particules solides en suspension dans un gaz.
d- Explique d’où provient généralement le monoxyde de carbone. Précise pourquoi il est dangereux.
Le monoxyde de carbone est principalement produit par des combustions incomplètes. Il est dangereux
car c’est un gaz très toxique qui bloque le transport du dioxygène dans le sang.
e- L’air de Paris est-il un corps pur ou un mélange ? Justifie ta réponse. C’est un mélange car il est formé
d’au moins deux gaz.
f- Cite les deux principaux constituants d’un air non pollué et leur proportion : le diazote : 80 % et le
dioxygène 20 %.
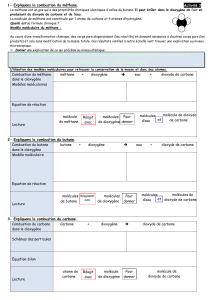
2- La majorité des voitures et des bus fonctionnent avec des moteurs à combustion. En effet, l’essence est
brûlée dans le moteur et les produits de cette combustion (gaz et fumées) sont rejetés par le pot
d’échappement.
L’octane est le principal constituant de l’essence.
On a représenté son modèle moléculaire ci-contre.
a- A l’aide des symboles des atomes, écris la
formule de la molécule d’octane : C8H18
b- Explique pourquoi la combustion de l’essence est une transformation chimique. Au cours de la combustion
des substances disparaissent et de nouvelles se forment.
c- Nomme l’espèce chimique indispensable à la plupart des combustions. Indique sa formule moléculaire.
C’est le dioxygène de formule O2.
d- Précise le rôle de ce dernier lors d’une combustion : Il joue le rôle de comburant.
e- Nomme le 3ème élément nécessaire pour démarrer la combustion : Une source d’énergie est nécessaire pour
démarre la combustion.
Numéro d’anonymat : …………
Atome de carbone
Atome d’hydrogène

2
Épreuve commune de Sciences Physiques 2013 – Niveau 4ème - Collège CHARLET – Remiremont
3- Toutes les matières organiques brûlent en formant les mêmes gaz. Une matière organique est
principalement formée d’atomes de carbone et d’hydrogène.
a- Le méthane est une matière organique. Justifie le en écrivant sa formule moléculaire : CH4
b- La combustion de l’octane forme 2 produits. Nomme ceux-ci à partir des résultats aux tests suivants :
Le premier trouble l’eau de chaux : Le dioxyde de carbone.
Le deuxième bleuit le sulfate de cuivre anhydre : L’eau.
c- En t’aidant des réponses précédentes (2c et 3b), complète le bilan de la combustion de l’octane.
Complète aussi les pointillés sous le bilan.
Octane + dioxygène dioxyde de carbone + eau
Réactifs Produits
d- L’équation de la combustion de l’octane s’écrit :
2 C8H18 + 25 O2 16 CO2 + . . . H2O
Indique la signification du nombre 25 dans 25 O2 : C’est le nombre de molécules de dioxygène qui
réagissent.
Choisis la bonne réponse par les propositions suivantes : Il se forme 9 / 18 / 20 molécules d’eau.
Justifie ta réponse ci-dessous en calculant le nombre d’atomes d’hydrogène présents avant la combustion.
1 molécule d’octane contient 18 atomes d’hydrogène donc 2 molécules d’octane en contiennent 2 x 18 = 36.
Ces atomes se retrouvent totalement dans les molécules d’eau formées soit 18 molécules contenant
chacune 2 atomes.
e- Si 11 kg d’octane réagissent totalement avec 24 kg de dioxygène, calcule la masse totale de gaz
formés. Justifie ton calcul en citant une loi vue en classe.
Lors d’une transformation chimique, la masse totale se conserve.
Masse des réactifs consommés = 11 + 24 = 35 kg. Il se formera donc 35 kg d’eau et de dioxyde de
carbone.
f- Si la masse d’octane et de dioxygène consommé augmente, comment varie la masse des produits formés ?
Elle augmente également.
g- Propose une explication au conseil ci-contre donné par AIRPARIF lors
d’un pic de pollution au dioxyde de carbone.
Réduire la vitesse permet de consommer moins de carburant et donc de
produire moins de dioxyde de carbone.
4- Gonflage des pneus et consommation
a- Le dispositif représenté ci-dessous permet d’ajuster le gonflage des
pneus en y ajoutant de l’air.
Nomme l’appareil de mesure visible sur cette photographique :
C’est un manomètre (baromètre).
Indique ce qu’il permet de mesurer. Précise une unité.
Il permet de mesurer la pression en hectoPascal ou bar.
b- Rappelle la disposition des molécules dans un gaz.
Dans un gaz, les molécules sont en mouvement : elles sont désordonnées et dispersées.
Source : Airparif

3
Épreuve commune de Sciences Physiques 2013 – Niveau 4ème - Collège CHARLET – Remiremont
c- On a représenté les principales molécules de l’air dans un pneu de la voiture avant d’ajuster le gonflage.
Complète la légende.
Parmi les schémas ci-dessous, lequel représente correctement les molécules dans le pneu après gonflage.
Justifie en précisant pourquoi les autres schémas ne conviennent pas.
Le schéma B représente les molécules dans le pneu après gonflage.
Dans le schéma C, le nombre de molécules a diminué or on ajoute des molécules lors du gonflage.
Dans le schéma A, les molécules sont toutes identiques. Il ne s’agit plus d’air mais de diazote.
Indique en justifiant, le schéma correspondant au pneu le plus léger.
C est le pneu le plus léger car il contient le plus petit nombre de molécules.
Indique en justifiant, le schéma correspondant au pneu où la pression est la plus forte.
A est le pneu où la pression est plus forte car le nombre de molécules est le plus grand dans le même
volume. Le nombre de chocs des molécules sur les parois sera le plus important.
Explique pourquoi le pneu durcit au cours du gonflage.
Le nombre de molécules augmente (le volume reste quasiment constant). Les chocs sur les parois sont plus
nombreux.
Observe le tableau ci-contre (document de l’ADEME)
d- A l’aide des informations du tableau, explique pourquoi il
faut vérifier et ajuster régulièrement le gonflage des
pneumatiques.
Un sous gonflage entraîne une augmentation sensible de la consommation et donc des rejets de dioxyde de
carbone.
Sous-gonflage
Consommation de
carburant
- 300 hPa
+1,2%
- 500 hPa
+2,4%
- 1000 hPa
+6%
A
B
C
Molécule de diazote
Molécule de Dioxygène

4
Épreuve commune de Sciences Physiques 2013 – Niveau 4ème - Collège CHARLET – Remiremont
ELECTRICITE : CIRCUIT ELECTRIQUE DES PHARES D’UNE VOITURE
On a représenté ci-contre le circuit simplifié des phares avant d’une voiture.
On dispose de plusieurs exemplaires des lampes suivantes :
1- Afin de choisir la lampe adaptée, on désire mesurer la tension aux bornes de la batterie (générateur).
a- Nomme l’appareil de mesure à utiliser et précise son mode de branchement : voltmètre en dérivation.
b- Représente le symbole correctement branché pour effectuer la mesure sur le schéma ci-dessus.
2- La façade de l’appareil de mesure est représentée ci-contre.
a- Colorie en rouge les bornes à utiliser.
b- Observe bien l’indication affichée sur le cadran de l’appareil.
Indique s’il est possible de sélectionner un autre calibre. Justifie.
On peut utiliser un autre calibre car la mesure est inférieure à 20 V.
c- Explique l’intérêt d’ajuster le calibre lors d’une mesure.
Ajuster le calibre permet d’augmenter la précision de la mesure.
3- Indique les modifications qui ont été effectuées pour obtenir les affichages suivants.
: : :
Affichage : Les branchements de l’appareil ont été inversés.
Affichage : Le calibre sélectionné est 20 V
Affichage : Le calibre sélectionné est inférieur à la mesure. (2 ou 200 mV)
4- Indique avec les notations habituelles le résultat de la mesure la plus précise possible : U = 11,9 V
5- A peine placées dans les phares, les 2 lampes identiques brillent fortement puis grillent. Indique quelles
lampes (A, B, ou C) ont été utilisées sachant que chacune d’elles dispose à ses bornes de la tension du
générateur. Justifie.
La lampe choisie est en surtension. Sa tension nominale est très inférieure à celle qu’elle reçoit.
Comme la lampe reçoit 11,9 V, sa tension nominale est 3,5 V. Il s’agit de la lampe A.
6- Nomme la lampe (A, B, ou C) la plus adaptée aux phares de cette voiture. Justifie.
La lampe B est la plus adaptée car sa tension nominale est proche de la tension reçue.
7- Cite deux éléments du circuit aux bornes desquels la tension est nulle.
La tension aux bornes d’un fil et de l’interrupteur fermé est nulle.
8- « Lorsque l’interrupteur est ouvert, toutes les tensions du circuit sont nulles ».
L’affirmation précédente est-elle vraie ? Justifie en citant au moins deux exemples.
Non car il existe encore une tension aux bornes du générateur et de l’interrupteur ouvert.
|
11.9
- 11
3,5 V
12 V
24 V
Lampe A
Lampe B
Lampe C
11
mA COM V
0
V
mA
200
20
2
200mV
G
L1
L2
V
1
/
4
100%