Syndrome de Lemierre secondaire à une otite moyenne chronique cholestéatomateuse CAS CLINIQUE

CAS CLINIQUE
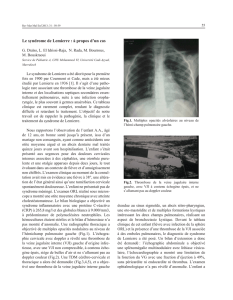
▲ Figure 1. Tomodensitométrie cérébrale en coupe axiale, avec injection de
produit de contraste montrant la thrombose du sinus latéral.
La Lettre d’ORL et de chirurgie cervico-faciale • n° 318 - juillet-août-septembre 2009 | 29
Mots-clés
Syndrome de Lemierre – Otite moyenne chronique –
Tomodensitométrie cervico-faciale – Antibiothérapie
Keywords
Lemierre’s syndrome – Chronic otitis – CT scan – Antibiotherapy
Syndrome de Lemierre secondaire
à une otite moyenne chronique
cholestéatomateuse
Lemierre’s syndrome as a complication of cholesteatoma
A. Benhammou*, H. Mimouni*, N. Nazih*, M. Boulaadas*, M.A. Benbouzid*, M. Boulaich*,
L. Essakali*, M. Kzadri*
* Service d’ORL et de chirurgie cervico-faciale, hôpital des spécialités, CHU de Rabat-salé,
Maroc.
L
e syndrome de Lemierre, ou nécrobacillose, est une affec-
tion rare définie comme une thrombophlébite septique de
la veine jugulaire interne ou d’une de ses branches, asso-
ciée à des emboles septiques. Il s’agit en fait d’une septicémie
à Fusobacterium necrophorum secondaire à une infection de
la sphère ORL, le plus souvent oro-pharyngée (1). Le point de
départ oto-mastoïdien, exceptionnel, doit cependant être
évoqué, puisque sa méconnaissance peut retarder le diagnostic,
alors que la morbidité dépend du délai de prise en charge.
À partir d’une observation de syndrome de Lemierre compli-
quant une otite moyenne chronique cholestéatomateuse
et d’une revue de la littérature, les auteurs se proposent de
rappeler la physiopathologie, la clinique et le traitement de
ce syndrome.
Observation
Notre patient, âgé de 17 ans, ayant un passé otitique à type
d’otorrhée purulente et fétide droite évoluant par poussées,
avec hypoacousie d’aggravation progressive et acouphènes,
n’a jamais été suivi. Il a consulté en urgence pour un syndrome
fébrile associé à des céphalées intenses et des vomissements,
avec toujours la même symptomatologie otologique. L’examen
retrouvait un patient conscient, sans déficit sensitivo-moteur
ni raideur de la nuque, mais qui présentait un empâtement
douloureux, mal limité, non inflammatoire de la région
jugulo-carotidienne droite, sans torticolis. L’otoscopie sous
microscope après aspiration a permis de mettre en évidence
une perforation tympanique totale et un volumineux polype
inflammatoire comblant la totalité de la caisse du tympan. Il
n’existait pas de paralysie faciale, de signes de mastoïdite ni
d’atteinte labyrinthique.

CAS CLINIQUE
◀ Figure 2.
Tomodensitométrie
cervicale
en coupe axiale (A)
et en reconstruc-
tion
sagittale (B), avec
injection
de produit de
contraste montrant
la thrombose
de la veine jugulaire
interne et la coulée
ganglionnaire
cervicale.
▼
▼ Figure 3. Tomodensitométrie des rochers montrant un aspect en faveur
d’une otite moyenne cholestéatomateuse.
A
B
30 | La Lettre d’ORL et de chirurgie cervico-faciale • n° 318 - juillet-août-septembre 2009
La ponction lombaire était normale. La tomodensitométrie
(TDM) cérébrale et cervicale avec injection intraveineuse de
produit de contraste a mis en évidence une thrombose du
sinus sigmoïde (figure 1) et de la veine jugulaire interne droite
(figure 2), ainsi qu’une coulée ganglionnaire allant de l’espace
rétrostylien à la région jugulo-carotidienne basse. Par ailleurs,
les coupes réalisées sur le rocher ont permis de retrouver des
signes en faveur d’une otite chronique cholestéatomateuse
droite (figure 3).
Le patient a été mis sous antibiothérapie à large spectre
(céphalosporine de troisième génération associée au métro-
nidazole et à la gentamicine), d’abord par voie parentérale
combinée à un traitement anticoagulant pendant 2 semaines,
ce qui a permis une nette amélioration clinique, puis en admi-
nistration p.o. Le patient a ensuite bénéficié d’un traitement
chirurgical de son cholestéatome, à type de tympanoplastie
en technique ouverte du fait de l’extension des lésions ; les
suites opératoires ont été favorables.
Discussion
La nécrobacillose a été décrite pour la première fois en 1900 par
P. Courmont et A. Cade (2), et, en 1936, A. Lemierre a rapporté
une série de 20 cas de septicémies à germes anaérobies avec
des abcès disséminés (3), notamment au niveau pulmonaire.
Le nom de “syndrome de Lemierre” est donné à cette affection,
qui se définit comme une thrombophlébite septique de la veine
jugulaire interne ou de l’une des veines collatérales, à l’origine
d’emboles septiques, consécutive à une infection ORL, et qui
entraîne l’invasion hématogène par une bactérie anaérobie, le
Fusobacterium necrophorum (1). Il s’agit d’une bactérie anaé-
robie à Gram négatif, commensale de l’oropharynx, du tube
digestif et de l’appareil génital féminin. Son pouvoir pathogène
serait secondaire à la libération d’endotoxines qui favorisent
la propagation de l’infection aux tissus de voisinage, puis à la
région cervicale jusqu’à entraîner une thrombose de la veine
jugulaire interne et/ou de ses branches (1).
C’est une affection rare, dont l’incidence est de 0,8 par million
d’habitants. Elle se rencontre chez le sujet jeune (entre 16 et
23 ans), de sexe masculin dans 75 % des cas, sans antécédents
ni déficience particulière (4).
Cliniquement, le syndrome de Lemierre évolue en deux phases.
La phase initiale correspond à l’infection ORL, qui est le
plus souvent oropharyngée (angine simple ou compliquée
de phlegmon périamygdalien, d’adénopathies cervicales et
de syndrome fébrile) [1, 5]. Le point de départ est rarement
otologique (6, 7), comme dans notre observation. A. Lemierre
lui-même en a rapporté un cas en 1936 (2). La seconde phase
correspond à la diffusion de l’infection aux espaces parapha-
ryngés, avec la thrombophlébite de la veine jugulaire et la
septicémie. Elle se manifeste dans la semaine qui suit l’épi-
sode infectieux initial, mais est susceptible d’apparaître plus
tardivement, ce qui peut poser des problèmes diagnostiques
(1, 5). Cliniquement, elle se traduit par des pics fébriles avec
frissons, altération de l’état général, torticolis et sensibilité

CAS CLINIQUE
La Lettre d’ORL et de chirurgie cervico-faciale • n° 318 - juillet-août-septembre 2009 | 31
cervicale homolatérale à la localisation initiale. L’examen clinique
retrouve une induration douloureuse et inflammatoire de la région
sterno-cléido-mastoïdienne, qui peut évoluer vers une cellulite
cervico-médiastinale. Parfois, on ne retrouve qu’un cordon palpable
à l’avant du sterno-cléido-mastoïdien, correspondant à la throm-
bose veineuse. Les signes généraux, généralement très marqués,
comportent des symptômes pulmonaires (toux, douleurs thoraco-
pleurales, dyspnée, hémoptysies) et des arthralgies. Les emboles
septiques peuvent se localiser au niveau de tous les organes, en
particulier le foie et les reins. Des cas d’endocardite ont égale-
ment été rapportés (5). Cependant, lorsque le point de départ
est otitique, les manifestations infectieuses métastatiques sont
exceptionnelles ; on peut toutefois retrouver des cas de méningite
associée (6).
Sur le plan paraclinique, un syndrome inflammatoire important
avec hyperleucocytose est constant ; une hyperbilirubinémie est
retrouvée dans 50 % des cas, secondaire à une hépatolyse, et une
coagulation intravasculaire disséminée dans 23 % des cas (1).
Les prélèvements bactériologiques, notamment les hémocul-
tures, permettent de retrouver le germe en cause (Fusobacterium
necrophorum), mais, dans 10 à 30 % des cas, une flore polymi-
crobienne est retrouvée et, dans 10 à 15 % des cas, aucun germe
n’est identifié (1, 5).
L’imagerie joue un rôle important pour montrer l’atteinte tant
ORL que pulmonaire (8). La TDM cervicale avec injection de
produit de contraste objective la thrombophlébite de la veine
jugulaire interne, mais également les adénopathies et la porte
d’entrée (8, 9). L’échographie doppler peut visualiser la throm-
bose veineuse sous forme d’une veine augmentée de diamètre,
incompressible, et d’une absence de flux. Cependant, cet examen
est opérateur-dépendant, il ne permet pas de visualiser l’ensemble
de la veine jugulaire interne et peut ne pas mettre en évidence
un thrombus frais, non organisé. La radiographie pulmonaire ou,
mieux, la TDM thoracique recherche les emboles septiques sous
forme de nodules parenchymateux périphériques avec ou sans
cavitation et de plages de condensation pulmonaire (10).
Il n’existe pas de consensus thérapeutique pour la prise en charge
du syndrome de Lemierre (1). La majorité des auteurs recom-
mandent une antibiothérapie par voie parentérale, à base de
clindamycine, ou de céphalosporine de deuxième ou troisième
génération, associée au métronidazole. Cette antibiothérapie
doit être poursuivie pendant 2 à 6 semaines, avec un relais p.o.
dès constatation d’une amélioration clinique et d’une normali-
sation des paramètres biologiques. Un drainage chirurgical doit
être proposé chaque fois qu’il existe un abcès profond. Le trai-
tement anticoagulant est discuté : en effet, il risque de favoriser
les emboles septiques par fragmentation du thrombus veineux,
mais reste le seul moyen d’éviter une progression rétrograde du
thrombus vers le sinus caverneux. Les modalités de prescription
des anticoagulants sont mal définies (1, 11).
Le pronostic du syndrome de Lemierre dépend du délai écoulé
avant la formulation du diagnostic et le début de la prise en charge.
La mortalité est devenue exceptionnelle depuis l’avènement des
antibiotiques (11).
Conclusion
Le syndrome de Lemierre est une affection rare et grave, secondaire
à une infection banale de la sphère ORL, atteignant des sujets
jeunes et en bon état général. L’origine otitique de cette affection
est rarement rapportée dans la littérature ; il faut cependant penser
à cette complication éventuelle des otites moyennes, puisque
seule la prise en charge précoce permet une évolution favorable.
Le traitement ne fait pas l’objet d’un consensus, mais l’antibiothé-
rapie parentérale à large spectre et au long cours semble donner
de bons résultats. ■
1. Righini CA, Hitter A, Perrin MA, Schmerber S, Ferretti G, Reyt E. Le-
mierre’s syndrome: literature review. Ann Otolaryngol Chir Cervicofac
2006;123(4):179-88.
2. Courmont P, Cade A. Sur une septico-pyohémie de l’homme simulant la peste
causée par un streptobacille anaérobie. Arch Med Exp Anat Pathol 1900;4.
3. Lemierre A. On certain septicaemias due to anaerobic organisms. Lancet
1936;230:701-3.
4. Hagelskjaer LH, Prag J, Malczynski J, Kristensen JH. Incidence and clinical
epidemiology of necrobacillosis, including Lemierre’s syndrome, in Denmark
1990-1995. Eur J Microbiol Infect Dis 1998;17(8)561-5.
5. Fiesler FW, Richman PB, Riggs RL. Pharyngitis followed by hypoxemia and
sepsis: Lemierre syndrome. Am J Em Med 2001;19:320-2.
6. Masterson T, El-Hakim H, Magnus K, Robinson J. A case of the otogenic va-
riant of Lemierre’s syndrome with atypical sequelae and a review of the pedia-
tric literature. Int J Pediatr Otorhinolaryngol 2005;69:117-22.
7. Rosique Lopez L, Rodriguez Dominguez F, Navarro Paule P, Soler Valcar-
cel A. Lemierre’s syndrome: an unusual variant. Acta Otorrinolaringol Esp
2007;58(5):217-8.
8. Perrin MA, Jankowski A, Righini C, Boubagra K, Coulomb M, Ferretti G. Syn-
drome de Lemierre : apport de l’imagerie. J Radiol 2007;88:65-8.
9. Nguyen-Dinh KV, Marsot-Dupuch K, Portier F, Lamblin B, Lasjaunias P. Le-
mierre syndrome: usefulness of CT in detection of extensive occult thrombo-
phlebitis. J Neuroradiol 2002;29:132-5.
10. Kuhlman JE, Fishman EK, Teigen C. Pulmonary septic emboli: diagnostic
with CT. Radiology 1990;174:211-3.
11. Brook I. Microbiology and management of deep facial infections and
Lemierre syndrome. ORL J Otorhinolaryngol Relat Spec 2003;65:117-20.
Références bibliographiques
1
/
3
100%