STIMULI ETOP/IFCT 4-12

Synopsis ETOP/IFC
T 4
-
12 STIMULI V 1.3 02Dec
2013
1
/
6
Synopsis
STIMULI
ETOP/IFCT 4
-
12
Numéro BMS
: CA184
-
310
Etude de phase
II ouverte et randomisée sur le tr
aitement de
consolidation par l’
ipilimumab
après chimio
-
radiothérapie en cas de
cancer du poumon à petites cellules de stade limité
STIMULI:
S
mall cell lung cancer
T
rial with
I
pili
MU
mab in
LI
mited disease
Promoteur
:
European Thoracic Oncology Platform
(ETOP)
Entreprise pharmaceutique partenaire
:
Bristol
-
Myers Squibb
Population
:
SCLC de stade limité traité radicalement après une radiothérapie thoracique
associée à une chimiothérapie et une irradiation crânienne prophylactique (ICP)
concomitantes
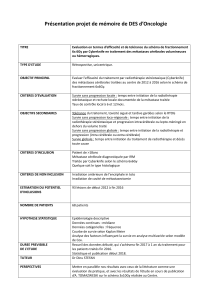
Schéma
:
étud
e
clinique
internationale de phase
II ouverte, randomisée et multicentrique
comprenant deux groupes thérapeutiques et une analyse intermédiaire précoce de l’innocuité
Taille de l’échantillon
:
260
patients
randomisés
, environ 325
patients inclus dans
la phase
avec chimio
-
radiothérapie
Chemotherapy
:
4
cycles
cisplatin
+
etoposide
Biomaterial
for
translational
research
:
weeks
: 1 4 7 10 15
after
rand
: 0 1 4 7 10 12 (16) 21 22 33 34
...
Thoracic
RT:
start
day
1
cycle
1
or
day
1
cycle
2
Ipilimumab
consolidation
vs
observation
:
Induction
maintenance
Observation
LD SCLC
Stage I
–
IIIB
M0
determined
by
brain
MRI+bone
scan
or
whole
body
PET
-
CT
Thoracic
RT
PCI
Tumor
evaluation
:
NotPD
PD:off
Thoracic
RT
R
...
PCI:
prophylac
-
tic
cranial
irradiation
Blood&
serum
CT *
CT
* 16
week
CT
mandatory
for
first
30
Ipi
pts
Blood&
serum
Blood&
serum
Biopsy
:FFPE block
or
slides
At
progression
:
•
Voluntary
re
-
biopsy
:
FFPE block
•
serum
CT
Optional
FDG PET
-
CT

Synopsis ETOP/IFC
T 4
-
12 STIMULI V 1.3 02Dec
2013
2
/
6
Randomisation
:
stratification selon le facteur suivant
: radiothérapie deux fois par jour vs
radiothérapie une fois par jour
Justification
Au moment du diagnostic, 30% des patients atteints d’un cancer du poumon à
petites
cellules (SCLC) présentent une maladie de stade limité, désormais appelé stade
I
-
IIIB (selon
l
’International Association for the Study of Lung Cancer
[IASLC]). Le pronostic en cas de
SCLC de stade limité reste mauvais, avec une survie médiane de 16
à 24
mois avec les
formes de traitement actuelles et une survie à long terme de seulement 15 à 25%.
L’association chimiothérapie plus radiothérapie thoracique constitue l’approche
thérapeutique standard en cas le SCLC de stade limité, dans laquelle l’
étoposide et le
cisplatine (PE) sont utilisés comme protocole de base. La
chimio
-
radiothérapie
concomitante
est supérieure à un traitement séquentiel
,
et une radiothérapie thoracique
précoce débu
tant
lors du premier ou deuxième cycle de chimiothérapie semb
le bénéfique.
Il
a été montré que la radiothérapie accélérée hyperfractionnée est plus efficace qu’une
radiothérapie administrée sur une longue durée globale de traitement
. Toutefois, la
disponibilité et l’utilisation de manière routinière de la radiothéra
pie hyperfractionnée font
toujours débat. Par conséquent, des protocoles de radiothérapie avec une administration
accélérée deux fois par jour ou une administration une fois par jour seront acceptés dans
cette étude. Le protocole choisi constituera un fact
eur de stratification pour la
randomisation.
Différentes études menées chez des patients atteints de cancer du poumon non à petites
cellules (NSCLC) suggèrent qu’une infiltration accrue de la tumeur par des cellules
immunitaires est associée à une meilleur
e survie
.
Au cours des dernières années,
l’amélioration continue de l’identification de cibles antigéniques, l’adjonction
d’immunoadjuvants et la production de systèmes d’administration plus efficaces ont
permis
d’obtenir des vaccins plus efficaces en mesure de déclencher une réponse immunitaire
puissante, ce qui
a
perm
is
le développement de l’immunothérapie en tant que traitement
fondamentalement nouveau du NSCLC.
L’antigène 4 cytotoxique humain associé
au lymphocyte T (
cytotoxic T
-
lymphocyte antigen
-
4
ou CTLA
-
4), qui est un régulateur négatif de l’activation des lymphocytes
T, est
actuellement une cible anti
-
cancéreuse qui suscite l’intérêt. L’ipilimumab, anticorps
monoclonal totalement humain, inhibe sp
écifiquement la liaison du CTLA
-
A à ses l
igands
(CD80/CD86). Ce blocage major
e l’activation et la prolifération des lymphocytes
T, ce qui
provoque l’infiltration de la tumeur par les lymphocytes T, puis sa régression. De premières
études cliniques avec l
’
i
pilimumab ont mis en évidence une activité dans de nombreux types
de cancer différents. Au cours d’études de phase
III récentes, l’ipilimumab a été le premier
agent à permettre d’améliorer de manière statistiquement significative la survie globale des
pati
ents atteints de mélanome métastatique. Une étude de phase
II
randomisée
avec un
schéma permettant une analyse distincte des différentes populations de patients a été menée
afin de comparer l’association ipilimumab plus paclitaxel et carboplatine suivie d’
une
traitement d’entretien par l’ipilimumab et un traitement par le paclitaxel et le carboplatine
seuls chez des patients atteints de NSCLC et des patients présentant un SCLC étendu. Pour
justifier l’emploi de l’ipilimumab en association avec le paclitaxel
et le carboplatine, les
chercheurs se sont basés sur des modèles précliniques dans lesquels des protocoles

Synopsis ETOP/IFC
T 4
-
12 STIMULI V 1.3 02Dec
2013
3
/
6
chimiothérapiques comprenant des taxanes et des composés à base de platine ont induit la
libération d’antigènes spécifiques à la tumeur par des cell
ules tumorales qui étaient en train
de mourir, ce qui a activé les lymphocytes
T. Il est important de noter que, tel que suggéré
dans des modèles tumoraux précliniques, certains agents chimiothérapiques pourraient aussi
améliorer l’activité anti
-
tumorale d
es anticorps anti
-
CTLA
-
4.
Comme il a été montré que l’ordre d’administration de la chimiothérapie et de
l’immunothérapie influe sur le résultat, deux protocoles alternatifs d’administration ont été
utilisés au cours de l’étude randomisée de phase
II
: le p
remier avec début simultané du
traitement par l’ipilimumab (10
mg/kg toutes les trois semaines, 4
cycles avec traitement
d’entretien toutes les 12
semaines jusqu’à progression de la maladie) et du premier cycle de
traitement par le paclitaxel et le carbopl
atine et le deuxième avec deux cycles de traitement
par le paclitaxel et le carboplatine avant le début de l’administration de l’ipilimumab
(«
protocole progressif
»). Chez les patients atteints de NSCLC, l’ipilimumab a permis
d’améliorer la survie sans pr
ogression (PFS) selon des critères de réponse liés au système
immunitaire (irRC) (irPFS), ainsi que la PFS médiane selon les critères de l’Organisation
mondiale de la Santé (OMS) et a tendu à améliorer la survie globale (OS) des patients traités
par le pro
tocole progressif à base d’ipilimumab (HR
: 0
,
72; p=0,05), mais pas des patients
qui ont bénéficié du protocole avec administration simultanée d’ipilimumab.
Au total, 130
patients ont é
té inclus dans l’étude de phase
II randomisée visant à comparer
l’administration simultanée et
progressive de l’association ipilimumab plus paclitaxel et
carboplatine au sein de la cohorte de patients atteints de SCLC étendu. Les résultats
suggèrent que l’administration progressive de l’association ipilimumab plus chim
iothérapie
a permis d’améliorer le résultat lors du traitement de première ligne des patients atteints de
SCLC étendu, avec une amél
ioration de l’irPFS (6,4 vs 5,3
mois, p=0,03), un taux de
meilleure réponse globale numériquement supérieur selon les irRC (
71% vs 53%) et une
tendance à l’amélioration de l’OS (12,9 vs 9,9
mois, p=0,13)
.
L’ipilimumab n’a pas semblé exacerb
er
les toxicités observées avec la chimiothérapie seule,
et les effets indésirables ont généralement pu être pris en charge en appliquant le
s directives
thérapeutiques définies dans le protocole.
Les résultats de cette étude ont été considérés comme plaidant en faveur d’une nouvelle
évaluation du protocole progressif à base d’ipilimumab dans le cadre d’une étude de
phase
III menée actuellement
chez des patients atteints d’un SCLC de stade
IV non
préalablement traité. Le présent protocole propose d’évaluer un protocole de traitement par
l’ipilimumab similaire chez des patients atteints de SCLC de stade limité dans le cadre
d’une étude ouverte ra
ndomisée.
L’ipilimumab sera administrée de manière séquentielle à titre de traitement de consolidation
après un protocole standard comprenant une chimio
-
radiothérapie et une irradiation
c
rânienne prophylactique (ICP).
Il est important de noter que, lors de
l’étude CA184042, qui
était la première étude visant à évaluer l’emploi de l’ipilimumab en monothérapie chez des
sujets atteints de mélanome avancé de stade
IV et de métastases cérébrales actives, le profil
d’innocuité constaté chez un sous
-
groupe de 31
p
atients qui avaient préalablement subi une
radiothérapie pour des métastases au niveau du système nerveux central (SNC) n’était pas
différent de celui relevé
dans
l’ensemble de la population de l’étude, qui comprenait
72
sujets.

Synopsis ETOP/IFC
T 4
-
12 STIMULI V 1.3 02Dec
2013
4
/
6
Objectifs et critères d’év
aluation de l’étude
L’objectif principal est d’évaluer si la survie globale des patients traités par chimio
-
radiothérapie et irradiation crânienne prophylactique suivies d’un traitement de
consolidation par l’ipilimumab est supérieure à celle des patients
traités par chimio
-
radiothérapie et irradiation crânienne prophylactique sans traitement de consolidation par
l’ipilimumab.
Critère d’évaluation principal
: survie globale.
Critères d’évaluation secondaires
:
survie sans progression selon les critères
RECIST
1.1
réponse objective déterminée selon les critères RECIST
1.1
délai jusqu’à l’échec du traitement
événements indésirables classés selon les CTCAE V4.0
Critères d’éligibilité principaux
(voir section
7.
du protocole pour la liste complète)
Critères d’inclusion lors du recrutement
:
cancer du poumon à petites cellules histologiquement ou cytologiquement confirmé
maladie limitée
(LM) non traitée définie par un stade
I
-
IIIB selon la 7
e
édition de la
classification TNM (classification proposée par l’IASLC pour le SCLC).
M0 attesté
par
o
examen de tomographie par émission de positons (TEP) au FDG pour
l’ensemble du corps avec scanner
du thorax et de la partie supérieure de
l’abdomen (y compris foie, reins et surrénales) avec produit de contraste
OU scanner du thorax et de la
partie supérieure de l’abdomen
(y compris
foie, reins et surrénales) avec produit de contraste et scintigraphie
osseuse
o
examen d’imagerie par résonance magnétique (IRM)
patient âgé de
≥18
ans dans un délai de 28
jours avant le début du cycle
1
indice de performance ECOG compris entre 0 et 1
fonctions hématologique, rénale, hépatique et pulmonaire adéquates
foncti
on pulmonaire
: volume expiratoire maximal par seconde (VEMS) de 1,0
l ou
>40% de la valeur théorique et DL
CO
>40% de la valeur théorique
Critères d’exclusion lors du recrutement
:
caractéristiques histologiques mixtes (petites cellules / non à petites
cellules)
épanchements pleuraux ou péricardiques qui se sont avérés être malins
antécédents documentés de maladie symptomatique à médiation immunitaire ou de
maladie autoimmune sévère ayant nécessité un traitement immunosuppresseur
systémique (par des stér
oïdes, par exemple) prolongé (pendant plus de deux mois)
tels que colite ulcéreuse et maladie de Crohn, polyarthrite rhumatoïde, sclérose
systémique progressive (sclérodermie), lupus érythémateux disséminé ou vascularite
auto
-
immune (granulomatose de Wegen
er, par exemple)
maladie pulmonaire interstitielle ou fibrose pulmonaire
femmes enceintes ou qui allaitent
patients recevant simultanément un quelconque traitement anticancéreux systémique
infection par le virus de l’immunodéficience humaine (VIH), le v
irus de l’hépatite
B
ou le virus de l’hépatite
C
patients qui présentent ou ont présenté au cours des cinq années précédentes une
quelconque affection maligne, A L’EXCEPTION d’un carcinome basocellulaire ou

Synopsis ETOP/IFC
T 4
-
12 STIMULI V 1.3 02Dec
2013
5
/
6
épidermoïde de la peau, d’un carcinome
in situ
du
col utérin ou de la vessie et d’un
carcinome canalaire
in situ
du sein traités correctement
radiothérapie thoracique précédente (avant l’inclusion)
dose pulmonaire moyenne prévue
>20
Gy ouV20 >35 %
Critères d’inclusion lors de la randomisation
:
chimio
-
radiothérapie achevée conformément au protocole
: quatre cycles de
chimiothérapie, 85% du volume cible prévisionnel (PTV) pour la radiothérapie
thoracique et ICP obligatoire achevée
absence de progression après la radio
-
chimiothérapie et l’ICP
Trait
ement de consolidation attribué par randomisation
:
Groupe 1
: ipilimumab administré par vo
ie intraveineuse à raison de 10
mg/kg
-
Induction
: 4 cycles à 3
semaines d’intervalle
-
Entretien
: à partir de 12
semaines après la dernière administration d’ipilimum
ab
dans le cadre du traitement d’induction, une dose toutes les 12
semaines jusqu’à
progression de la maladie ou pendant une durée maximale de deux ans après la date
de randomisation.
Groupe
2
: aucun traitement supplémentaire
; évaluation de la tumeur, do
cumentation du
suivi et prélèvement d’échantillons biologiques selon le même calendrier que dans le
groupe
1.
Considérations statistiques
Il a été montré que la radiothérapie accélérée hyperfractionnée
est plus efficace qu’une
radiothérapie administrée sur une longue durée globale de traitement
. Avec un
fractionnement deux fois par jour (BID), les tissus normaux réagissant tardivement sont
épargnés par rapport à la tumeur. Il en résulte une œsophagite a
igüe plus temporaire.
La valeur d’une radiothérapie BID administrée de manière précoce et en même temps que la
chimiothérapie a été évaluée lors d’études de référence et d’une méta
-
analyse, qui
constitueront nos données de référence. Ap
rès un suivi médian
de plus de huit
ans, la survie
globale (OS) à deux ans était respectivement de 47% pour la radiothérapie BID et de 41%
pour la radiothérapie administrée une fois par jour (QD).
La taille de l’échantillon a été calculée en se basant sur l’hypothèse d’une p
ériode de
recrutement de trois
ans (taux de recrutement de 90
patients par an pour les patients
randomisés
) et de l’emploi d’un test du log
-
rank unilatéral avec un niveau de signification
de 5% pour la comparaison de l’OS entre les groupes de traitement. L
e taux de survie à deux
ans pour le groupe ne recevant pas d’autre traitement est d’approximativement 44% (47%
pour la radiothérapie BID et 41% pour la radiothérapie QD en se basant sur l’hypothèse que
la moitié des patients inclus recevra une radiothérapi
e BID et l’autre moitié une
radiothérapie QD). Pour déceler une amélioration de 30% du taux de survie et un
hazard
ratio
de 0,70 avec une puissance de 80% avec un niveau de signification unilatéral de 5%
(bilatéral
: 10%), 260
patients devront au total êtr
e randomisés afin d’observer un nombre
maximum de 202
événements sur une durée d’étude maximale de 6,5
ans à partir du
recrutement du premier patient.
 6
6
1
/
6
100%