Lire l'article complet

La Lettre du Neurologue • Vol. XVIII - no 4 - avril 2014 | 121
MISE AU POINT
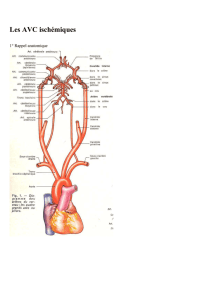
Neuro-imagerie des AVC
Neuroimaging of stroke
E. de Roquefeuil*, S. Molinier*, V. Dousset*
* Service de neuro-imagerie diagnos-
tique et thérapeutique, hôpital Pelle-
grin, CHU de Bordeaux.
L’
imagerie est une étape indispensable
dans la prise en charge des patients qui
font un accident vasculaire cérébral (AVC)
puisqu’elle a un rôle de confi rmation du diagnostic,
d’orientation étiologique et d’indication thérapeu-
tique. Cette importance croissante est liée aux
progrès techniques, qui offrent une rapidité de
réalisation et une caractérisation lésionnelle de
plus en plus fi ne.
Infarctus cérébral
et thrombolyse
L’imagerie a plusieurs objectifs dans ce cadre. Le
principal est d’éliminer un hématome, contre-
indiquant la thrombolyse. Les autres sont la confi r-
mation de l’infarctus et l’exclusion de diagnostics
différentiels, l’évaluation de la zone de pénombre
et de la perméabilité des vaisseaux.
Scanner
Depuis 2009, la Haute Autorité de santé (HAS)
recommande l’accès à l’imagerie cérébrale 24 h/24
et 7 j/7 pour tous les patients suspects d’AVC aigu, en
privilégiant dès que possible l’IRM. Or, cette modalité
d’imagerie est encore peu accessible en urgence et
le scanner est donc la technique privilégiée dans
de nombreux centres. Le scanner est également
choisi en cas de contre-indication à l’IRM ou lorsque
l’état d’agitation du patient rend la réalisation de
l’IRM impossible, ce qui est fréquent pour les sujets
souffrant d’un AVC sévère.
En tomodensitométrie (TDM), plusieurs acquisi-
tions sont réalisées (fi gure 1, p. 122). Le premier
temps est une hélice sans injection de produit de
contraste, à la recherche des composantes sanguines
d’un hématome ou d’une ischémie hémorragique,
hyperdenses spontanément. Cette acquisition peut
également montrer des signes précoces d’ischémie :
des signes parenchymateux tels qu’une atténuation
du contraste entre substance blanche et substance
grise, un effet de masse et/ou une hyperdensité
intra-artérielle en rapport avec un thrombus intra-
luminal. Un score pronostique − l’ASPECTS − a été
développé à partir de ces signes, mais sa reproducti-
bilité interobservateur est moyenne et il n’intéresse
que le territoire sylvien (1). De plus, le scanner est
souvent normal très précocement (fi gure 1A, p. 122).
Ce premier temps peut être considéré comme
suffi sant pour la mise en place d’une thrombolyse
intraveineuse (i.v.) dans les 4 h 30 après le début
authentifi é des symptômes (2).
L’étude de la perfusion cérébrale correspond au
deuxième temps de l’examen. Elle était auparavant
limitée puisque la boîte d’acquisition ne couvrait
que 4 cm d’épaisseur de parenchyme encéphalique
en moyenne. Avec les nouvelles générations de
scanner, un volume suffi sant de 8 cm est exploré.
La perfusion s’évalue en répétant la même boîte
d’acquisition de manière très rapprochée dans le
temps, lors de l’injection d’un bolus de produit de
contraste iodé (technique de suivi de bolus). Les
images sont alors traitées par logiciel afi n d’obtenir
plusieurs cartes de perfusion. La zone hypoperfusée
est estimée sur la carte de temps de transit moyen
(TTM). On considère une hypoperfusion lorsque
le TTM est supérieur à 140 % par rapport au côté
controlatéral (fi gures 1C et 1E, p. 122). La carte de
volume sanguin cérébral (VSC) va aider à évaluer
la zone de nécrose. La nécrose correspondrait à
une chute de 60 % du volume par rapport au côté
controlatéral ou à une valeur absolue inférieure
à 2 ml/100 g (fi gure 1F, p. 122). Le débit sanguin
cérébral (DSC) peut également évaluer la zone de
nécrose, en prenant comme seuil un DSC inférieur
à 40 % (3). La zone de pénombre, qui peut encore
être sauvée, correspond théoriquement à la zone

Figure 1. Protocole scanner avant thrombo-
lyse.
A : le scanner sans injection élimine un saigne-
ment intracrânien.
B : l’angioscanner des troncs supra-aortiques
et du polygone de Willis précise le niveau de
l’occlusion artérielle. Ici en M1 droit (fl èche).
C : la carte de TTM montre un allongement de
ce paramètre dans le territoire sylvien droit,
traduisant une hypoperfusion.
D : il n’y a pas d’abaissement du VSC dans cette
zone. Les mécanismes de compensation fonc-
tionnent. La zone hypoperfusée correspond
intégralement à de la pénombre.
E: zone hypoperfusée sur la carte TTM en
région temporale.
F : les mécanismes de compensation sont
dépassés. Il existe une chute du VSC. La zone
hypoperfusée correspond à de la nécrose.
G : l’IRM de diffusion 24 heures après la
thrombolyse montre une bonne réponse au
traitement : pas d’ischémie constituée dans
la zone de pénombre.
H : la zone qui était déjà nécrosée sur le
scanner est visible sous forme d’un hyper signal
en diffusion témoignant d’une restriction.
122 | La Lettre du Neurologue • Vol. XVIII - no 4 - avril 2014
Points forts
»
L’IRM est la modalité d’imagerie à privilégier pour toute suspicion d’AVC, en raison de sa sensibilité et de
l’absence d’irradiation. Elle est indispensable si l’on envisage une thrombolyse pour les AVC d’horaire inconnu.
»
Si l’IRM est inaccessible ou contre-indiquée, le scanner de perfusion couplé à un angioscanner des troncs
supra-aortiques est une aide importante à la décision de thrombolyse.
»L’étude de la vascularisation doit systématiquement être associée à l’exploration parenchymateuse.
»
L’étude de la perfusion (en IRM ou TDM) permet d’estimer la pénombre parenchymateuse à risque
d’ischémie.
»L’exploration vasculaire à visée étiologique dans le cadre des hématomes est indispensable pour tous
les patients de moins de 50ans, quelle qu’en soit la topographie et pour tous les hématomes lobaires
quel que soit l’âge du patient.
Mots-clés
IRM
AVC
Thrombolyse
Infarctus cérébraux
Hémorragie
Highlights
»
MRI is the best modality for
suspicion of stroke, because of
its sensitivity and the lack of
radiation exposure. MRI must
be the fi rst diagnostic test for
patients with a stroke whose
time of symptoms onset is
unknown.
»
If MRI is not available or
contraindicated, perfusion CT
with CT angiography improve
patient selection for thrombo-
lytic therapy.
»
Vasculature evaluation has
to be performed in the same
time that parenchyma study.
»
Perfusion CT and perfusion
MRI allow to assess the isch-
emic penumbra.
»
In case of intracerebral
haemorrhage, CT or MRI angi-
ography has to be performed
for patients younger than 50
years old and for all patients
with lobar haemorrhage.
Keywords
MRI
Stroke
Thrombolysis
Ischemia
Haemorrhage
apparaissant hypoperfusée sur le TTM et dont le
volume sanguin n’est pas encore abaissé sur la carte
VSC (fi gure 1D). Le troisième temps est l’explo-
ration vasculaire (fi gure 1B). Un nouveau bolus de
produit de contraste iodé est injecté pour opacifi er
les troncs supra-aortiques et le polygone de Willis,
à la recherche d’une occlusion et de son site.
Une occlusion proximale est en général associée à
une mauvaise réponse à la thrombolyse i.v.
Pour mémoire, l’irradiation délivrée au cours de ce
type d’examen TDM est importante et l’IRM devrait
être privilégiée dès que possible, même si l’évaluation
des sténoses en angioscanner est plus précise.

La Lettre du Neurologue • Vol. XVIII - no 4 - avril 2014 | 123
MISE AU POINT
IRM
Lorsqu’elle est accessible, l’IRM reste l’examen de
référence (4). Le protocole pour thrombolyse doit
être court pour ne pas retarder la prise en charge
thérapeutique. Idéalement, l’examen ne doit pas
durer plus de 10 minutes. Quatre séquences sont
indispensables.
➤
La séquence T2* est utilisée pour éliminer
une hémorragie. Elle est sensible aux artefacts de
susceptibilité magnétique, et donc aux produits de
dégradation de l’hémoglobine et montre un hypo-
signal lorsqu’il existe un hématome. À la phase
hyperaiguë avant 3 heures, l’hématome présente
2 composantes : l’une en hypersignal, centrale, en
rapport avec l’oxyhémoglobine, et l’autre en franc
hyposignal, périphérique, en rapport avec de la
déoxyhémoglobine. Cette séquence du protocole
thrombolyse permet d’identifi er un hématome intra-
parenchymateux de manière formelle à ce stade aigu
avant 3 heures. La séquence T2* objective également
parfois le thrombus intra-artériel sous la forme d’un
hyposignal linéaire.
➤
La séquence de diffusion montre très préco-
cement − dès l’installation des symptômes − un
hypersignal au niveau de la zone de nécrose. Elle
apparaît en hyposignal sur la cartographie du coeffi -
cient apparent de diffusion (ADC) parfois de manière
un peu retardée, ce qui ne doit pas faire exclure le
diagnostic d’ischémie. La diffusion refl ète les mouve-
ments browniens de l’eau libre extracellulaire. Dans
l’infarctus cérébral, l’ischémie entraîne un œdème
cytotoxique, qui correspond à un gonfl ement des
cellules, réduisant l’espace extracellulaire et géné-
rant une restriction de diffusion. Cette séquence est
la première à se positiver et permet de confi rmer
l’infarctus. Elle est sensible et identifi e les lésions
lacunaires. Cependant, la sensibilité n’est pas de
100 %, notamment pour les petites lésions de la fosse
postérieure. Pour améliorer leur détection, lorsque
les symptômes présentés évoquent une atteinte du
territoire vertébrobasilaire, des coupes plus fi nes sont
réalisées (3 mm versus 5 mm) avec, lorsque c’est
possible, des valeurs de b plus élevées (≥ 2 000). La
diffusion est également utile pour évaluer l’ancien-
neté d’un infarctus cérébral. Le signal de l’AVC en
diffusion va évoluer au cours du temps. L’hypersignal
en diffusion va persister 2 mois en moyenne, par
l’effet de rémanence T2 (T2 shine through). L’ADC va
s’inverser pour se normaliser puis augmenter entre le
troisième et le dixième jour en moyenne, en rapport
avec la destruction neuronale et la diminution de
l’œdème cytotoxique et de l’œdème vasogénique.
➤
La troisième séquence est le T2 FLAIR, séquence
T2 avec suppression du signal de l’eau libre (par
exemple, le liquide cérébrospinal [LCS]). Elle
évalue l’état du parenchyme cérébral sous-jacent.
Elle identifi e des stigmates d’AVC ancien (atteinte
corticale avec atrophie), montre des signes de
micro-angiopathie (hypersignaux de la substance
blanche sus-tentorielle, pontiques associés parfois
à des lacunes des noyaux gris centraux). Concernant
la lésion aiguë, elle se positive plus tardivement
que la séquence de diffusion, en moyenne aux alen-
tours de 4 heures. Ce délai va dépendre de plusieurs
paramètres, notamment la taille de l’infarctus. En
cas d’occlusion vasculaire, le FLAIR peut également
montrer des hypersignaux sous-arachnoïdiens
d’aspect tubulé qui traduisent un ralentissement
circulatoire dans les artères corticales.
➤
La quatrième séquence permet l’exploration
des vaisseaux intracrâniens. Il peut s’agir soit d’une
séquence en temps de vol (Time of fl ight [TOF]) qui
permet la visualisation du polygone de Willis sans
injection, soit d’une séquence d’angioMR avec
injection de chélates de gadolinium, qui étudie le
polygone et les troncs supra-aortiques.
La séquence de perfusion est parfois réalisée et
dépend du contexte. Elle est utile lorsque le délai
de 4 h 30 est dépassé, que la clinique est atypique ou
que la diffusion est négative avec une forte suspicion
clinique d’infarctus cérébral. Elle permet d’obtenir,
comme au scanner, les cartes de TTM et de VSC
relatifs notamment. De nouvelles techniques sont
en développement pour obtenir des informations de
perfusion sans injection de produit de contraste. Il
s’agit de la séquence ASL (Arterial Spin Labeling), qui
donne de bonnes informations sur le débit sanguin
cérébral et montre en pathologie sténo-occlusive
un retard du bolus de sang marqué dans la zone
de mesure (5).
Lorsque l’heure de début des symptômes ne peut
être authentifiée (c’est le cas des AVC constatés
au réveil), l’IRM va alors dater l’infarctus. On
utilise le différentiel entre l’apparition retardée
de l’hypersignal en FLAIR et l’apparition immédiate
des anomalies en diffusion (figure 2, p. 124).
G. Thomalla et al. (6) ont étudié les IRM de patients
réalisées moins de 12 heures après le début des
symptômes et dont la diffusion était positive. Ils
ont montré que seuls 17 % des patients avec un
FLAIR négatif avaient un infarctus datant de plus
de 4 h 30. Cette étude multicentrique a prouvé
que la très grande majorité des patients avec FLAIR
négatif était dans la fenêtre thérapeutique pour la
thrombolyse i.v.

Figure 2. IRM et AVC du réveil.
A : homme de 54 ans ; paralysie faciale droite
et aphasie constatées au réveil à 7 h 15 ; IRM
à 9 heures.
Il existe une lésion ischémique constituée fron-
tale gauche et une lésion punctiforme parié-
tale droite, en hypersignal sur la séquence de
diffusion.
B : ces infarctus ne sont pas visibles sur la
séquence FLAIR. Ils datent probablement de
moins de 4 h 30. La thrombolyse peut être
envisagée.
C : homme de 82 ans ; hémiplégie gauche
constatée au réveil ; hypersignal en diffusion
du bras postérieur de la capsule interne droite.
D : l’infarctus est déjà visible sur la séquence
FLAIR. Il date possiblement de plus de 4 h 30.
La thrombolyse est récusée.
124 | La Lettre du Neurologue • Vol. XVIII - no 4 - avril 2014
Neuro-imagerie des AVC
MISE AU POINT
Lorsque l’AVC date de plus de 4 h 30, un traitement
endovasculaire peut cependant être envisagé selon
la HAS : jusqu’à 6 heures pour un infarctus sylvien
et même au-delà pour un infarctus dans le terri-
toire vertébrobasilaire, après concertation entre
neurologues et neuroradiologues. Plusieurs types
de techniques intra-artérielles existent : des
techniques chimiques à type de thrombolyse intra-
artérielle et des techniques mécaniques dont les
plus récentes correspondent à une thrombectomie
par retrait du caillot.
L’étude multicentrique DEFUSE 2 a montré le rôle de
l’IRM de diffusion et de perfusion chez les patients
présentant un infarctus de moins de 12 heures,
bénéfi ciant d’un traitement endovasculaire pour des
occlusions carotidienne ou sylvienne (7). En effet,
une zone de pénombre signifi cative − c’est-à-dire un
rapport de volume du tissu hypoperfusé/tissu nécrosé
supérieur ou égal à 1,8 et au moins supérieur à 15 ml
avant procédure − est prédictive d’un meilleur résultat
fonctionnel. L’IRM peut donc permettre une meilleure
sélection des patients. Des lésions du tronc cérébral
très étendues en diffusion dans les thromboses du
tronc basilaire sont de mauvais pronostic et récusent
en général un traitement endovasculaire.
Trois récentes études randomisées remettent en
question l’efficacité de ces techniques endovas-
culaires (8-10). La présence d’une pénombre chez
des patients éligibles à un traitement endovas-
culaire ne serait pas prédictive d’une meilleure
évolution comme en témoignent les résultats
de l’étude MR RESCUE (8), contrairement à ceux
de l’étude DEFUSE 2. Dans l’étude IMS III (9), les
patients ayant un infarctus sévère cliniquement
et avec une occlusion artérielle proximale avaient
un pronostic inchangé lorsqu’on associait un
traitement endovasculaire dans les 7 premières
heures au traitement i.v. administré dans les
3 premières heures, même si le taux de reperfusion
était supérieur. Cependant, ces études n’ont pas été
réalisées avec la nouvelle génération de matériel
d’embolectomie (stent retriever) dont l’efficacité
doit être évaluée (2).
Autres apports de l’imagerie
dans les infarctus cérébraux
Accident ischémique transitoire
ou infarctus cérébral constitué ?
Selon le TIA Working group, l’accident ischémique
transitoire (AIT) est un épisode bref de dysfonction
neurologique dû à une ischémie focale cérébrale

Figure 3. Indication de craniectomie ?
A : homme de 53 ans ; défi cit hémi corporel
droit et aphasie à 10 h 30 ; scanner à
12 heures. La carte TTM montre une hypo-
perfusion du territoire sylvien gauche.
B : le VSC est abaissé. L’ensemble de la zone
hypoperfusée correspond à de la nécrose.
Devant ce volumineux infarctus, la thrombo-
lyse est récusée mais se pose une éventuelle
indication de craniectomie.
C : le patient bénéficie d’une IRM avec
séquence de diffusion. L’infarctus est
contouré sur chaque coupe. Le logiciel fournit
ensuite le volume qui est mesuré ici à 211 cc,
ce qui est supérieur à 145 cc. La craniectomie
est retenue.
La Lettre du Neurologue • Vol. XVIII - no 4 - avril 2014 | 125
MISE AU POINT
ou rétinienne, dont les symptômes cliniques
durent typiquement moins de 1 heure, sans preuve
d’infarctus aigu.
L’étude de C. Lamy et al. (11) a montré que plus d’un
tiers des patients avec un défi cit clinique transi-
toire d’une durée moyenne de 1,9 heure présen-
taient des infarctus constitués, de petite taille le
plus souvent. Ce taux passait à plus de 50 % si seuls
les défi cits ayant duré plus de 60 minutes étaient
pris en compte. L’IRM permet donc de faire la part
des choses entre infarctus cérébral régressif et AIT
où la séquence de diffusion apparaît normale. Cela
a un intérêt pronostique puisque lorsqu’il existe un
infarctus constitué en imagerie, le risque de faire
un défi cit clinique constitué par la suite est plus
important (12). L’exploration vasculaire, qui est une
urgence dans ce cadre, peut être réalisée dans le
même temps par une angioMR des troncs supra-
aortiques.
Indication de craniectomie
dans les infarctus sylviens malins
L’IRM permet le calcul du volume lésionnel par
contourage de la zone en restriction sur la diffusion.
Un volume supérieur à 145 cc est un des critères
de réalisation d’une craniectomie avec un bénéfi ce
clinique démontré (fi gure 3) [13].
Diagnostic étiologique
Lorsqu’une sténose signifi cative, de plus de 50 %
selon la classifi cation de NASCET (14), est identifi ée
en amont du territoire artériel ischémié, il faut
s’attacher à préciser si l’image est évocatrice
d’une plaque athéromateuse ou d’une dissection
artérielle. Dans ce dernier cas, les techniques
d’imagerie montrent une sténose effilée, avec
un aspect excentré de la lumière vasculaire et un
élargissement du calibre artériel. En IRM, si une
dissection est suspectée cliniquement ou sur un
examen d’imagerie préalable, il faut réaliser avant
l’angioMR une séquence cervicale haute, de la base
du crâne à C4, en pondération T1 sans injection
et avec suppression du signal de la graisse, pour
repérer l’hématome de paroi qui apparaît en hyper-
signal. Cet hypersignal se présente de manière un
peu retardée par rapport à la dissection et son
absence au stade précoce n’élimine pas l’hématome
(faux-négatifs).
L’angioMR des troncs supra-aortiques ne permet pas
l’analyse de la paroi. La caractérisation d’une plaque
 6
6
 7
7
 8
8
1
/
8
100%