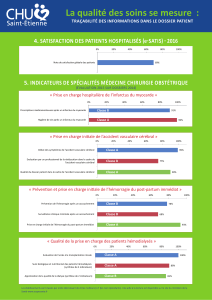
Prévention vasculaire après infarctus cérébral ou AIT

RECOMMANDATION PROFESSIONNELLE
A
RGUMENTAIRE
Mars 2008
Prévention vasculaire après un infarctus cérébral
ou un accident ischémique transitoire

L’argumentaire scientifique de cette évaluation
sur
Les recommandations et leur synthèse sont téléchargeables sur
www.has-sante.fr
Haute Autorité de Santé
Service communication
2, avenue du Stade-de-France – F 93218 Saint-Denis La Plaine Cedex
Tél. : +33 (0)1 55 93 70 00 - Fax : +33 (0)1 55 93 74 00
Ce document a été validé par le Collège de la Haute Autorité de Santé en mars 2008
© Haute Autorité de Santé – 2008

Prévention vasculaire après un infarctus cérébral ou un accident ischémique transitoire
HAS / Service des bonnes pratiques professionnelles / Mars 2008
3
Sommaire
Abréviations......................................................................................................................................................5
Méthode de travail............................................................................................................................................6
1.
Méthode et processus d’adaptation des recommandations pour la pratique clinique................6
1.1
Choix du thème de travail.........................................................................................................................6
1.2
Comité d’organisation...............................................................................................................................6
1.3
Comité de pilotage....................................................................................................................................6
1.4
Groupe de travail......................................................................................................................................7
1.5
Groupe de lecture.....................................................................................................................................7
1.6
Version finale des recommandations.......................................................................................................7
1.7
Validation par le Collège de la HAS.........................................................................................................7
1.8
Diffusion....................................................................................................................................................8
1.9
Niveau de preuve et grade des recommandations ..................................................................................8
2.
Gestion des conflits d’intérêts...........................................................................................................8
3.
Recherche documentaire....................................................................................................................8
1.10
Bases de données....................................................................................................................................8
1.11
Stratégie de recherche.............................................................................................................................8
Argumentaire ..................................................................................................................................................11
1
Introduction........................................................................................................................................11
1.1
Méthode..................................................................................................................................................11
1.2
Demandeur.............................................................................................................................................11
1.3
Cibles 12
1.4
Champ de la recommandation...............................................................................................................12
1.5
Objectifs de l’argumentaire et définitions ...............................................................................................12
1.5.1
Objectifs de l’argumentaire.....................................................................................................12
1.5.2
Définitions...............................................................................................................................12
1.5.3
Évolution de l’incidence des AVC...........................................................................................13
1.5.4
Diagnostic étiologique des infarctus cérébraux et des AIT ....................................................13
1.5.5
Risque de récidive après un infarctus cérébral......................................................................14
1.5.6
Risque cardiaque après infarctus cérébral.............................................................................15
1.5.7
Mortalité après infarctus cérébral...........................................................................................15
1.5.8
Conclusion..............................................................................................................................16
2
Contrôle des facteurs de risque chez tous les patients après un infarctus cérébral ou un AIT17
2.1
Pression artérielle...................................................................................................................................17
2.2
Lipides....................................................................................................................................................27
2.1.1
Statines et AVC ......................................................................................................................27
2.1.2
Niveau de cholestérol cible.....................................................................................................33
2.1.3
Autres hypolipémiants............................................................................................................34
2.1.4
Approche globale du patient dyslipidémique..........................................................................35
2.3
Diabète ...................................................................................................................................................37
2.1.5
Contrôle de l’HTA ...................................................................................................................38
2.1.6
Contrôle des lipides................................................................................................................39
2.1.7
Contrôle de la glycémie..........................................................................................................41
2.4
Tabac 45
2.5
Alcool 46
2.6
Obésité ...................................................................................................................................................48
2.7
Habitudes alimentaires...........................................................................................................................50
2.8
Activité physique.....................................................................................................................................52
2.9
Traitement hormonal de la ménopause .................................................................................................52
2.10
Contraception hormonale.......................................................................................................................56
2.11
Hyperhomocystéinémie..........................................................................................................................56
2.12
Syndrome d’apnées du sommeil............................................................................................................58
3
Traitement spécifique après un infarctus cérébral ou un AIT associé à une cardiopathie.......61
3.1
Fibrillation auriculaire non valvulaire......................................................................................................61
3.1.1
Antithrombotique.....................................................................................................................61

Prévention vasculaire après un infarctus cérébral ou un accident ischémique transitoire
HAS / Service des bonnes pratiques professionnelles / Mars 2008
4
3.1.2
Traitement antiarythmique......................................................................................................66
3.1.3
Conclusion..............................................................................................................................67
3.2
Infarctus du myocarde et dysfonction ventriculaire gauche...................................................................69
3.3
Anomalies du septum interauriculaire....................................................................................................72
3.4
Valvulopathies........................................................................................................................................75
3.4.1
Rétrécissement mitral rhumatismal........................................................................................75
3.4.2
Prothèses valvulaires .............................................................................................................75
3.4.3
Prolapsus de la valve mitrale..................................................................................................78
3.4.4
Calcifications valvulaires ........................................................................................................78
4
Traitement spécifique après un infarctus cérébral ou un AIT lié à l’athérosclérose, à la
maladie des petites artères ou d’origine indéterminée ..............................................................................80
4.1
Traitements antithrombotiques...............................................................................................................80
4.1.1
Antiagrégants plaquettaires....................................................................................................80
4.1.2
Anticoagulants oraux..............................................................................................................87
4.2
Aspects spécifiques des infarctus cérébraux ou AIT liés a l’athérosclérose..........................................90
4.2.1
Sténose athéroscléreuse de la carotide interne extracrânienne............................................90
4.2.2
Sténose athéroscléreuse de l’artère vertébrale extracrânienne.............................................98
4.2.3
Sténose athéroscléreuse intracrânienne................................................................................99
4.2.4
Athérosclérose de la crosse de l’aorte .................................................................................102
4.3
Aspects spécifiques des infarctus cérébraux ou AIT liés à la maladie des petites artères..................103
4.4
Infarctus cérébral cryptogénique du sujet jeune ..................................................................................104
5
Causes particulières........................................................................................................................105
5.1
Coagulopathie ......................................................................................................................................105
5.1.1
Thrombophilie héréditaire.....................................................................................................105
5.1.2
Syndrome des antiphospholipides........................................................................................106
5.2
Drépanocytose .....................................................................................................................................107
5.3
Dissections artérielles cervicales et intracrâniennes............................................................................110
Annexe 1. Résultats de la phase d’adaptation ..........................................................................................112
Annexe 2. Classification des étiologies des infarctus cérébraux et AIT ................................................125
Annexe 3. Sténose carotidenne : méthodes de mesure et schéma........................................................129
Annexe 4. Classification révisée des critères pour le syndrome des anticorps antiphospholipides .130
Bibliographie.................................................................................................................................................131
Participants ...................................................................................................................................................148

Prévention vasculaire après un infarctus cérébral ou un accident ischémique transitoire
HAS / Service des bonnes pratiques professionnelles / Mars 2008
5
Abréviations
ADA American Diabetes Association
AGP angioplastie
AHA American Heart Association
AOMI artériopathie oblitérante des membres inférieurs
APL antiphospholipides
ARA II antagonistes des récepteurs de l’angiotensine II
ASA American Stroke Association
ASIA anévrisme du septum interauriculaire
AVC accident vasculaire cérébral
EC endartériectomie carotidienne
FA fibrillation auriculaire
FANV fibrillation auriculaire non valvulaire
FOP foramen ovale perméable
HbA1c hémoglobine glyquée
HR hazard ratio
HTA hypertension artérielle
IC 95 % intervalle de confiance à 95 %
HDL high density lipoproteins
IDM infarctus du myocarde
IEC inhibiteurs de l’enzyme de conversion
IMC indice de masse corporelle
IRM imagerie par résonance magnétique
INR international normalized ratio
LDL low density lipoproteins
LP libération prolongée
OR odds ratio
PA pression artérielle
PPC pression positive continue
RP recommandation professionnelle
RPC recommandation pour la pratique clinique
RR risque relatif
RRA réduction du risque absolu
RRR réduction du risque relatif
SAS syndrome d’apnées du sommeil
THM traitement hormonal de la ménopause
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
1
/
150
100%