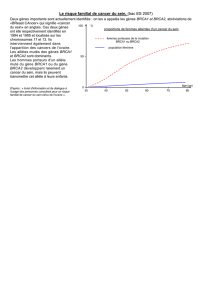
E Prise en charge des femmes porteuses BRCA1

Prise en charge des femmes porteuses
d’une mutation de BRCA1 ou BRCA2
Quels sont les niveaux de preuve ?
Management of BRCA1 and BRCA2 mutation carriers.
What are the levels of evidence ?
●
C. Monnerat*
LE GÈNE DU MOIS
22
La Lettre du Cancérologue - Volume XII - no1 - janvier-février 2003
E
nviron 15 % des cancers du sein surgissent dans un
contexte familial et 3 % à 5 % sont associés à une
mutation d’un gène de prédisposition au cancer tel
que BRCA1 ou BRCA2 (1). Une anamnèse familiale positive
représente le facteur de risque principal de développer un can-
cer du sein. Ce risque peut être évalué lors d’une consultation
d’oncogénétique et, s’il existe une constellation familiale rem-
plissant des critères bien définis, un test génétique devrait être
proposé. Deux gènes de prédisposition au cancer du sein,
BRCA1 isolé en 1994, et BRCA2 isolé en 1995, peuvent être ana-
lysés en routine (2, 3). Lors des consultations d’oncogénétique,
une des tâches du généticien consiste à exposer quelles sont les
conséquences du diagnostic d’une mutation délétère du gène
BRCA1 ou BRCA2 et quelle est la prise en charge des femmes
porteuses d’une telle anomalie. Si les aspects cliniques du syn-
drome de prédisposition aux cancers du sein et de l’ovaire lié
à une mutation de BRCA1 et BRCA2 commencent à être mieux
cernés, la prise en charge des femmes porteuses d’une telle
mutation est moins bien établie. Une revue récente du Groupe
suisse d’oncogénétique met en évidence la fragilité des preuves
qui soutiennent les recommandations émises par différents
groupes (4).
LES NIVEAUX DE PREUVE
Les travaux qui soutiennent des recommandations cliniques ont
été stratifiés selon la méthodologie de l’étude clinique. Ces
niveaux de preuve (level of evidence) sur lesquels repose la
médecine fondée sur des preuves (evidence based-medicine)
sont rappelés dans le tableau I. La découverte récente des gènes
BRCA1 et BRCA2, le nombre relativement rare des cas de can-
cer du sein héréditaire et la nature particulièrement difficile des
questions cliniques posées (par exemple, la mastectomie pré-
ventive) n’ont pas permis, jusqu’à présent, de réaliser un essai
clinique randomisé. Il faut espérer que des essais de chimio-
prévention pourront être mis sur pied pour les cancers du sein
héréditaires. Une collaboration internationale sera, bien sûr,
indispensable. Il faut souligner que c’est grâce au travail remar-
quable de groupes de recherche internationaux que l’identifi-
cation des gènes de prédisposition au cancer du sein a été pos-
sible et que l’histoire naturelle des femmes porteuses d’une
mutation de BRCA1 et BRCA2 a été mieux définie.
PRISE EN CHARGE DES FEMMES
PORTEUSES D’UNE MUTATION DE BRCA1 OU BRCA2
Pénétrance
La pénétrance, c’est-à-dire le risque de développer un cancer
du sein à un âge donné chez une femme porteuse d’une muta-
tion de BRCA1 ou BRCA2, est un paramètre important dans la
prise en charge. En fonction des méthodes de calcul et des popu-
lations étudiées, la valeur de la pénétrance peut varier. Elle
* Centre pluridisciplinaire d’oncologie, CHUV, Bugnon 46, 1011 Lausanne,
Suisse.
Tableau I.
Niveau de preuve
I
II
III-1
III-2
III-3
IV
V
Adapté de (4).
Preuve obtenue par
Une revue systématique de tous les essais
cliniques comparatifs randomisés
Au moins un essai comparatif randomisé
Un essai comparatif
avec une pseudo-randomisation (attribution
des patients à chaque groupe de façon alternée)
Une étude prospective avec un groupe témoin
non randomisé ou une étude cas-témoins
Une étude prospective
avec un contrôle historique, au moins deux études
prospectives avec un seul bras
Une revue de cas
Une opinion d’experts

des niveaux de preuve très solides, principalement en l’absence
d’étude randomisée. Il faut cependant souligner que l’évaluation
d’interventions chirurgicales préventives par une étude prospec-
tive randomisée est impossible à conduire. On ne peut pas se
résoudre à proposer une mastectomie préventive par le biais d’un
tirage au sort ! De nombreuses questions ne sont pas du tout réso-
lues et restent l’objet de controverses, comme la chimiopréven-
tion par le tamoxifène ou le dépistage du cancer du sein par
l’IRM. La prise en charge doit être individualisée et discutée
avec chaque femme.
CHIRURGIE PRÉVENTIVE
Deux études prospectives récentes amènent des éléments ob-
jectifs concernant la mastectomie et l’ovariectomie préventives.
L’efficacité de la mastectomie prophylactique, réduisant le
risque de développer un cancer du sein de plus de 90 %, est bien
documentée par une étude rétrospective de la Mayo Clinic (12).
Sur 176 patientes analysées rétrospectivement, 18 étaient por-
teuses d’une mutation de BRCA1 ou BRCA2. Aucune de ces
18 femmes n’a développé de cancer du sein. L’équipe de Rot-
terdam (Rotterdam Family Cancer Clinic) a rapporté son expé-
rience sur 139 femmes porteuses d’une mutation de BRCA1 ou
BRCA2 (13). Une mastectomie bilatérale prophylactique avec
reconstruction immédiate par prothèse de silicone a été accep-
tée par 76 femmes. À 3 ans, aucun cas de cancer du sein n’est
survenu. Les 63 femmes qui ont refusé cette intervention ont
servi de groupe témoin. L’âge médian était identique dans les
deux groupes (mastectomie : 35,8 ans ; contrôle : 39,9 ans), mais
un nombre plus important de femmes avaient eu une ovariec-
tomie préventive dans le groupe mastectomie (mastectomie :
58 % ; contrôle : 38 % ; p = 0,03). Les femmes du groupe
témoin ont bénéficié d’une surveillance clinique tous les 6 mois
et d’un dépistage annuel par mammographie et IRM. Sur 63
femmes, 8 ont présenté un cancer du sein après 3 ans de suivi,
ce qui correspond à une incidence annuelle de 2,5 % par an par
patient. L’histologie était dans sept cas sur huit un carcinome
de grade 3 avec des récepteurs hormonaux négatifs, histologie
typique des cancers du sein héréditaires liés à BRCA1. Malgré
la surveillance aux six mois, quatre cancers sur huit sont deve-
nus symptomatiques entre deux contrôles (50 % de “cancer de
l’intervalle”) et quatre de ces cancers étaient des stades avan-
cés N+, ce qui confirme la croissance très rapide des cancers
héréditaires. Une patiente âgée de 28 ans est décédée trois ans
et demi après le diagnostic initial. La valeur de la surveillance
par mammographie était très limitée, puisque seulement deux
cancers sur huit ont été détectés par la mammographie, alors
que tous ont été détectés par l’IRM.
Si le dépistage des cancers du sein héréditaires paraît peu satis-
faisant, le dépistage du cancer de l’ovaire est encore plus diffi-
cile et aucune méthode de dépistage n’a été démontrée comme
efficace. De plus, lorsqu’il est symptomatique, le cancer de
l’ovaire se présente déjà à un stade III qui n’est curable que dans
une minorité de cas. C’est pourquoi la salpingo-ovariectomie
dès 35 ans a été retenue comme une option préventive. Les don-
nées du Memorial Sloan-Kettering Cancer Center confirment
23
La Lettre du Cancérologue - Volume XII - no1 - janvier-février 2003
était très élevée dans les premières études du Breast Cancer Lin-
kage Consortium, car les critères de sélection demandaient au
moins quatre cas de cancer du sein ou de l’ovaire dans une
famille (5). En revanche, les études de population donnent une
estimation beaucoup plus faible (6, 7). En pratique, l’estima-
tion de la pénétrance la plus logique est celle qui est effectuée
parmi les patients consultant en oncogénétique (8). Ces varia-
tions dans l’estimation de la pénétrance pour le cancer du
sein chez les porteuses d’une mutation de BRCA1 sont résumées
dans le tableau II. En pratique, le risque cumulatif de déve-
lopper un cancer à l’âge de 70 ans est estimé à 73 % pour le
cancer du sein et à 41 % pour le cancer de l’ovaire (8). La péné-
trance peut également être estimée par le programme informa-
tique BRCAPRO qui est de plus en plus utilisé en pratique cou-
rante (10). La prise en charge des femmes à haut risque de
développer un cancer du sein et de l’ovaire consistera donc en
une surveillance clinique étroite, avec, éventuellement, des
mesures de chirurgie préventive.
Recommandations
Les recommandations de prise en charge des femmes porteuses
d’une mutation de BRCA1 ou BRCA2 ont été émises par diverses
sociétés savantes ; elles sont également disponibles sur Inter-
net (11). Une compilation de ces recommandations a été formu-
lée par le Groupe suisse de génétique (tableau III). Il apparaît
que la plupart de ces recommandations ne sont pas soutenues par
Tableau II. Risque cumulatif de développer un cancer du sein à l’âge
de 70 ans chez les femmes porteuses d’une mutation de BRCA1.
Étude (réf.) Auteur (année) Pénétrance à 70 ans
Famille (9) Ford 1994 87 % (IC 65 % à 92 %)
Population (6) Antoniou 2000 45 % (IC 22 % à 76 %)
Consultation (8) Brose 2002 73 % (IC 68 % à 78 %)
Tableau III. Options de prise en charge des femmes à haut risque de
développer un cancer du sein et de l’ovaire.
Preuve obtenue par
Examen clinique des seins tous les 6 mois
Mammographie annuelle ± ultrason dès 30 ans
(ou 5 ans avant l’âge du cas le plus jeune
de cancer du sein dans la famille)
Ultrason endovaginal annuel avec doppler
couleur + mesure du CA125 dès 35 ans
(ou 5 ans avant l’âge du cas le plus jeune
de cancer de l’ovaire dans la famille)
Au cas par cas, discussion d’une chirurgie
préventive (mastectomie bilatérale
prophylactique et salpingo-ovariectomie
prophylactique)
Éviter à long terme l’hormonothérapie
substitutive de la ménopause
Adapté de (14).
Niveau de preuve
V
III
V
III-2
III-2

LE GÈNE DU MOIS
l’intérêt de cette chirurgie préventive (14). Sur 170 femmes
avec une mutation de BRCA1 ou BRCA2, 98 ont eu une sal-
pingo-ovariectomie prophylactique et 72 une surveillance. Lors
de la chirurgie, deux cas de cancer de l’ovaire et un cas de
cancer du péritoine ont été découverts fortuitement. Après un
suivi médian de 2 ans seulement, une réduction du nombre de
cancers de l’ovaire, mais aussi une réduction du nombre de can-
cers du sein apparaît déjà dans le groupe des patientes avec une
salpingo-ovariectomie préventive (tableau IV). La diminution
du nombre de cancers est estimée à 75 % (hazard ratio 0,25
[0,08-0,74]), ce qui est spectaculaire. Bien sûr, un suivi à plus
long terme s’avère nécessaire afin de confirmer ces résultats.
CONCLUSION
Ces travaux récents confirment que la salpingo-ovariectomie
prophylactique est une procédure préventive efficace avec une
morbidité acceptable. Elle peut être recommandée comme
mesure préventive. La question de l’hormonothérapie substitu-
tive, de son dosage et de sa durée après la chirurgie n’est cepen-
dant pas résolue, bien que le bénéfice de l’ovariectomie pré-
ventive semble maintenu en présence d’une hormonothérapie
substitutive (15). La mastectomie bilatérale prophylactique se
confirme comme étant la mesure préventive la plus efficace, au
prix d’une morbidité apparemment acceptable, mais qu’il fau-
dra encore évaluer à long terme (16). Elle ne peut pas être recom-
mandée de façon systématique et elle doit être discutée de cas
en cas, particulièrement dans les familles avec un nombre de can-
cers du sein élevé chez des femmes jeunes. Le dépistage par
mammographie est clairement insuffisant et l’IRM semble avoir
une meilleure sensibilité. Néanmoins, la morbidité liée au
nombre élevé d’imageries faussement positives, la fréquence
des examens et leur coût restent à évaluer (17-18). Il reste éga-
lement à démontrer qu’un dépistage systématique par IRM per-
met de réduire la mortalité liée au cancer du sein.
■
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Familial breast cancer study group. Collaborative reanalysis of individual
data from 52 epidemiological studies including 58 209 women with breast cancer
and 101 986 women without the disease. Lancet 2001 ; 358 (9291) : 1389-99.
2. Miki Y, Swensen J, Shattuck-Eidens D et al. A strong candidate for the
breast and ovarian cancer susceptibility gene BRCA1. Science 1994 ;
266 (5182) : 66-71.
3. Wooster R, Bignell G, Lancaster J et al. Identification of the breast cancer
susceptibility gene BRCA2. Nature 1995 ; 378 (6559) : 789-92.
4. Pichert G, Bolliger B, Buser K, Pagani O. Evidence-based management
options for women at increased breast/ovarian cancer risk. Ann Oncol 2003 ;
14 (1) : 9-19.
5. Narod SA, Ford D, Devilee P et al. An evaluation of genetic heterogeneity
in 145 breast-ovarian cancer families. Breast Cancer Linkage Consortium. Am
J Hum Genet 1995 ; 56 (1) : 254-64.
6. Antoniou AC, Gayther SA, Stratton JF et al. Risk models for familial ova-
rian and breast cancer. Genet Epidemiol 2000 ; 18 (2) :173-90.
7. Begg CB. On the use of familial aggregation in population-based case pro-
bands for calculating penetrance. J Natl Cancer Inst 2002 ; 94 (16) : 1221-6.
8. Brose MS, Rebbeck TR, Calzone KA et al. Cancer risk estimates for BRCA1
mutation carriers identified in a risk evaluation program. J Natl Cancer Inst
2002 ; 94 (18) : 1365-72.
10. Euhus DM, Smith KC, Robinson L et al. Pretest prediction of BRCA1
or BRCA2 mutation by risk counselors and the computer model BRCAPRO.
JNatl Cancer Inst 2002 ; 94 (11) : 844-51.
11. NCCN guidelines, 2002. http://www.nccn.org/physician_gls/index.html
12. Hartmann LC, Sellers TA, Schaid DJ et al. Efficacy of bilateral prophy-
lactic mastectomy in BRCA1 and BRCA2 gene mutation carriers. J Natl
Cancer Inst 2001 ; 93 (21) : 1633-7.
13. Meijers-Heijboer H, van Geel B, van Putten WL et al. Breast cancer after
prophylactic bilateral mastectomy in women with a BRCA1 or BRCA2 muta-
tion. N Engl J Med 2001 ; 345 (3 ): 159-64.
14. Kauff ND, Satagopan JM, Robson ME et al. Risk-reducing salpingo-
oophorectomy in women with a BRCA1 or BRCA2 mutation. N Engl J Med
2002 ; 346 (21) : 1609-15.
15. Rebbeck TR, Lynch HT, Neuhausen SL et al. Prophylactic oophorectomy
in carriers of BRCA1 or BRCA2 mutations. N Engl J Med 2002 ; 346 (21) :
1616-22.
16. Frost MH, Schaid DJ, Sellers TA et al. Long-term satisfaction and psycho-
logical and social function following bilateral prophylactic mastectomy. JAMA
2000 ; 284 (3) : 319-24.
17. Tillman GF, Orel SG, Schnall MD et al. Effect of breast magnetic reso-
nance imaging on the clinical management of women with early-stage breast
carcinoma. J Clin Oncol 2002 ; 20 (16) : 3413-23.
18. Stoutjesdijk MJ, Boetes C, Jager GJ et al. Magnetic resonance imaging
and mammography in women with a hereditary risk of breast cancer. J Natl
Cancer Inst 2001 ; 93 (14) : 1095-102.
19. Ford D, Easton DF, Bishop DT et al. Risks of cancer in BRCA1-mutation
carriers. Breast Cancer Linkage Consortium. Lancet 1994 ; 343 (8899) : 692-5.
24
La Lettre du Cancérologue - Volume XII - no1 - janvier-février 2003
Tableau IV.
Salpingo- Surveillance p
ovariectomie
Nombre de cas 98 72
Cancers de l’ovaire 150,040
(ou péritoine)
Cancers du sein 3 8 0,070
Cancers liés à BRCA (total) 4 12* 0,006
Survie sans cancer à 5 ans 94 % 69 % 0,006
* Une patiente a eu un cancer de l’ovaire et un cancer du sein.
D’après (14).
Tous les articles publiés dans La Lettre du Cancérologue le sont sous la seule responsabilité de leurs auteurs.
Edimark S.A., 62-64, rue Jean-Jaurès, 92800 Puteaux
Tous droits réservés - Dépôt légal : à parution - ALJAC S.A. Locataire gérant de EDIMARK S.A.
©mai 1992 - Imprimé en France - Point 44 - 94500 Champigny-sur-Marne
Un Infos Congrès ESMO réalisé en partenariat avec Aventis est routé avec ce numéro ainsi qu’un supplément ESTRO réalisé en partenariat avec Schering-Plough.
1
/
3
100%