ETUDE DE QUELQUES PEPTIDES D`INTÉRÊT BIOLOGIQUE

ETUDE DE QUELQUES PEPTIDES D'INTÉRÊT BIOLOGIQUE
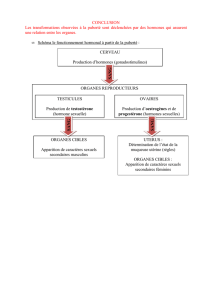
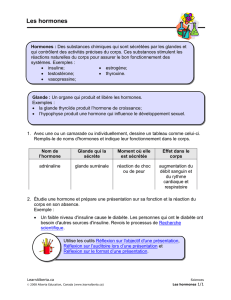
HORMONES POST-HYPOPHYSAIRES
Deux hormones, I'ocytocine et la vasopressine, sont des nonapeptides dont la structure est la suivante:
Ces deux hormones, ont des structures chimiques très proches l'une de l'autre, ce qui permet de
concevoir des analogies dans leurs activités biologiques. L'ocytocine agit surtout sur la contraction du
muscle utérin, alors que la vasopressine a principalement une action hypertensive et antidiurétique. La
synthèse chimique de ces deux hormones a été réalisée par du Vigneaud dés 1953, ce qui constitue le
premier exemple d'une synthèse peptidique réussie. Du Vigneaud a d'ailleurs réalisé la synthèse de
molécules hybrides: cycle de l'une associé à la chaîne latérale de l'autre. On a pu également synthétiser
des analogues structuraux ne différant du composé naturel que par un seul amino-acide. Exemple:
Vasoprossine (lysine) et Vasopressine (histidine).
Des modifications minimes sur la séquence d'élimination d'un OH de la lyrosine ou d'un NH: de l'arginine
conduit a des produits à activités biologiques bien dissociées: respectivement vasoconstricteur et
anidiurétique.
On utilise en medecine des analogues structuraux de synthèse de ces deux hormones peptidiques.
HORMONES ANTÉHYPOPHYSAIRES
Un exemple bien connu des hormones antéhypophysaires est l'hormone adrénocorticotrope ou ACTH.
C'est un enchaînement monocaténaire de 39 amino-acides pour un poids moléculaire de 4 500. La
séquence des amino-acides dans l'ACTH de l'homme est la suivante :
L'activité biologique dépend de l'intégrité de la séquence des amino-acides (1) à (20) et spécialement de
la présence des amino-acides (1) à (13). La détermination exacte de la séquence des 39 amino-acides
est aux travaux de Li (1958).

Le système hypothalamo-hypophysaire et les hormones protidiques
Hormones hypothalamiques
Les hormones de l'antéhypophyse et de l'hypophyse intermédiaire.
Hormones antéhypophysaires

HORMONES PANCRÉATIQUES
L'insuline est une hormone polypeptidique synthétisée par les cellules des îlots de Langerhans du
pancréas. Son poids moléculaire est de 5 734.C'est la première séquence hormonée polypeptidique
connue, grâce aux travaux de F. Sanger (1955). La molécule d'insuline est constituée par deux chaînes
polypeptidiques unies entre elles par deux ponts disulfures. Ce sont :
• la chaîne A qui comprend 21 amino-acides dont le gycocolle à l'extrémité N-terminale, avec un pont
disulfure intrachaine entre les résidus cystétyl en (6) et en (11);
• la chaîne B qui comprend 30 amino-acides, dont la phényalanine à l'extrémitié N-termmale.
II n'y a dans la molécule ni tryptophanne, ni méthionine.
La séquence des diverses insulines obtenues a d'autres espaces animales est identique a celle de
l'insuline humaine, sauf au niveau des amino-acides 8, 9 et 10 de la chaîne A et de l'amino-acide 30 de
la chaîne B.
La synthèse chimique de l'insuline a été réalisée selon les principe de la méthode employée par du
Vigneaud pour l'ocytocine: union de fragments préalablement synthétises, protection des groupements
sulfhydryles par formation du dérivé S-benzyl-cystéine et élimination secondaire du protecteur par
hydrogénolyse. La chaîne A nécessite 89 étapes de synthèse. La chaîne B 132 étapes.
Un tel travail, partiellement accompli dés 1963 par Katsoyannis (Université de Pinsburgh. USA.) et Zuhn
(Technische Hochschule. Allemagne fédérale) a été totalement réalisé, en 1965 par Kung et ses
collaborateurs de l'Université de Pékin et de l'Académie des Sciences de Shangaï. Ce fut une
acquisition fondamentale en Biochimie.
Le glucagon est une autre hormone peptidique pancréatique. Il ne comporte qu'une structure
polypetidique monocaténaire de 29 amino-acides dont la séquence a été déterminée par Bromer en
1957.
Insuline Humaine
Glucagon

PEPTIDES ANTIBIOTIQUES
De telles molécules, préparées à partir de cultures bactériennes, ont la propriété de contenir souvent
des D-amino-acides et de présenter une structure cyclique. Or en connaît un très grand nombre, doués
d'activité bactéricide puissante.
TYROCIDINE A
C'est un polypeptide cyclique extrait de la tyrocdine produite par Bacillus. Sa structure a été déterminée
par Paladine et Craig en 1954. Elle est la suivante:
Sa synthèse par voie chimique a été réalisée au Japon par Ohno en 1966.
En médecine, ce composé entre dans la constitution d'un antibiotique d'usage courant, la tyrothricine.
Le légendaire désordre qui régnait en permanence dans Ie Laboratoire de Recherche de Fleming est
pour une bonne part à la base de la découverte de ce remarquable antibiotique qu'est ta pénicilline.
LES PENICILLINES
Extraites des cultures d'un grand nombre de Pénicillium, ce sont des substances antibiotiques dont
l'usage est très largement répandu en médecine. La structure générale est la suivante:
LES GRAMICIDINES
Cyclopeptides extraits de Bacillus, ils sont des composants également de la Tyrocidine. Parni les
structures connues, on peut citer les gramicidines J1 et J2.

CONCLUSION
II existe bien d'autres structures peptidiques de grand intérêt biologique:
• propriétés hormonales (angiotensines, bradykinine, mélano-stimulines, gastrines, sécrétine, etc).
• rôle structural le peptidoglycane des parois bactériennes.
• pouvoir antibiotique: gramicidines, tyrocidines, bacitracines, polymixines, etc.
• pouvoir toxique: phalloïdine, responsable des intoxications mortelles par un champignon vénéneux:
l'Amanite phalloïde.
La détermination de structure est pour tous, soit faite, soit en cours de réalisation, et plusieurs d'entre
eux ont déjà été synthétisé par voie chimique, ainsi que de nombreux analogues structuraux
biologiquement actifs.
Un des aspects des plus moderne de ce problème est représente par l'étude des effets endocriniend et
comportementaux des neuropeptides.
1
/
5
100%