Biopathologie : quoi de neuf ? DOSSIER THÉMATIQUE

84 | La Lettre de l’Hépato-gastroentérologue • Vol. XIV - n° 2 - mars-avril 2011
DOSSIER THÉMATIQUE
XXIIe Journée scientifique
FFCD-PRODIGE
Biopathologie :
quoi de neuf ?
Biopathology: what’s new?
F. Bibeau*
* Service de pathologie, CRLC de
Montpellier.
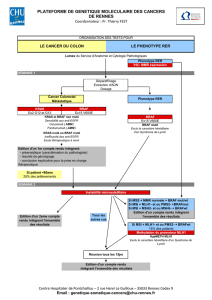
HER2 et cancer gastrique : vers
un raffinement des techniques
de détection
Le trastuzumab, en association avec la capécitabine
ou le 5-fluorouracil et le cisplatine, a été approuvé par
l’agence européenne des médicaments (autorisation
de mise sur le marché [AMM], le 19 janvier 2010)
pour le traitement des adénocarcinomes gastriques
ou de la jonction œsogastrique métastatiques. Cette
AMM est sous-tendue par un statut HER2 positif en
immunohistochimie (IHC) de score 3+ ou de score
2+ avec hybridation in situ montrant un rapport
HER2/CEP17 > 2 (rapport sonde HER2 sur sonde
centrométrique du chromosome 17 > 2) [1]. Initia-
lement, l’hybridation in situ fluorescente ou FISH
(Fluorescent In Situ Hybridization) avait été retenue.
Une extension d’AMM a été apportée le 6 août 2010
incluant désormais la technique d’hybridation in
situ argentique ou SISH (Silver In Situ Hybridization).
C’est cette dernière qui devrait plutôt être utilisée
car elle permet de repérer, avec plus de précision
que la FISH, les marquages hétérogènes. Compte
tenu de l’importance de la détermination du statut
HER2 dans le cancer gastrique, il faut signaler que
des tests d’assurance qualité ont été proposés en
2010 par l’Association française d’assurance qualité
en anatomie et cytologie pathologiques (AFAQAP),
à l’instar de ce qui a été fait dans le cancer du sein.
D’après les dernières données de l’ESMO, il ne semble
pas exister de disparité majeure du statut HER2 entre
tumeur primitive et métastases (ESMO 2010. F. Negri
et al. Abstract 823P). Cependant, l’évaluation du
statut HER2 sur le site métastatique est préférable
quand cela est réalisable. Par ailleurs, une publication
récente a fait état de possibles faux négatifs après trai-
tement néoadjuvant des cancers de l’œsophage (2).
Ces dernières données sont à confirmer.
Instabilité microsatellitaire :
l’évidence stable
Ce statut particulier concerne 15 % des cancers
colorectaux dans un contexte soit sporadique, soit
héréditaire (syndrome de Lynch). Il est objectivable
par immunohistochimie et biologie moléculaire qui
sont concordantes dans la très grande majorité des
cas. Cependant, une publication récente a montré
qu’une perte d’expression de MSH6 par HC pouvait
s’observer dans les cancers du rectum après traite-
ment néoadjuvant par radiochimiothérapie, sans
instabilité microsatellitaire associée (3).
Les études présentées lors du congrès de l’ASCO
en 2010, ont encore souligné l’impact pronostique
favorable de l’instabilité microsatellitaire (ou
profil dMMR [deficient MisMatch Repair]) [ASCO
2010. G. Hutchins et al. Abstract 3517 ; F. Sinicrope
et al. Abstract 3519 ; G.P. Kim et al. Abstract 3518].
L’histoire naturelle des cancers MSI (microsatellite
instable) a par ailleurs été précisée, montrant une
proportion plus élevée de récidives intra-abdomi-
nales (F. Sinicrope et al. Abstract 3519) et un impact
pronostique favorable maintenu au cours de l’évolu-
tion naturelle de la maladie, que les patients aient
reçu ou non une chimiothérapie adjuvante par 5-FU
après exérèse de la tumeur primitive (ASCO 2010.
G.P. Kim et al. Abstract 3518). Les raisons du pronostic
plus favorable des tumeurs dMMR sont encore à
préciser, mais la réponse immune semble être une
piste prometteuse. À ce titre, une communication
affichée de J.F. Fléjou et al. a souligné qu’un plus
grand nombre de ganglions lymphatiques était
objectivé dans les pièces de résection chirurgicale
de cancers colorectaux MSI que dans les cancers
colorectaux MSS (microsatellite stable), notam-
ment dans les cancers du côlon droit, dans les cas
sans ganglions métastatiques et lors d’une perte

La Lettre de l’Hépato-gastroentérologue • Vol. XIV - n° 2 - mars-avril 2011 | 85
Résumé
L’année 2010 n’a pas fait émerger de nouveaux biomarqueurs mais a confirmé la place de certains d’entre
eux dans des situations cliniques précises. Le statut de l’oncogène HER2 dans les cancers gastriques métas-
tatiques et la détermination de l’instabilité microsatellitaire dans les cancers du côlon deviennent ainsi
des paramètres incontournables. Les mutations du gène BRAF dans le cancer colorectal s’intègrent plus à
un cadre pronostique que prédictif. L’année 2010 renforce aussi l’importance des techniques associées à
la mise en évidence de ces biomarqueurs, devant s’inscrire dans le cadre d’un contrôle qualité.
Mots-clés
HER2
Hybridation in situ
Instabilité
microsatellitaire
Mutations BRAF
Abstract
In 2010, no new biomarker
was validated for the clinical
practice in digestive oncology.
HER2 status in metastatic
gastric cancer and MSI status
in colorectal cancers are now
becoming mandatory. BRAF
mutations found in colorectal
cancers have to be consi-
dered rather prognostic than
predictive. At last, in 2010,
biomarkers testing should be
performed with a quality assur-
anced program.
Keywords
HER2
In situ hybridization
Microsatellite instability
BRAF mutations
d’expression d’hMLH1 (ASCO 2010. J.F. Fléjou et al.
Abstract 3607).
La valeur prédictive du statut MSI a aussi fait l’objet
de plusieurs travaux. Deux études ont confirmé l’ab-
sence de bénéfice de la chimiothérapie adjuvante
par 5-FU en cas de tumeurs MSI de stade II (ASCO
2010. G.P. Kim et al. Abstract 3518 ; F. Sinicrope et
al. Abstract 3519). La publication de D.J. Sargent
et al., parue dans Journal of Clinical Oncology en
juillet 2010, renforce ces données et suggère que le
statut MSI ou dMMR devrait être recherché après
exérèse d’un cancer colique de stade II, afin d’éviter
une chimiothérapie à base de 5-FU (4). L’ensemble
de ces données confirme ainsi, dans les cancers
colorectaux de stade II, l’intérêt du 5-FU seulement
chez les patients ayant un statut MSS ou pMMR.
En première ligne métastatique, aucune différence
d’efficacité de chimiothérapie à base d’irinotécan
n’a été objectivée entre patients MSI et MSS. Une
tendance non significative concernant une meilleure
survie sans progression a cependant été observée
chez les patients avec statut MSI (ASCO 2010. J. Kim
et al. Abstract 3579).
Mutations BRAF :
pour l’instant pronostiques
Au cours de l’année 2010, le caractère pronos-
tique des mutations du gène BRAF dans le cancer
colorectal a été une nouvelle fois mis en évidence.
Ces mutations surviennent en aval du gène KRAS et
sont mutuellement exclusives de celui-ci (5). Elles
ont été analysées dans le cadre de plusieurs études
biologiques satellites de différents essais thérapeu-
tiques et leur fréquence s’est avérée dans l’ensemble
comparable, atteignant 8 %.
Leur caractère péjoratif a ainsi été objectivé en situa-
tion adjuvante (essai PETACC3 : cancer du côlon de
stade II ou III, traité par LV5FU2 seul ou avec irino-
técan [ASCO 2010. A.D. Roth et al. Abstract 3504 ;
S. Tejpar et al. Abstract 3505], et en première ligne
métastatique (essais CRYSTAL [FOLFIRI versus
FOLFIRI + cétuximab]), OPUS (FOLFOX4 versus
FOLFOX4 + cétuximab) et COIN (chimiothérapie à
base d’oxaliplatine associé au 5-FU ou à la capécita-
bine selon le choix de l’investigateur) [ASCO 2010.
C. Bokemeyer et al. Abstract 3506 ; T.S. Maughan et
al. Abstract 3502]. Il est nécessaire de préciser que
ce caractère péjoratif n’est présent qu’au sein des
cancers colorectaux sans instabilité microsatellitaire.
Dans les tumeurs MSI, dont le pronostic favorable
vient d’être évoqué, les mutations de BRAF servent à
distinguer les cancers MSI sporadiques (si mutation de
BRAF) des cancers MSI héréditaires (non mutées pour
BRAF !) [5, 6]. Il reste maintenant à comprendre pour-
quoi la mutation du gène BRAF est délétère dans le
groupe des cancers colorectaux pMMR et non dMMR.
Une partie de ces études a également souligné que
les mutations de BRAF ne pouvaient être considé-
rées à l’heure actuelle comme un facteur prédictif
de résistance aux anticorps anti-EGFR (ASCO 2010.
C. Bokemeyer et al. Abstract 3506). Dans les essais
CRYSTAL et OPUS poolés, chez les patients porteurs
de tumeurs BRAF mutées, le pronostic s’avère en
effet particulièrement mauvais tant dans le bras
recevant la chimiothérapie et le cétuximab que dans
le bras recevant la chimiothérapie seule, ce qui en
fait, à l’heure actuelle, un marqueur essentiellement
pronostique. ■
1. L, Doglioni C. HER2 testing in gastric cancer. Adv Anat
Pathol 2011;18(1):53-9.
2. Schoppmann SF, Jesch B, Friedrich J et al. Expression of
Her-2 in carcinomas of the esophagus. Am J Surg Pathol
2010;34(12):1868-73.
3. Bao F, Panarelli NC, Rennert H, Sherr DL, Yantiss RD.
Neoadjuvant therapy induces loss of MSH6 expression in
colorectal carcinoma. Am J Surg Pathol 2010;34:1798-804.
4. Sargent DJ, Marsoni S, Monges G et al. Defective
mismatch repair as a predictive marker for lack of efficacy
of fluorouracil-based adjuvant therapy in colon cancer. J
Clin Oncol 2010;28:3219-26.
5. Lièvre A, Rouleau E, Buecher B, Mitry E. Intérêt clinique des
mutations de BRAF dans le cancer colorectal. Bull Cancer
2010;12:1441-52.
6. Sharma SG, Gulley ML. BRAF mutation testing in
colorectal cancer. Arch Pathol Lab Med 2010;134:1225-8.
Références bibliographiques
1
/
2
100%