Lire l'article complet

La Lettre du Pharmacologue - vol. 23 - n° 2 - avril-mai-juin 2009
Pharmacologie
Pharmacologie
48
Traitement médical de l’hypertension artérielle pulmonaire
Medical treatment of pulmonary arterial hypertension
●● O. Sitbon*, L. Savale*, X. Jaïs*, D. Montani*, M. Humbert*, G. Simonneau*
* Centre national de référence sur l’HTAP, service de pneumologie, UPRES-EA2705, hôpital
Antoine-Béclère, AP-HP, université Paris-Sud, Clamart.
RÉSUMÉ 왘
Le traitement de l’hypertension artérielle pulmonaire
왘
(HTAP) tente de s’opposer aux eff ets délétères de la vaso-
constriction, de l’obstruction vasculaire pulmonaire par
remodelage et thrombose, et de l’insuffi sance cardiaque
droite. Les innovations thérapeutiques de ces 10 dernières
années (antagonistes des récepteurs de l’endothéline,
dérivés de la prostacycline, inhibiteurs de la phosphodies-
térase de type 5) découlent d’une meilleure compréhension
des anomalies physiopathologiques de l’HTAP, en particulier
de la dysfonction endothéliale, caractérisée par un défaut
de production de substances vasodilatatrices et antiprolifé-
rantes (prostacycline et monoxyde d’azote) et un excès de
production de substances vasoconstrictrices (endothéline 1,
thromboxane) qui stimulent également la prolifération des
cellules musculaires lisses vasculaires. La mise au point de
ces nouvelles thérapeutiques ciblées sur la dysfonction
endothéliale a permis une amélioration substantielle de
l’espérance de vie des malades. Malheureusement, aucun
de ces médicaments administré isolément ne permet à
l’heure actuelle de guérir cette maladie, dont le pronostic
reste réservé, en particulier pour les patients les plus jeunes.
Les progrès des années à venir passeront sans doute par un
diagnostic plus précoce de la maladie, les associations théra-
peutiques et la mise au point de nouvelles molécules ciblant
d’autres mécanismes physiopathologiques (inhibiteurs de la
recapture de la sérotonine, inhibiteurs de tyrosines kinases
comme l’imatinib). L’impact de ces nouvelles approches
thérapeutiques sur la survie des patients souff rant d’HTAP
est un enjeu majeur pour les prochaines années.
Mots-clés : Hypertension artérielle pulmonaire – Prosta-
cycline – Endothéline – Monoxyde d’azote – Phospho-
diestérases.
SUMMARY 왘
Treatment of pulmonary arterial hypertension (PAH) attempts
to counteract the deleterious eff ects of pulmonary vasocons-
triction, pulmonary vascular remodeling, thrombosis and
right heart dysfunction. Over the last 10 years, advances in
our understanding of the molecular mechanisms involved in
this disease suggest that endothelial dysfunction plays a key
role. Chronically impaired production of vasoactive mediators,
such as nitric oxide and prostacyclin, along with prolonged
overexpression of vasoconstrictors such as endothelin-1 not
only aff ect vascular tone but also promote vascular remodel-
ing. These advances in our understanding of the pathophy-
siological and molecular mechanisms of PAH have led to the
development of new pharmacologic therapies (prostacyclin
derivatives, endothelin-receptor antagonists, phosphodies-
terase type 5 inhibitors). Despite recent major improvements
in symptomatic treatments, no current treatment cures this
devastating condition. However, treatment options for patients
with the disease have evolved to help prolong their survival
and improve their quality of life. Greater knowledge of this
devastating disease may ultimately lead to the development
of new therapies and strategies that ensure a better prognosis:
early diagnosis and treatment, combination therapies, new
drugs targeting other pathophysiological pathways (seroto-
nin-reuptake inhibitors, tyrosin kinase inhibitors...). The impact
of these new therapeutic approachs on long-term survival of
patients with PAH is a major challenge in the near future.
Keywords: Pulmonary hypertension – Prostacyclin – Endo-
thelin – Nitric oxide – Phosphodiesterase.
L’
hypertension artérielle pulmonaire (HTAP) est une
maladie rare dont le pronostic médiocre a longtemps
été considéré comme inéluctable. La maladie est carac-
térisée par l’augmentation progressive des résistances vasculaires
pulmonaires, aboutissant à une insuffi sance cardiaque droite et
au décès. Au cours des 10 dernières années, les progrès réalisés
dans la compréhension des mécanismes physiopathologiques
de l’HTAP ont permis la mise au point de plusieurs molécules
innovantes et une nouvelle approche thérapeutique de la maladie.
Ainsi, la dysfonction endothéliale, avec pour corollaires un désé-

La Lettre du Pharmacologue - vol. 23 - n° 2 - avril-mai-juin 2009
Pharmacologie
Pharmacologie
49
quilibre de la balance vasoconstriction/vasodilatation et une
prolifération musculaire lisse exagérée, représente à l’heure
actuelle la cible prioritaire du traitement de l’HTAP (1). Cette
meilleure compréhension de la physiopathologie de l’HTAP a
permis au fi l du temps d’en modifi er l’approche thérapeutique, en
passant progressivement de traitements à visée essentiellement
vasodilatatrice (inhibiteurs calciques) à des médicaments inhi-
bant la prolifération des cellules vasculaires pulmonaires dans le
but de faire régresser les lésions d’hypertrophie et de remodelage
vasculaire : dérivés de la prostacycline (PGI2), antagonistes des
récepteurs de l’endothéline 1 (ET-1) et, plus récemment, inhi-
biteurs de la phosphodiestérase de type 5 (PDE5).
PRINCIPES GÉNÉRAUX DU TRAITEMENT DE L’HTAP
Le traitement de l’HTAP tente de s’opposer aux eff ets délétères
de la vasoconstriction, de l’obstruction vasculaire pulmonaire par
remodelage et thrombose, et de l’insuffi sance cardiaque droite.
Les principaux traitements actuels de l’HTAP ont pour cible
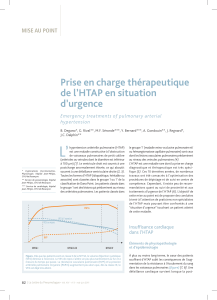
la dysfonction endothéliale des artères pulmonaires (fi gure 1)
[1]. À côté des médicaments ciblant cette dysfonction endothé-
liale, d’autres thérapeutiques sont disponibles, en particulier
les vasodilatateurs comme les inhibiteurs calciques chez les
très rares patients vasoréactifs en aigu, les anticoagulants et
les diurétiques.
Figure 1. Cibles des traitements actuels de l’hypertension artérielle pulmonaire (d’après [1]).
Partie supérieure : coupe transversale d’une artère pulmonaire de petit calibre (diamètre < 500 μm) d’un patient souff rant d’une HTAP sévère, montrant une
prolifération intimale et une hypertrophie de la média.
La dysfonction endothéliale se traduit par une diminution de la production par les cellules endothéliales (représentées en bleu) de prostacycline et de monoxyde
d’azote, associée à une augmentation de la production d’endothéline 1. Ces modifi cations conduisent à une vasoconstriction et à une prolifération des cellules
musculaires lisses des artères pulmonaires (représentées en fond clair).
AMPC : adénosine monophosphate cyclique ; GMPC : guanosine monophosphate cyclique ; ET : endothéline ; ETA : récepteur A de l’endothéline ; ETB : récepteur B de
l’endothéline ; PDE5 : phosphodiestérase de type 5 ; PGI2 : prostaglandine I2 (prostacycline).
Pré-pro-ETppro-ET
Voie de l’endothéline
Monoxyde d’azote
Inhibiteurs de la PDE5
Antagonistes
des récepteurs
de l’endothéline Dérivés de la
prostacycline
Vasoconstriction
Prolifération
Vasodilatation
Antiprolifération
Vasodilatation
Antiprolifération
Endothéline 1
PDE5
GMPc AMPc
Prostacycline (PGI2)
ETAETB
Voie de la prostacyclineVoie du monoxyde d’azote
Acide arachidoniquepPGI2
L-argininepL-citrulline

La Lettre du Pharmacologue - vol. 23 - n° 2 - avril-mai-juin 2009
Pharmacologie
Pharmacologie
50
MESURES GÉNÉRALES
Les patients souff rant d’une HTAP ont un réseau artériel pulmo-
naire restreint du fait du remodelage intense des artères pulmo-
naires. Chez ces patients, certaines précautions simples doivent
être envisagées.
Limitation de l’activité physique et règles d’hygiène
de vie
Tout exercice physique peut aggraver les symptômes d’HTAP
(dyspnée, fatigue, douleur thoracique, syncope). Les activités
physiques doivent donc être réduites et guidées par les symp-
tômes. Néanmoins, un mode de vie trop sédentaire peut être à
l’origine d’une fonte musculaire participant à la limitation fonc-
tionnelle (2). Un compromis est donc à trouver pour encourager
les patients à exercer une activité physique modérée, en évitant
tout eff ort potentiellement dangereux (2). Les résultats récents
d’un programme de réadaptation à l’eff ort chez des patients
souff rant d’HTAP sont encourageants (3).
Altitude et hypoxie
La raréfaction en oxygène majore l’hypoxémie, donc la dyspnée,
et, de façon réfl exe, la pression artérielle pulmonaire (phénomène
de vasoconstriction hypoxique). Ainsi, les séjours en altitude
(au-dessus de 800 mètres) et, par extension, les voyages aériens
en cabine non pressurisée doivent être proscrits (2).
Grossesse et contraception
La grossesse est formellement contre-indiquée, car les modifi ca-
tions hémodynamiques et hormonales qu’elle entraîne peuvent
être responsables d’une décompensation cardiaque droite, parfois
fatale pour la mère et l’enfant (4, 5). Ces risques imposent donc le
recours à une contraception (progestative pure ou estroproges-
tative minidosée chez les patientes correctement anticoagulées
et en l’absence d’antécédent thromboembolique ou de thrombo-
philie) chez les femmes en période d’activité génitale (4, 5).
Anesthésie et chirurgie
Toute procédure invasive (chirurgie, cathétérisme cardiaque,
etc.) doit être discutée et, si possible, réalisée dans des centres
spécialisés dans la prise en charge des HTAP.
TRAITEMENT SYMPTOMATIQUE
Anticoagulation au long cours
Le traitement anticoagulant permet de diminuer la mortalité
des patients souff rant d’HTAP, par la réduction probable des
phénomènes de thrombose in situ (6, 7). En conséquence, le
traitement anticoagulant oral par antivitamine K est proposé de
manière systématique lorsqu’il n’existe pas de contre-indication
(objectif d’INR de 1,5 à 2,5).
Diurétiques
Les diurétiques (furosémide, spironolactone), associés à un régime
sans sel, réduisent la volémie, diminuent les signes de surcharge
ventriculaire droite et améliorent la symptomatologie. La poso-
logie doit être adaptée à la clinique (poids de base, présence
d’œdème des membres inférieurs) mais peut être aussi ajustée en
fonction des pressions de remplissage cardiaque droit mesurées
lors des bilans échocardiographiques et hémodynamiques (2).
Oxygénothérapie
éoriquement, l’hypoxie peut aggraver l’hypertension pulmo-
naire par augmentation de la vasoconstriction hypoxique. Une
oxygénothérapie doit donc être envisagée chez les patients
présentant une hypoxie sévère (PaO2 < 60 mmHg). Cependant,
ce traitement est essentiellement symptomatique (2).
TRAITEMENT SPÉCIFIQUE DE L’HTAP
Si l’objectif principal des thérapeutiques est, bien sûr, l’amélioration
de la survie, il est nécessaire de prendre en compte de nombreux
objectifs, comme l’amélioration de la qualité de vie, des symp-
tômes et des capacités à l’eff ort.
Inhibiteurs calciques
Les inhibiteurs calciques peuvent s’opposer à la vasoconstric-
tion, mais ils n’ont pas d’eff ets sur le remodelage vasculaire
pulmonaire. Chez certains patients, les phénomènes de vaso-
constriction prédominent largement sur les phénomènes de
remodelage vasculaire, et les inhibiteurs calciques peuvent
apporter un bénéfi ce clinique. Ces patients dits “répondeurs”
sont identifi és par un test de vasoréactivité en aigu réalisé au
cours de la première évaluation par cathétérisme cardiaque droit
(7, 8). On défi nit comme “répondeurs” les patients présentant
une baisse de la pression artérielle pulmonaire moyenne d’au
moins 10 mmHg jusqu’à un niveau inférieur à 40 mmHg, avec un
débit cardiaque normal ou augmenté au cours de l’inhalation de
NO (9). Malheureusement, ils ne représentent qu’environ 10 %
de l’ensemble des patients présentant une HTAP idiopathique
ou associée à la prise d’anorexigènes (9). Chez ces patients, le
diltiazem, la nifédipine ou l’amlodipine, à des doses sensible-
ment plus élevées que dans d’autres indications, permettent une
réponse clinique et hémodynamique très satisfaisante, et un
pronostic excellent (9). À l’inverse, les inhibiteurs calciques sont
toujours ineffi caces chez les patients non répondeurs au NO.
Dérivés de la prostacycline
La prostacycline (PGI2) est produite par les cellules endothé-
liales et entraîne une relaxation du muscle lisse vasculaire et
une inhibition de l’agrégation plaquettaire par le biais d’une
augmentation de la concentration intracellulaire d’AMP cyclique.
Mais c’est surtout pour les eff ets antiproliférants de la PGI
2
sur
les cellules musculaires lisses (CML) que ses dérivés sont utilisés
dans le traitement de l’HTAP.
L’époprosténol 쐌
Du fait de sa très courte demi-vie (3 minutes), la PGI2 ou épopros-
ténol (Flolan
®
) doit être administrée par voie intraveineuse

La Lettre du Pharmacologue - vol. 23 - n° 2 - avril-mai-juin 2009
Pharmacologie
Pharmacologie
51
continue à l’aide d’une pompe connectée à un cathéter sous-
clavier tunnellisé. Chez les patients en classe fonctionnelle III
ou IV de la NYHA, le traitement par époprosténol a prouvé qu’il
apportait une amélioration signifi cative des symptômes, des
capacités à l’eff ort (test de marche de 6 minutes), des paramètres
hémodynamiques ainsi qu’une réduction de la mortalité (10-12).
L’époprosténol est indiqué dans l’HTAP idiopathique, familiale,
ou associée aux connectivites, en classe fonctionnelle III ou IV
de la NYHA. Ce médicament reste le traitement de référence
des formes les plus sévères de la maladie.
En dépit du bénéfi ce apporté, la perfusion continue d’époprosténol
ne constitue pas un traitement idéal. Il s’agit d’une thérapeutique
complexe, inconfortable et dont le coût est très élevé. Les
eff ets secondaires du traitement sont fréquents : douleurs des
mâchoires, céphalées, diarrhées, fl ushes, douleurs des membres
inférieurs, nausées et vomissements (10-12). Ces manifestations
sont doses-dépendantes et le plus souvent modérées, ne néces-
sitant pas l’interruption du traitement. Les complications les
plus sévères sont liées au mode d’administration par cathéter :
thromboses et surtout infections (incidence de l’ordre de 0,1 à
0,6 cas par an et par patient) [13]. L’interruption du traitement
par dysfonction de la pompe ou rupture de cathéter peut se
compliquer d’une aggravation brutale de l’HTAP, potentielle-
ment mortelle (4).
Les analogues stables de la prostacycline 쐌
Les complications liées à la mise en place d’un cathéter veineux
central pour l’administration intraveineuse d’époprosténol ont
justifi é le développement d’analogues de la prostacycline délivrés
sous d’autres formes (sous-cutanée, inhalée ou orale).
Le tréprostinil (Remodulin
®
) est un analogue de la prostacycline
dont la demi-vie est plus longue, ce qui permet une administra-
tion en continu par voie sous-cutanée à l’aide d’une minipompe
semblable à celle utilisée pour la délivrance de l’insuline (14).
Une étude contrôlée a démontré que ce traitement permettait
d’améliorer les capacités à l’exercice et l’hémodynamique des
patients en classe II, III ou IV de la NYHA (14). L’existence de
douleurs au point d’injection observées chez 85 % des patients
représente le principal eff et secondaire. Ces douleurs consti-
tuent parfois un facteur limitant à l’augmentation des doses
et conduisent à l’arrêt du traitement dans environ 8 % des cas
(14). Les données à long terme sont encourageantes, avec un
impact positif sur la survie (15, 16). Le tréprostinil par voie
sous-cutanée est indiqué dans l’HTAP idiopathique de classe
fonctionnelle III.
Le tréprostinil peut également être utilisé comme l’époprosténol,
par voie intraveineuse (il est approuvé aux États-Unis dans cette
indication, mais aucune AMM n’est pour l’instant disponible
en France). Des essais thérapeutiques avec le tréprostinil en
inhalation et par voie orale sont en cours.
L’iloprost (Ventavis
®
) est un analogue stable de la prostacycline,
qui est administré par inhalation à l’aide d’un système produisant
des particules d’un diamètre de 0,5 à 3 μm. La courte durée
d’action de l’iloprost constitue le principal désavantage de ce
mode d’administration, puisqu’il nécessite 6 à 9 inhalations
par jour. Une étude contrôlée a permis de démontrer que le
traitement par iloprost améliorait le test de marche et la classe
fonctionnelle de patients souff rant d’HTAP et en classe fonction-
nelle III ou IV de la NYHA (17). La toux et les symptômes liés à
la vasodilatation représentent les principaux eff ets secondaires
observés (17). Les résultats à long terme obtenus avec l’iloprost
en monothérapie sont malheureusement assez décevants (18).
L’iloprost inhalé est approuvé dans l’HTAP idiopathique de
classe fonctionnelle III.
Antagonistes des récepteurs de l’endothéline
L’ET-1 est un puissant vasoconstricteur et un facteur favorisant
la prolifération des CML, contribuant ainsi à l’augmentation
du tonus vasculaire pulmonaire et à l’hypertrophie des parois
artérielles pulmonaires. Les antagonistes des récepteurs de l’ET-1
sont des médicaments utilisables par voie orale.
Le bosentan (Tracleer
®
) est un antagoniste mixte des récep-
teurs de l’endothéline. Deux essais contrôlés contre placebo
ont démontré son effi cacité chez des patients présentant une
HTAP idiopathique ou associée à une sclérodermie en classe
fonctionnelle III ou IV de la NYHA (19, 20). Ainsi, le bosentan
améliore les capacités à l’eff ort, l’hémodynamique, et allonge
le délai avant aggravation clinique (19, 20). L’évaluation à long
terme des patients inclus dans les deux essais contrôlés est en
faveur d’une amélioration de la survie sous bosentan par rapport
à la survie théorique (21). Une étude récente a montré son effi ca-
cité dans des formes moins sévères d’HTAP chez des patients en
classe fonctionnelle II de la NYHA (22). La dose recommandée
est de 62,5 mg deux fois par jour pendant 4 semaines, puis de
125 mg deux fois par jour. Le principal eff et secondaire est la
cytolyse hépatique, toujours réversible, survenant dans environ
7 % des cas, ce qui nécessite une surveillance mensuelle des
transaminases. Le traitement est contre-indiqué en cas d’in-
suffi sance hépatique modérée ou sévère ou en cas d’élévation
des transaminases à plus de trois fois la normale.
En dehors de l’HTAP idiopathique, familiale et associée aux
connectivites, le bosentan a été utilisé avec succès dans d’autres
formes d’HTAP, en particulier l’HTAP associée au VIH (23) et
l’HTAP associée aux cardiopathies congénitales (24).
Le bosentan est approuvé dans le traitement de l’HTAP en classe
fonctionnelle III de la NYHA.
Le sitaxentan ( elin
®
) est un antagoniste sélectif des récep-
teurs A de l’ET-1, ce qui off re l’avantage théorique d’éviter la
vasoconstriction induite par la liaison de l’ET-1 à son récepteur
de type A situé sur les CML, tout en maintenant la liaison à
son récepteur de type B responsable d’une vasodilatation et
d’une augmentation de la clairance de l’ET-1 (25). Deux études
ont démontré un eff et positif de ce traitement sur le test de
marche et l’hémodynamique (26, 27). La dose de sitaxentan est
de 100 mg par jour. Comme pour le bosentan, les eff ets secon-
daires sont essentiellement hépatiques, même si la fréquence des
cytolyses semble un peu plus faible. Une surveillance mensuelle
du bilan hépatique est cependant nécessaire. Il existe une
importante interaction médicamenteuse entre le sitaxentan
et les antivitamines K, ce qui rend parfois très diffi cile l’équi-

La Lettre du Pharmacologue - vol. 23 - n° 2 - avril-mai-juin 2009
Pharmacologie
Pharmacologie
52
libration du traitement anticoagulant (risque important de
surdosage). Le sitaxentan est approuvé dans l’HTAP de classe
fonctionnelle III.
L’ambrisentan (Volibris
®
), autre antagoniste sélectif des récep-
teurs A de l’ET-1, a été évalué dans deux essais contrôlés avec
un eff et bénéfi que observé sur le test de marche et l’hémody-
namique (28, 29). La fréquence des cytolyses semble plus faible
et il n’y a pas d’interaction médicamenteuse avec l’ambrisentan.
L’ambrisentan est approuvé dans l’HTAP de classes fonction-
nelles II et III.
Les résultats à long terme avec ces deux médicaments sont
encore mal connus, en particulier en ce qui concerne leur impact
sur la survie des malades.
Inhibiteurs de la phosphodiestérase de type 5
L’inhibition de la PDE5 est à l’origine d’une augmentation de la
concentration intracellulaire de GMP cyclique, avec pour consé-
quence une relaxation du muscle lisse vasculaire pulmonaire
et une inhibition de la prolifération des cellules musculaires
lisses (30, 31). Les inhibiteurs de la PDE5, comme le sildénafi l
(Revatio
®
) ou le tadalafi l, ont l’avantage d’une administration
par voie orale et de l’absence d’eff ets secondaires hépatiques. Un
essai contrôlé a prouvé l’effi cacité à court terme (12 semaines)
du sildénafi l chez des patients en classe fonctionnelle II ou III
de la NYHA (amélioration de la distance parcourue au test
de marche et amélioration des paramètres hémodynamiques)
[32]. Aucun eff et dose-réponse n’ayant pu être démontré, c’est
la plus faible dose testée (20 mg trois fois par jour) qui a été
retenue et approuvée par les autorités de santé. Le traitement
par sildénafi l était associé à la survenue d’eff ets secondaires
mineurs comme des fl ushs, des troubles digestifs et des diarrhées.
Aucune donnée n’est actuellement disponible, ni sur l’effi cacité
à long terme du sildénafi l aux doses recommandées, ni sur la
survie. Le sildénafi l est approuvé dans le traitement de l’HTAP
de classe fonctionnelle III de la NYHA.
RECOMMANDATIONS ACTUELLES
Malgré les avancées récentes dans la prise en charge des patients
atteints d’HTAP, les traitements actuels ne permettent pas de
guérir cette maladie grave. Néanmoins, ils permettent d’amé-
liorer la qualité de vie des malades (meilleures capacités d’exer-
cice, mise à disposition de traitements par voie orale, etc.). À
l’exception de données pour les patients recevant de l’épopros-
ténol (11, 12) et, plus récemment, du bosentan (21, 33, 34),
l’effi cacité à long terme des nouveaux traitements reste mal
connue. Il apparaît donc nécessaire d’évaluer leur bénéfi ce à
long terme en termes d’effi cacité clinique et hémodynamique,
de qualité de vie des malades, mais aussi en termes de survie,
d’eff ets secondaires et de coût.
En l’absence de données comparant les diff érents traitements, le
choix du traitement initial dépend donc autant de l’expérience
des équipes et des réglementations locales que de l’état clinique
du patient et de ses préférences. Pour les HTAP sévères (classe
fonctionnelle IV), la plupart des experts recommandent un
traitement de première intention par époprosténol en injection
intraveineuse continue. En dehors de cette situation, les possi-
bilités de traitement pour les malades en classe fonctionnelle III
comprennent le bosentan ou le sildénafi l administrés par voie
orale, l’iloprost nébulisé, le tréprostinil sous-cutané, mais égale-
ment l’époprosténol intraveineux, débutés sous surveillance
dans un centre spécialisé dans la prise en charge des maladies
vasculaires pulmonaires.
Pour les formes moins sévères d’HTAP, des données sont main-
tenant disponibles, ce qui permet d’établir des recommanda-
tions thérapeutiques pour ces patients. Aussi, le bosentan, et
plus récemment l’ambrisentan, ont obtenu une AMM pour les
patients en classe fonctionnelle II de la NYHA.
À partir des données actuelles, un algorithme résumant la prise
en charge de l’HTAP a été proposé par les trois conférences d’ex-
perts publiées en 2004 (35-37) ; il a été modifi é lors du dernier
congrès mondial sur l’HTAP à Dana Point (Californie) en février
2008 (fi gure 2) [49].
PERSPECTIVES THÉRAPEUTIQUES
Si les stratégies thérapeutiques actuelles ont permis une amélio-
ration substantielle de l’espérance et de la qualité de vie des
malades, elles demeurent insuffi santes pour envisager aujourd’hui
un traitement curatif de la maladie. L’objectif majeur pour les
années futures est de passer d’une maladie invalidante et mortelle
à une maladie chronique sans handicap majeur (“vivre avec sa
maladie”). Afi n d’améliorer le pronostic de l’HTAP, plusieurs
pistes sont envisagées ou sont déjà en cours d’évaluation.
Un diagnostic plus précoce
L’objectif d’un diagnostic précoce est la possibilité d’un trai-
tement pour une forme moins sévère de la maladie. Compte
tenu de la rareté de la maladie, un diagnostic plus précoce ne
peut s’envisager que pour des groupes à risque, c’est-à-dire
dans lesquels la prévalence de l’HTAP est importante (formes
familiales, sclérodermies, infection par le VIH, hypertension
portale). Deux études portant sur le dépistage de l’HTAP au
cours de la sclérodermie (38) et au cours de l’infection par le
VIH (39) ont clairement montré que le dépistage échocardio-
graphique de l’HTAP dans ces populations à risque permettait
de diagnostiquer des formes moins graves de la maladie. Par
ailleurs, l’étude EARLY, évaluant l’effi cacité du bosentan chez
des patients en classe II de la NYHA, a montré un allongement
du temps avant détérioration clinique dans le groupe traité par
bosentan par rapport à celui recevant le placebo (22).
Les associations de traitements
Selon les recommandations actuelles, la majorité des patients est
actuellement traitée en première intention par une monothérapie.
En pratique courante, de plus en plus de malades reçoivent des
associations de traitements, soit d’emblée, soit le plus souvent
après échec d’un traitement de première ligne. L’association de
 6
6
 7
7
 8
8
1
/
8
100%