Lire l'article complet

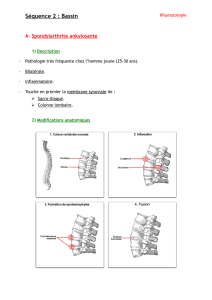
Aspects mécaniques
Tableau. Liste non exhaustive des ostéochondroses : loca-
lisations anatomiques et noms usuels selon les auteurs les
ayant décrites. En bleu : celles qui appartiennent au groupe
des apophysoses.
Ostéochondroses Noms
Capitulum Panner
Capitulum O. disséquante
Épicondyle médial Adams
Épiphyse radiale Madelung
Os lunatum Kienböck
Plateau vertébral Scheuermann
Épiphyse fémorale supérieure Legg-Perthes-Calvé
Synchondrose ischio-pubienne Van Neck-Odelberg
Tubérosité ischiatique Mac Master
Condyles fémoraux O. disséquante
Pointe de rotule Sinding Larsen-Johansson
Physe tibiale proximale interne Blount
Tubérosité tibiale antérieure Osgood-Schlatter
Dôme du talus O. disséquante
Calcanéum Sever
Os naviculaire Khöler-Mouchet
Base du 5emétatarsien Iselin
Tête des métatarsiens médiaux Freiberg
Os sésamoïdes Renander
La Lettre du Rhumatologue • No 394 - septembre 2013 | 13
Actualités sur la
RHUMATOLOGIE
PÉDIATRIQUE
Apophysoses de croissance
Growth apophysitis
Matthias Thépaut*
* Service de chirurgie pédiatrique,
hôpital Augustin-Morvan, CHU de
Brest.
L
es apophysoses de croissance sont un motif
fréquent de consultation en pédiatrie. Elles font
partie du vaste groupe des ostéo chondroses.
Une apophyse est une protubérance de l’os à
l’inser tion d’un tendon ou d’un ligament, de nature
cartilagineuse chez le petit enfant, siège d’une ossi-
fi cation enchondrale au cours de la croissance. Les
apo physoses correspondent à un trouble de cette
ossifi cation, dont l’étiopathogénie est imparfaite-
ment connue, bien que l’origine microtraumatique
semble avérée (1). Les différentes localisations des
apo physoses ont des caractères cliniques, radio-
graphiques et évolutifs communs. Actuellement,
ce terme est préféré à l’ancienne dénomination
“apophysite”, dont la connotation infl ammatoire
est inappropriée.
Cadre nosologique
des ostéochondroses
Le terme “ostéochondrose” regroupe plus de
50 entités caractérisées par des variations anor-
males de l’ossifi cation enchondrale des épiphyses
et des apophyses (2). Leur point commun est d’être
le siège d’un processus pathologique non infectieux
perturbant l’ossifi cation des noyaux secondaires.
La nécrose transitoire est suivie d’une régénéra-
tion osseuse (condensation, fragmentation, puis
reconstruction). La plupart des auteurs suspectent
une origine multifactorielle : ces lésions seraient
consécutives à des microtraumatismes par hyper-
sollicitation, favorisées par des facteurs anatomiques
et vasculaires. En 1981, R.S. Siffert a établi une clas-
sifi cation des ostéochondroses (2), qu’il sépare en :
➤ostéochondroses articulaires :
•
épiphysaires (Freiberg, Legg-Perthes-Calvé, etc.) ;
•
disséquantes (condyles fémoraux, capitulum, etc.),
limitées à l’os sous-chondral et au cartilage articulaire ;
➤ostéochondroses non articulaires :
•apophysoses (Osgood-Schlatter, Sever, etc.) ;
•avulsions et arrachements apophysaires ;
➤
ostéochondroses de la physe (Tibia vara ou
maladie de Blount, Madelung, Scheuermann, etc.).
Une liste non exhaustive des ostéochondroses est
rapportée dans le tableau. On ne peut généraliser la
prise en charge des ostéochondroses, tant ces entités
sont différentes, bien qu’ayant des similitudes. Il
est donc indispensable de bien connaître l’histoire
naturelle de chaque lésion. Alors qu’une maladie
d’Osgood-Schlatter évoluera favorablement à la

Points forts
14 | La Lettre du Rhumatologue • No 394 - septembre 2013
»Ce trouble d’ossification des apophyses s’intègre dans le cadre plus général des ostéochondroses.
»Le diagnostic se fait essentiellement à l’interrogatoire et à l’examen physique.
»
La guérison sans séquelle est obtenue par simple restriction d’activités physiques, mais les douleurs
peuvent durer plusieurs mois.
Mots-clés
Apophysose
Ostéochondrose
Maladie
d’Osgood-Schlatter
Highlights
»
This disorder in enchondral
ossification of the apophyses
is a part of the larger group of
the osteochondroses.
»
The diagnostic is essentielly
made with clinical examina-
tion.
»
Healing without after-effect is
obtained with only simple rest
but the pain may last several
months.
Keywords
Apophysitis
Osteochondrosis
Osgood-Schlatter disease
mise au repos simple, d’autres, comme la maladie
de Legg-Perthes-Calvé ou le Tibia vara, pourront être
sources de déformations et de handicap.
Le propos concerne ici les apophysoses. Toutes
les localisations ne pouvant être décrites, nous ne
détaillerons que les plus fréquentes. Cependant, la
démarche diagnostique devant une apophysose
est souvent identique, quel qu’en soit le site. Elle
repose essentiellement sur la clinique : le patient
se plaint de douleurs mécaniques qui surviennent
à l’effort ou juste après, puis cèdent au repos. La
pression de l’apophyse provoque la douleur. Dans les
localisations superficielles, on constate une tumé-
faction en regard.
La sémiologie radiologique est elle aussi volontiers
comparable d’une région à l’autre : les particularités
sont essentiellement liées à l’âge de survenue de
chaque lésion, qui correspond à la tranche d’âge
qui suit l’apparition de chaque noyau d’ossification
secondaire (3). Il est parfois difficile de différencier
une apophysose d’une croissance normale unique-
ment par l’imagerie, car l’ossification normale des
apophyses peut prendre un aspect très irrégulier.
Aussi, on ne réalise des examens que pour les loca-
lisations symptomatiques, sans faire de cliché bila-
téral systématique. La radiographie standard reste
l’examen de choix pour confirmer l’apophysose et
faire le diagnostic différentiel. Il faut parfois savoir
éliminer une infection, une tumeur ou un rhuma-
tisme. En cas de doute, des investigations complé-
mentaires peuvent être nécessaires.
Enfin, l’objectif thérapeutique étant purement fonc-
tionnel, la stratégie de prise en charge est semblable
d’une localisation à l’autre. Les apophysoses ont en
commun une guérison spontanée sans séquelles.
Certains enfants auront une atteinte bilatérale,
d’autres seront atteints en plusieurs localisations
au cours de leur croissance.
Apophysoses du pied
Maladie de Sever
L’apophysose de la grosse tubérosité du calcanéum
(insertion du tendon d’Achille) est la pathologie
microtraumatique la plus fréquente du pied (3),
touchant plutôt les garçons. Elle survient entre 7
et 12 ans, âge d’apparition du noyau d’ossification
secondaire du calcanéum, mais connaît un pic
de fréquence vers 9-10 ans. Elle est favorisée par
la mise en tension du tendon achiléen et par les
impacts sur le talon. Les activités incriminées sont
les sports de course (football) et de saut avec chaus-
sage léger (gymnastique). L’examen retrouve des
douleurs postérieures du calcanéum, qui incitent
les patients à marcher sur la pointe des pieds. On
peut retrouver un tendon un peu court avec un
arrière-pied en valgus. L’atteinte peut être bilaté-
rale, volontiers asymétrique, prédominant sur le
pied d’appel. La radiographie est très peu spéci-
fique, une image condensée ou fragmentée pouvant
classiquement se rencontrer entre 7 et 14 ans en
dehors de toute atteinte. L’évolution est favorable
en quelques mois en respectant un repos sportif.
Une talonnette visco-élastique améliore les dou-
leurs par absorption des vibrations à la marche et
baisse de tension du triceps. On peut pratiquer des
étirements passifs doux du tendon. L’immobilisation
est exceptionnelle, et reste réservée aux formes
hyperalgiques.
Apophysoses du genou
Maladie d’Osgood-Schlatter
Les microtraumatismes répétés au site d’insertion du
tendon rotulien entraînent des lésions histologiques
infracliniques et une réparation localisée aboutissant
à une proéminence de la tubérosité tibiale anté-
rieure (TTA) [4]. La prévalence de cette maladie est
de 10 % entre 8 et 16 ans, surtout chez le garçon
sportif. Le pic de survenue correspond à la poussée
de croissance pubertaire (13-14 ans chez les garçons,
10-11 ans chez les filles) [3].
L’atteinte est volontiers bilatérale. La douleur est
déclenchée à la course ou au saut, et survient en fin
d’activité, puis cède au repos. Progressivement, les
douleurs surviennent pour des activités de moins
en moins intenses, jusqu’à devenir permanentes
en journée. On observe une tuméfaction de la
TTA, douloureuse à la pression. L’extension active
contrariée provoque la douleur. Des conditions

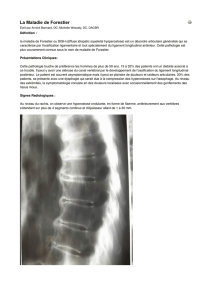
Figure. Exemples radiologiques d’apophysoses de croissance. A. Maladie d’Osgood-Schlatter. B. Maladie de Sinding
Larsen-Johansson. C. Maladie de Van Neck-Odelberg.
A B C
La Lettre du Rhumatologue • No 394 - septembre 2013 | 15
Actualités sur la
RHUMATOLOGIE
PÉDIATRIQUE
anatomiques telles qu’une rétraction des ischio-
jambiers ou du triceps sural, une patella alta ou
une torsion tibiale excessive peuvent lui être asso-
ciées (5-8).
La radiographie standard (figure, A) met en évidence
une proéminence de la TTA, un œdème des parties
molles et une fragmentation du noyau d’ossification
(pouvant exister physiologiquement). L’échographie
peut être une alternative à la radiographie, mettant
en évidence un épaississement du tendon et une
bursite (9). Dans les formes typiques, l’imagerie n’est
pas indispensable, mais sert surtout au diagnostic
différentiel. Les symptômes disparaissent à maturité
osseuse avec la fusion de l’apophyse. Parfois, un
fragment peut rester séquestré, formant un ossicule
responsable de douleurs chroniques (10).
La prise en charge initiale est purement sympto-
matique, fondée sur le repos sportif plus ou moins
restrictif et le glaçage, plus efficace que la prise
d’AINS, qui semble inutile (11). L’immobilisation,
source d’amyotrophie, est déconseillée en dehors
des formes hyperalgiques. Les infiltrations de corti-
coïdes sont contre-indiquées car incriminées dans
la fragilisation du tendon rotulien (3).
Après décroissance des douleurs, on commencera
des exercices d’étirements doux et de renforcement
du quadriceps. Le seul critère de guérison est la dis-
parition complète des douleurs. Dans les formes
chroniques compliquées d’un ossicule, on procède
à l’exérèse chirurgicale de celui-ci.
Maladie de Sinding Larsen-Johansson
Plus rare que celle de la TTA, l’apophysose de la
pointe de la patella est très proche de la maladie
d’Osgood-Schlatter en termes de symptômes,
d’imagerie (figure, B) et de traitement. Les signes
cliniques sont transposés au pôle inférieur de la
rotule. La persistance de fragments osseux avulsés
ou de calcifications intratendineuses peut amener
à une exérèse chirurgicale.
La préexistence d’une apophysose d’Osgood-
Schlatter ou de Sinding-Larsen-Johansson est très
probablement un facteur favorisant les fractures-
arrachements de la TTA ou de la pointe de la rotule
lors d’une extension active violente du genou (shoot
dans le vide) ou en flexion passive forcée (12).
Le traitement de ces arrachements est orthopédique
ou chirurgical en fonction du type de fracture (Classi-
fication d’Ogden) [12].
Apophysoses du bassin
Maladie de Van Neck-Odelberg
Cette synchondrose ischio-pubienne (figure, C) se
retrouve surtout chez les athlètes et gymnastes. Elle
est source de douleurs augmentant à l’abduction de
hanche, volontiers étiquetées “tendinites”. On parle
de maladie de Van Neck-Odelberg chez les patients
1. Staheli LT. Practice of
pediatric orthopedics. Phila-
delphia: Lippincott Williams
& Wilkins, 2006:16-7.
2. Siffert RS. Classification
of the osteochondroses.
Clin Orthop Relat Res 1981;
158:10-8.
3. Lascombes P, Tanguy A,
Ramseyer P. Ostéochondrite
de croissance. EMC-Appareil
locomoteur. Paris : Elsevier,
1994:1-0 [Article 14-028-A-20].
4. Ogden JA, Southwick WO.
Osgood-Schlatter’s disease
and tibial tuberosity develop-
ment. Clin Orthop Relat Res
1976;116:180-9.
5. Sarcević Z. Limited ankle
dorsiflexion: a predisposing
factor to Morbus Osgood
Schlatter? Knee Surg Sports
Traumatol Arthrosc 2008;
16(8):726-8.
6. De Lucena GL, dos Santos
Gomes C, Guerra RO.
Pre valence and associated
factors of Osgood-Schlatter
syndrome in a population-
based sample of Brazilian
adolescents. Am J Sports Med
2011;39(2):415-20.
7. Gigante A, Bevilacqua C,
Bonetti MG, Greco F.
Increased external tibial
torsion in Osgood-Schlatter
disease. Acta Orthop Scand
2003;74(4):431-6.
8. Aparicio G, Abril JC, Calvo E,
Alvarez L. Radiologic study of
patellar height in Osgood-
Schlatter disease. J Pediatr
Orthop 1997;17(1):63-6.
9. De Flaviis L, Nessi R,
Scaglione P, Balconi G, Albi-
setti W, Derchi LE. Ultrasonic
diagnosis of Osgood-Schlatter
and Sinding-Larsen-Johansson
diseases of the knee. Skeletal
Radiol 1989;18(3):193-7.
10. Krause BL, Williams JP,
Catterall A. Natural history
of Osgood-Schlatter disease.
J Pediatr Orthop 1990;10(1):
65-8.
11. Dohin B, Al Khouri Salem H.
Pathologie micro-trauma-
tique du genou. In : Gicquel P,
Karger C, Schneider L,
Clavert JM (eds). Le genou de
l’enfant. Montpellier : Sauramps
médical, 2013:157-67.
12. Ogden JA, Tross RB,
Murphy MJ. Fractures of the
tibial tuberosity in adoles-
cents. J Bone Joint Surg Am
1980;62(2):205-15.
Références
bibliographiques

SIMPONI® 50 mg, solution injectable en stylo prérempli / solution injectable en seringue préremplie. COMPOSITION (*) : Solution injectable en stylo prérempli, SmartJect de 0,5 ml contenant 50 mg de golimumab : boîte unitaire. Solution
injectable en seringue préremplie de 0,5 ml contenant 50 mg de golimumab : boîte unitaire. La solution est limpide à légèrement opalescente, incolore à légèrement jaune. Excipients : Sorbitol (E420), L-histidine, chlorhydrate d’histidine monohydraté,
polysorbate 80, eau pour préparations injectables. Excipients à effet notoire : Sorbitol (E420) - Chaque stylo/seringue contient 20,5 mg de sorbitol. INDICATIONS : Polyarthrite rhumatoïde (PR) : Simponi, en association avec le méthotrexate (MTX), est
indiqué dans : • le traitement de la polyarthrite rhumatoïde active, modérée à sévère chez les adultes, lorsque la réponse aux traitements de fond antirhumatismaux (DMARD), y compris le MTX, a été inadéquate. • le traitement de la polyarthrite rhumatoïde
active, sévère et évolutive chez les adultes non traités auparavant par le MTX. Il a été démontré que Simponi, en association avec le MTX, ralentit la vitesse de progression de la destruction articulaire, mesurée par radiographie et améliore la fonction
physique. Rhumatisme psoriasique (RP) : Simponi, seul ou en association avec le MTX, est indiqué dans le traitement du rhumatisme psoriasique actif et évolutif chez les adultes, lorsque la réponse à un précédent traitement de fond antirhumatismal
(DMARD) a été inadéquate. Il a été démontré que Simponi ralentit la vitesse de progression de la destruction articulaire périphérique, mesurée par radiographie chez les patients présentant des formes polyarticulaires symétriques de la maladie et améliore
la fonction physique. Spondylarthrite ankylosante (SA) : Simponi est indiqué dans le traitement de la spondylarthrite ankylosante active sévère chez les adultes qui n’ont pas répondu de manière adéquate à un traitement conventionnel. POSOLOGIE ET
MODE D’ADMINISTRATION (*) : Le traitement par Simponi doit être initié et supervisé par des médecins qualifiés expérimentés dans le diagnostic et le traitement de la polyarthrite rhumatoïde, du rhumatisme psoriasique ou de la spondylarthrite
ankylosante. Les patients traités par Simponi devront recevoir la carte de signalement Patient. Posologie. • Polyarthrite rhumatoïde : Simponi 50 mg administré une fois par mois, à la même date chaque mois. Simponi doit être administré de manière
concomitante avec le MTX. • Rhumatisme psoriasique : Simponi 50 mg administré une fois par mois, à la même date chaque mois.• Spondylarthrite ankylosante : Simponi 50 mg administré une fois par mois, à la même date chaque mois.Les données
disponibles suggèrent que la réponse clinique est habituellement obtenue dans les 12 à 14 semaines de traitement (après 3 à 4 doses). La poursuite du traitement doit être reconsidérée chez les patients pour lesquels aucun bénéce thérapeutique n’a
été démontré dans ce délai. Chez les patients pesant plus de 100 kg qui n’obtiennent pas de réponse clinique satisfaisante après 3 ou 4 doses, une augmentation de la dose de golimumab à 100 mg une fois par mois peut être envisagée, en tenant
compte du risque accru de certains effets indésirables graves survenant avec une dose de 100 mg par rapport à 50 mg. La poursuite du traitement doit être reconsidérée chez les patients pour lesquels aucun bénéce thérapeutique n’a été démontré
après 3 à 4 doses supplémentaires de 100 mg. En cas d’oubli d’une prise de Simponi, elle doit être effectuée dès que le patient s’en souvient. Les patients doivent recevoir comme instruction de ne pas injecter une double dose pour compenser la dose
oubliée. La dose suivante devra être administrée d’après le principe suivant : - Si la dose est administrée avec moins de 2 semaines de retard, le patient devra s’injecter la dose oubliée et poursuivre le traitement selon le calendrier mensuel initial - Si la
dose est administrée avec plus de 2 semaines de retard, le patient devra s’injecter la dose oubliée et un nouveau calendrier mensuel devra être établi à partir de la date de cette injection. Mode d’administration. Voie sous-cutanée. Après avoir été
formés de manière appropriée à la technique d’injection sous-cutanée, les patients peuvent s’injecter eux-mêmes Simponi si leur médecin considère que cela est approprié, avec un suivi médical si nécessaire. Les patients doivent recevoir comme
instruction d’injecter la quantité totale de Simponi selon les instructions complètes d’administration fournies dans la notice. CONTRE-INDICATIONS : • Hypersensibilité à la substance active ou à l’un des excipients. • Tuberculose (TB) active ou autres
infections sévères, telles que sepsis, et infections opportunistes. • Insufsance cardiaque modérée ou sévère (de classe III/IV dans la classication NYHA). MISES EN GARDE SPECIALES ET PRECAUTIONS D’EMPLOI (*) : Affections pour lesquelles
Simponi ne doit pas être instauré : Infections : infection active cliniquement importante, tuberculose active. Affections pour lesquelles Simponi devra être interrompu ou devra faire l’objet d’une surveillance étroite : Infections : tuberculose,
extra-pulmonaire dans la majorité des cas, (qui doit être recherchée avant tout traitement par golimumab), infection chronique ou antécédents d’infection récurrente, infections bactériennes (notamment sepsis et pneumonie), mycobactériennes, infections
fongiques invasives ou opportunistes. Surveillance maintenue jusqu’à 5 mois après l’arrêt de Simponi. Des cas de tuberculose active ont été rapporté chez des patients traités par Simponi pendant et après le traitement de la tuberculose latente. Les
patients traités par Simponi doivent être surveillés étroitement pour déceler des signes et des symptômesde tuberculose active, y compris les patients présentant un résultat négatif au test de dépistage d’une tuberculose latente, les patients qui suivent
un traitement pour une tuberculose latente, ou les patients ayant été précédemment traités pour une infection tuberculeuse. Réactivation d’une hépatite B : infection à VHB à rechercher avant d’initier un traitement par Simponi. Tumeurs malignes et
troubles lymphoprolifératifs. Cancers cutanés : Des examens périodiques de la peau sont recommandés, en particulier chez les patients qui ont des facteurs de risque de cancer cutané. Insufsance cardiaque congestive (ICC) : légère (de classe I/II de
la NYHA). Arrêt du traitement si apparition de nouveaux symptômes ou aggravation de l’insufsance cardiaque. Atteintes neurologiques : troubles démyélinisants du système nerveux central (y compris la sclérose en plaques) et périphériques. Le rapport
bénéce/risque d’un traitement anti-TNF doit être pris en compte avant d’initier un traitement par Simponi. L’arrêt de Simponi devra être envisagé si ces troubles se manifestent. Réactions auto-immunes : maladies auto-immunes (syndrome type lupus).
Réactions hématologiques : pancytopénie, leucopénie, neutropénie, anémie aplasique, thrombocytopénie. L’arrêt de Simponi devra être envisagé pour les patients présentant des anomalies hématologiques significatives confirmées. Changement
d’agents biologiques : continuer la surveillance des patients. Réactions allergiques : hypersensibilité systémique (réaction anaphylactique), parfois survenue dès la première administration. Hypersensibilité au latex : présence de latex dans le protège
aiguille de la seringue ou du stylo. Présence de sorbitol. Le traitement par Simponi n’est pas recommandé : avec d’autres biothérapies utilisées pour traiter les mêmes affections que Simponi dont l’anakinra, l’abatacept ou avec les vaccins vivants.
Précautions chez les personnes âgées de 65 ans ou plus à l’égard de la survenue d’infections et chez les sujets atteints de troubles de la fonction hépatique. INTERACTIONS AVEC D’AUTRES MEDICAMENTS ET AUTRES FORMES D’INTERACTIONS (*) :
L’association de Simponi avec d’autres biothérapies utilisées pour traiter les même affections que Simponi, dont l’anakinra et l’abatacept n’est pas recommandée. Les vaccins vivants ne doivent pas être administrés de façon concomitante avec Simponi.
FECONDITE, GROSSESSE ET ALLAITEMENT (*) : Femmes en âge d’avoir des enfants : utilisation d’une contraception appropriée pendant au moins 6 mois après le dernier traitement par golimumab. Grossesse : l’utilisation de golimumab n’est
pas recommandée pendant la grossesse. Allaitement :
comme de nombreuses immunoglobulines humaines sont excrétées dans le lait maternel, les femmes ne doivent pas allaiter pendant au moins 6 mois après le dernier traitement par golimumab.
EFFETS SUR L’APTITUDE A CONDUIRE DES VEHICULES ET A UTILISER DES MACHINES (*) : Simponi peut avoir une inuence mineure sur l’aptitude à conduire des véhicules et à utiliser des machines. Des vertiges peuvent survenir après
l’administration de Simponi. EFFETS INDESIRABLES (*) : Les plus fréquents lors des études cliniques - très fréquent ≥ 1/10 : Infection des voies respiratoires hautes (nasopharyngite, pharyngite, laryngite et rhinite). - fréquent ≥1/100 à <1/10 :
infections bactériennes (telle que cellulite), infections virales (telles que grippe et herpès), bronchite, sinusite, infections fongiques superficielles, anémie, réactions allergiques (bronchospasme, hypersensibilité, urticaire), auto-anticorps positif, dépression,
insomnie, vertiges, paresthésies, céphalées, hypertension, constipation, dyspepsie, douleur gastro-intestinale et abdominale, nausées, augmentation de l’alanine aminotransférase et de l’aspartate aminotransférase, alopécie, dermatite, prurit, rash,
pyrexie, asthénie, réaction au site d’injection (telle qu’érythème au site d’injection, urticaire, induration, douleur, hématome, prurit, irritation et paresthésies), altération des facultés de guérison, gêne thoracique. Effets indésirables d’intérêt particulier
(en fréquence ou gravité) : Infections graves (tuberculose, sepsis, pneumonie, infections opportunistes), lymphome, troubles démyélinisants, augmentation du taux des enzymes hépatiques, réaction au site d’injection (érythème). SURDOSAGE (*).
PROPRIETES PHARMACOLOGIQUES (*) : Inhibiteurs du Facteur Nécrosant des Tumeurs alpha (TNF), code ATC : L04AB06. CONDITIONS DE CONSERVATION : A conserver au réfrigérateur (entre 2ºC et 8ºC). Ne pas congeler. Conserver le stylo/
la seringue prérempli(e) dans l’emballage extérieur à l’abri de la lumière. Simponi ne doit pas être utilisé si la solution jaunit, est trouble ou si elle contient des particules étrangères visibles. DONNEES ADMINISTRATIVES : • Liste I - Médicament
soumis à prescription initiale hospitalière annuelle. Prescription initiale et renouvellement réservés aux spécialistes en rhumatologie ou en médecine interne. Médicament d’exception (prescription en conformité avec la Fiche d’Information
Thérapeutique). 1 stylo prérempli AMM EU/1/09/546/001 (2009, rév. mars 2013) - Code CIP 3400939730745 / 1 seringue préremplie AMM EU/1/09/546/003 (2009, rév. mars 2013) - Code CIP 3400939730974 - Prix : 937,23 € (boîte unitaire :
seringue ; stylo). Remboursement par la Sécurité Sociale à 65 %. Non pris en charge par l’assurance maladie dans la polyarthrite rhumatoïde active, sévère et évolutive chez les adultes non traités auparavant par le méthotrexate. Agréé à l’usage des
Collectivités. Inscrit sur la liste des spécialités prises en charge en sus de la T2A. • TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE : Biologics B.V. Einsteinweg 101 - 2333 CB Leiden - Pays-Bas • REPRESENTANT LOCAL : MSD France - 34,
avenue Léonard de Vinci - 92400 Courbevoie - Information médicale : 01 80 46 40 40. (*) Pour une information complète, consulter le Résumé des Caractéristiques du Produit sur le site de l’EMA, http://www.ema.europa.eu/.
Aspects mécaniques
16 | La Lettre du Rhumatologue • No 394 - septembre 2013
Actualités sur la
RHUMATOLOGIE
PÉDIATRIQUE
symptomatiques, mais 50 % des enfants présentent
des images similaires vers 8-10 ans (fusion du pubis
et de l’ischion). L’aspect radiologique peut mimer
celui d’une tumeur, ce qui pose le problème du diag-
nostic différentiel.
Toutes les apophyses du bassin peuvent être inté-
ressées (maladie de Mac Master à la tubérosité
ischiatique, épines iliaques, etc.). Le bassin est
aussi particulièrement le siège d’arrachements
apophysaires aigus lors d’une contraction brutale.
Chaque localisation a sa tranche d’âge et sa pra-
tique sportive spécifi que. Une telle avulsion impose
l’arrêt immédiat de l’activité. Le simple repos au lit
quelques jours suffi t à faire disparaître les douleurs,
et la consolidation est obtenue en 3 à 4 semaines.
Certaines localisations justifi ent une fi xation chirur-
gicale (tubérosité ischiatique, grand trochanter).
Conclusion
Les apophysoses de croissance sont un motif très
fréquent de consultation chez les enfants sportifs.
Le diagnostic repose essentiellement sur l’interro-
gatoire et l’examen physique. Les examens complé-
mentaires, en premier lieu la radiographie standard,
confi rment le diagnostic et éliminent une patho-
logie plus grave comme une tumeur. L’évolution des
apophysoses est spontanément favorable, mais les
douleurs peuvent durer plusieurs mois, voire plu-
sieurs années, entraînant la restriction des activités
physiques chez des adolescents en demande. Le trai-
tement est fonctionnel, conservateur dans la plupart
des cas, exception faite des exérèses d’ossicule ou
du repositionnement de certaines avulsions apo-
physaires. ■
L’auteur déclare
ne pas avoir de liens d’intérêts.
1
/
4
100%