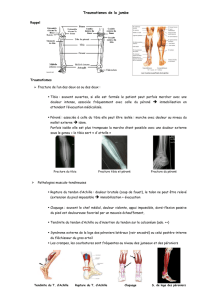
Bases anatomiques de l`aponévrotomie endoscopique de jambe

UNIVERSITE PARIS-EST CRETEIL VAL DE MARNE
FACULTE DE MEDECINE DE CRETEIL
<<<<><><><><><><>>>>
ANNEE 2013 N°
THESE
POUR LE DIPLOME D'ETAT
DE
DOCTEUR EN MEDECINE
Discipline : Chirurgie Orthopédique
------------
Présentée et soutenue publiquement le 25 Avril 2013
A Kremlin Bicêtre
------------
Par Pierre DIVINÉ
Né le 21 Juillet 1983 à Paris
-------------
Bases anatomiques de l'aponévrotomie endoscopique
de jambe dans les syndromes de loges d'effort
PRESIDENT DE THESE : LE CONSERVATEUR DE LA
Professeur Olivier GAGEY BIBLIOTHEQUE UNIVERSITAIRE
DIRECTEUR DE THESE :
Professeur Thierry BÉGUÉ
Signature du Cachet de la bibliothèque
Président de thèse universitaire

2
REMERCIEMENTS
A mon président de thèse :
Au Professeur Olivier Gagey
Professeur Universitaire – Praticien Hospitalier de Chirurgie Orthopédique, Kremlin Bicêtre
Vous me faîtes l’honneur de présider ma thèse et de me soutenir dans mes démarches, merci
de votre disponibilité. Soyez assuré de ma reconnaissance et de mon profond respect.
Aux membres de mon jury de thèse :
Au Professeur Philippe Hernigou
Professeur Universitaire – Praticien Hospitalier de Chirurgie Orthopédique, Henri Mondor
Vous avez accepté de participer à mon jury de thèse, votre aide et votre soutien me touchent
particulièrement. Soyez assuré de ma gratitude et de mon respect.
Au Docteur Stéphane Levante
Praticien Hospitalier de Chirurgie Orthopédique, Antoine Béclère
Vous avez aimablement accepté de participer à mon jury de thèse et de la critiquer. Soyez
assuré de mon estime. Merci de m’avoir accompagné durant l’année passée à Béclère.
Au Professeur Alexandre Poignard
Professeur Universitaire – Praticien Hospitalier de Chirurgie Orthopédique, Henri Mondor
Vous avez accepté de vous investir et de me soutenir dans ce travail. Merci pour votre
gentillesse. Vous avez activement participé, dès mon stage d’externe, à mon choix de
spécialité.
A mon directeur de thèse et maître de stage :
Au Professeur Thierry Bégué
Professeur Universitaire – Praticien Hospitalier de Chirurgie Orthopédique, Antoine Béclère
Vous me faîtes l’honneur de diriger ma thèse. L’année passée dans votre service a été
décisive et très formatrice. Merci pour votre paternalisme. Vous m’avez beaucoup appris,
notamment en termes de rigueur. Merci de m’avoir accompagné durant tout mon internat.
J’espère travailler encore longtemps à vos côtés.

3
A ma Femme, Aurélie Diviné, tu m’as toujours soutenu dans mon travail. Tu as toujours été
présente lorsque j’en avais besoin. Tu m’as accompagné dans mes recherches jusqu’au fer à
moulin. Tu participes toujours activement à l’ensemble de mes choix et je t’en remercie. Tu
me rends heureux et je suis fier d’être ton mari. Merci de m’apporter autant de bonheur
chaque jour. Merci du plus beau cadeau que tu pouvais me faire… Je t’aime !
A mon fils, Clément, notre beau bébé. Tu nous remplis de joie à chaque sourire. Je serais là
dès que tu auras besoin de moi. Je t’aime !
A mes parents, vous m’avez toujours soutenu durant mes études. Vous avez pleinement
participé à mon évolution professionnelle. J’espère vous rendre fier. Merci pour votre
présence et cette famille que j’aime.
A mon petit frère, Vincent, à toutes nos années passées ensemble, à tes réussites
professionnelles et surtout amoureuses. Plein de bonheur à vous deux. J’espère que l’on
passera plein de beaux moments ensemble.
A ma belle famille, merci pour votre accueil chaleureux. Vous m’apportez beaucoup de joie
et je vous remercie encore de tout ce que vous faîtes pour nous. Merci d’avoir créé et de
m’avoir ouvert ce joli cocon familial.
A tous mes enseignants, qui ont participé à ma formation durant mes stages et qui m’ont
transmis leur passion.
A tous mes amis, co-internes et chefs devenus amis qui m’ont soutenu… Merci pour tout !

4
SERMENT D’HIPPOCRATE
EN PRESENCE DES MAITRES DE CETTE ECOLE,
DE MES CHERS CONDISCIPLES
ET DEVANT L’EFFIGIE D’HIPPOCRATE,
JE PROMETS ET JE JURE D’ETRE FIDELE
AUX LOIS DE L’HONNEUR ET DE LA PROBITE
DANS L’EXERCICE DE LA MEDECINE.
JE DONNERAI MES SOINS GRATUITS A L’INDIGENT
ET N’EXIGERAI JAMAIS UN SALAIRE AU-DESSUS DE MON TRAVAIL.
ADMIS DANS L’INTERIEUR DES MAISONS,
MES YEUX NE VERRONT PAS CE QUI S’Y PASSE,
MA LANGUE TAIRA LES SECRETS QUI ME SERONT CONFIES,
ET MON ETAT NE SERVIRA PAS A CORROMPRE LES MOEURS
NI A FAVORISER LE CRIME.
RESPECTUEUX ET RECONNAISSANT ENVERS MES MAITRES,
JE RENDRAI A LEURS ENFANTS
L’INSTRUCTION QUE J’AI REÇUE DE LEURS PERES.
QUE LES HOMMES M’ACCORDENT LEUR ESTIME
SI JE SUIS FIDELE A MES PROMESSES !
QUE JE SOIS COUVERT D’OPPROBRE
ET MEPRISE DE MES CONFRERES
SI J’Y MANQUE.

5
Résumé
Introduction - Le syndrome des loges d’effort de jambe se définit par une
augmentation de pression intramusculaire à l’origine de douleurs de jambe spontanément
résolutives au repos. Son traitement est chirurgical et consiste en une aponévrotomie.
Matériel et Méthodes - Notre étude portait sur 30 cadavres. L’objectif était d’établir
une technique chirurgicale endoscopique à incision unique permettant une aponévrotomie
complète et fiable des loges antérieure, antéro-externe et postérieure. Les critères étudiés
étaient la taille de l’incision cutanée, la visualisation des structures nerveuses à risque ainsi
que les limites des aponévrotomies. Puis nous disséquions chaque jambe pour mesurer les
longueurs des 3 aponévrotomies et étudier le taux de lésions nerveuses.
Résultats - Une limite distale de la loge antérieure était systématiquement identifiée
endoscopiquement par le retinaculum des extenseurs. Une aponévrose rigide et opaque
constituait la limite endoscopique distale de la loge antéro-externe, identifiée chez 90% des
sujets. Les autres limites étaient morphologiques. Les tailles des aponévrotomies des loges
antérieure, antéro-externe et postérieure étaient respectivement de 24, 24,8 et 26,3 cm. Le nerf
fibulaire superficiel était visualisé dans 20% des cas et sa branche cutanée dans 56% des cas.
La distance moyenne entre l’aponévromie de la loge antéro-externe et la branche cutanée du
nerf fibulaire superficiel était de 0,6 cm. Nous n’observions aucune lésion nerveuse.
L’aponévrotomie était complète chez l’ensemble des sujets.
Conclusion - A travers notre étude, nous avons montré que cette technique chirurgicale
endoscopique était fiable, sûre et reproductible.
Mots clés : Syndrome des loges – Chirurgie, Décompression chirurgicale, Jambe,
Endoscopie, Effort physique
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
1
/
62
100%