L Traitement antidiabétique et insuffisance cardiaque DOSSIER THÉMATIQUE

16 | La Lettre du Cardiologue Risque Cardiovasculaire • n° 438 - octobre 2010
DOSSIER THÉMATIQUE
Sécurité cardiovasculaire
des antidiabétiques
Traitement antidiabétique
et insuffisance cardiaque
Antidiabetic drugs and heart failure
R. Roussel*
* Service d’endocrinologie diabéto-
logie nutrition, groupe hospitalier
Bichat-Claude-Bernard, Paris.
L
es liens entre insuffisance cardiaque et diabète
de type 2 sont étroits et réciproques. Le risque
d’insuffisance cardiaque chez les patients
diabétiques n’est pas complètement expliqué par
les facteurs de risque connus d’insuffisance cardiaque.
Le diabète, par l’hyperglycémie chronique et sans doute
aussi par d’autres facteurs qui lui sont intimement liés
– comme les anomalies lipidiques caractéristiques du
diabète de type 2 –, induit des transformations struc-
turales et fonctionnelles, notamment énergétiques,
qui peuvent favoriser le développement d’une insuf-
fisance cardiaque. Plusieurs études ont rapporté que
les traitements antidiabétiques eux-mêmes pouvaient
avoir un impact sur les événements liés à l’insuffi-
sance cardiaque : on pense, en particulier mais pas
exclusivement, aux glitazones contre-indiquées chez
les patients à tous les stades de la classification de la
NYHA. D’autres molécules, en particulier l’insuline,
ont également été associées à un surrisque. Ainsi, au
cours de la Framingham Heart Study, l’excès de risque
d’insuffisance cardiaque chez les diabétiques a été
confiné aux patients traités par insuline.
La suspicion concernant l’insuline est cependant loin
d’être systématiquement évoquée : elle a même été
associée (après administration aiguë) à une amélio-
ration de la tolérance à l’effort (1).
Épidémiologie
La prévalence de l’insuffisance cardiaque dans la
population générale est de l’ordre de 1 à 4 % pour
les tranches d’âge les plus élevées. Elle est d’environ
12 % chez les diabétiques, une proportion atteignant
22 % chez les sujets âgés de plus de 65 ans (2, 3).
Malheureusement, ces patients sont souvent exclus
des grands essais cliniques. Réciproquement, la préva-
lence du diabète dans la population générale est de
l’ordre de 4 à 10 %, et elle atteint, selon les études,
10 à 38 % des insuffisants cardiaques symptoma-
tiques (4). Les patients diabétiques sont d’autant plus
à risque de développer une insuffisance cardiaque
qu’ils cumulent les facteurs de risque cardiovasculaire.
Un indice de masse corporelle élevé (+ 2,5 kg/ m²)
augmente le risque d’insuffisance cardiaque de
12 % (5). Les autres facteurs de risque indépen-
dants sont l’âge, les antécédents de complications
micro-angiopathiques (rétinopathie et néphropathie
en particulier, qui s’accompagnent de protéinurie,
voire d’insuffisance rénale), macro-angiopathiques
(antécédents coronariens) et des caractéristiques
du diabète lui-même : une longue durée d’évolution
du diabète et la nécessité d’un recours à l’insuline,
2 aspects très liés, sont également des facteurs de
risque d’insuffisance cardiaque chez le diabétique.
L’hypertension est également un de ces facteurs de
risque indépendants. Elle est très fréquente chez le
diabétique de type 2. Le développement d’une insuf-
fisance cardiaque est un tournant très péjoratif dans
l’évolution de la maladie : dans l’étude DIABHYCAR
(The non-insulin-dependent DIABetes, HYpertension,
microalbuminuria or proteinuria, CARdiovascular
events, and ramipril), qui portait sur des diabétiques de
type 2 micro- ou macro-albuminuriques, le dévelop-
pement d’une insuffisance cardiaque était associé
à une mortalité multipliée par 12 au cours du suivi
(36 % versus 3 % chez les diabétiques ne développant
pas d’insuffisance cardiaque) [6]. Dans une étude
américaine épidémiologique portant sur des patients
diabétiques âgés, la survie à 5 ans après le diagnostic
d’insuffisance cardiaque était inférieure à 15 % alors
qu’elle s’élevait à 80 % chez les sujets ne présentant
pas d’insuffisance cardiaque et appariés par l’âge.
Pourquoi les diabétiques développent-ils fré quemment
une insuffisance cardiaque ?
Plusieurs mécanismes ont été proposés :
➤
De façon générale, les facteurs de risque d’insuffi-
sance cardiaque sont fréquemment observés chez les

La Lettre du Cardiologue Risque Cardiovasculaire • n° 438 - octobre 2010 | 17
Points forts
»
L’insuffisance cardiaque est fréquente chez les diabétiques, et, réciproquement, le diabète constitue un
facteur pronostique péjoratif chez les insuffisants cardiaques.
»
Les glitazones multiplient par un facteur de 1,5 à 2 le risque d’hospitalisation pour insuffisance cardiaque,
mais, selon les données disponibles, pas la mortalité cardiovasculaire.
»
Cet effet secondaire est lié à une rétention hydrosodée sensible aux diurétiques de type amiloride ;
il n’y a pas d’argument en faveur d’une toxicité myocardique directe.
»
La metformine est le seul antidiabétique associé à une réduction du risque d’insuffisance cardiaque, et,
en cas d’antécédent d’insuffisance cardiaque, elle est associée à un meilleur pronostic vital.
»
Ces observations sont essentiellement épidémiologiques, et nécessitent une confirmation dans des
essais randomisés contrôlés.
Mots-clés
Insuffisance cardiaque
Diabète
Traitement
antidiabétique
Effet secondaire
Metformine
Highlights
»
Heart failure is common
among diabetics, and diabetes
is a pejorative prognostic factor.
»
The glitazones multiplied by
a factor of 1,5 to 2 the risk of
hospitalization for heart failure,
without evidence of excess of
cardiovascular mortality.
»
This side effect is related to
a significant sodium and water
retention sensitive to diuretics
like amiloride, there is no argu-
ment for a direct myocardial
toxicity.
»
Metformin is the only anti-
diabetic drug associated with
a reduced risk of heart failure,
and for patients with a history
of heart failure, is associated
with better prognosis.
»
These observations are
essentially epidemiological,
and require confirmation in
randomized controlled trials.
Keywords
Heart failure
Diabetes
Anti-diabetic drug
Side-effect
Metformin
diabétiques, comme l’hypertension, les pathologies
ischémiques, l’obésité, etc.
➤
L’hyperglycémie chronique, mais également
les autres anomalies métaboliques associées à
l’hyperglycémie (hypertriglycéridémie en particulier
postprandiale, élévation des acides gras libres, baisse
de la leptine, etc.) ont probablement un effet direct
sur le myocarde.
➤
Le diabète est associé à des anomalies des
systèmes hormonaux vaso-actifs (activation de la
noradrénaline et de l’endothéline-1), mais aussi à
une activation de cytokines pro-inflammatoires,
dont l’IL-6 ou le TNFα. L’insuffisance cardiaque
présente également ces anomalies, avec cependant
une élévation des concentrations circulantes de ces
marqueurs à des niveaux bien supérieurs, corrélées
au pronostic (7). Or, l’insuline possède des propriétés
anti-inflammatoires (peut-être émoussées dans les
situations d’insulinorésistance) ; cette observation
concorde avec un bénéfice démontré de l’insuline dans
certaines situations de dysfonction cardiaque (1, 8).
Certains traitements antidiabétiques exercent une
toxicité sur le myocarde. Cependant, dans une étude
britannique rétrospective publiée en 2005 (ne portant
que sur les sulfamides, la metformine et l’insuline,
et excluant donc les glitazones), le risque d’insuf-
fisance cardiaque était élevé chez les diabétiques
commençant un traitement (sans différence entre les
différentes classes) seulement la première année, ce
qui suggère que la durée du diabète et la sévérité de
la maladie métabolique étaient les vrais facteurs en
cause, plus que l’aspect thérapeutique lui-même (9).
Enfin, rarement, le diabète et la myocardiopathie
sont deux conséquences d’une même maladie systé-
mique, comme l’hémochromatose.
Impact de la prise en charge
thérapeutique du diabète
sur les insuffisances cardiaques
Quel effet du contrôle glycémique ?
Sur le plan épidémiologique, les patients diabé-
tiques déséquilibrés ont un risque plus important de
développer une insuffisance cardiaque : + 10 à 15 %
par point d’HbA1c supplémentaire. Cette relation
épidémiologique n’a pas pour l’instant trouvé de
prolongement à l’occasion des grands essais d’inten-
sification du traitement antidiabétique : au cours
de l’étude UKPDS (UK Prospective Diabetes Study),
le risque d’insuffisance cardiaque n’a pas été réduit
chez les diabétiques soumis à un contrôle intensif
(7 % d’HbA1c moyenne) par rapport aux sujets
sous traitement conventionnel (7,9 % d’HbA1c
moyenne) [10]. Il s’agissait, il est vrai, de diabétiques
plutôt jeunes, un peu plus de 50 ans à l’inclusion,
dont le diagnostic de diabète était récent. Dans les
essais publiés ces 2 dernières années (ACCORD, VADT
et ADVANCE), le taux d’insuffisance cardiaque n’était
pas non plus affecté par le contrôle glycémique chez
des sujets plus âgés (62 ans dans ACCORD et VADT
et 66 ans dans ADVANCE) dont le diabète évoluait
depuis environ 8 à 10 ans.
Autres interventions thérapeutiques
chez les diabétiques
Bien que cet aspect sorte du cadre de cette mise
au point, il est clair que l’efficacité de l’intensifi-
cation du contrôle tensionnel chez les diabétiques
est acquise : les sujets soumis au contrôle intensif
dans UKPDS présentaient un risque diminué de 56 %
de développer une insuffisance cardiaque. De plus,
dans l’escalade thérapeutique, la généralisation
du recours précoce aux bloqueurs du système
rénine-angiotensine, inhibiteurs de l’enzyme de
conversion et surtout sartans, en particulier chez
les patients présentant une néphropathie diabétique
plus ou moins évoluée, a probablement contribué,
récemment, à limiter l’incidence de l’insuffisance
cardiaque chez les diabétiques.
Traitements pharmacologiques
antidiabétiques
Insuline
L’insulinothérapie a été associée à un risque accru de
décès chez les insuffisants cardiaques de plusieurs
études observationnelles. Au sein de l’essai SAVE

18 | La Lettre du Cardiologue Risque Cardiovasculaire • n° 438 - octobre 2010
Traitement antidiabétique et insuffisance cardiaque
DOSSIER THÉMATIQUE
Sécurité cardiovasculaire
des antidiabétiques
(Survival And Ventricular Enlargement), les sujets
traités par insuline après un infarctus du myocarde
compliqué d’une fraction d’éjection abaissée
avaient un moins bon pronostic (risque ajusté de
décès + 38 %) que les patients recevant d’autres
antidiabétiques (11). Ce résultat a été retrouvé dans
d’autres études, méthodologiquement médiocres
(sous-groupes, absence d’ajustement). En revanche,
aucune augmentation du risque de décès associée
au recours à l’insuline n’a été retrouvée dans la
très vaste analyse des données de patients de
Medicare (12). On peut donc conclure que l’insuline
n’est pas associée à un bénéfice chez les insuffi-
sants cardiaques mais qu’elle n’aggrave pas non
plus le risque de mortalité. On sait aussi qu’elle est
souvent un choix par élimination et/ou échec des
autres options, et que l’absence de traitement n’est
pas une alternative raisonnable.
Sulfamides
Le recours aux sulfamides est très fréquent chez les
diabétiques présentant une insuffisance cardiaque :
chez 1 833 diabétiques canadiens souffrant aussi
d’insuffisance cardiaque, 42 % étaient traités
par sulfamide en monothérapie et 47 % par une
association sulfamide/metformine (13). Les sulfa-
mides hypoglycémiants se lient à un récepteur situé
sur la membrane des cellules bêta du pancréas, SUR,
couplé à un canal potassique, Kir6.2, et induisent
une insulinosécrétion : ils favorisent donc l’hyperin-
sulinisme d’origine endogène, efficace pour réduire
la glycémie dans un contexte d’insulinorésistance.
Ils présentent l’inconvénient d’induire des hypogly-
cémies, l’insulinosécrétion survenant quelle que
soit la glycémie après liaison du sulfamide à son
récepteur. La grande fréquence de leur utilisation
reflète probablement la réticence vis-à-vis du recours
à d’autres hypoglycémiants chez ces patients fragiles
et présentant potentiellement des contre-indications
à d’autres classes, glitazones et biguanides. Chez les
diabétiques récemment diagnostiqués d’UKPDS, les
sujets du bras de traitement initial par sulfamide,
après échec des mesures hygiénodiététiques, ne
présentaient pas une incidence supérieure des
nouveaux cas d’insuffisance cardiaque. Dans une
analyse rétrospective américaine, les sulfamides
étaient au contraire associés à une incidence
inférieure d’insuffisance cardiaque, en comparaison à
l’insuline (− 36 %) [14]. La similitude entre les canaux
potassiques des cellules bêta pancréatiques (les
sulfamides hypoglycémiants les activent, induisant
une dépolarisation) et les canaux potassiques
myocardiques a fait craindre, en particulier avec les
sulfamides les plus anciens (chlorpropamide, gliben-
clamide), un risque accru de troubles du rythme
et de mort subite. Cependant, aucune association
avec la mortalité n’a été observée dans différentes
études rétrospectives de cohortes (12). Enfin, une
autre étude rétrospective de grande taille conduite
en Grande-Bretagne a conclu que les patients en
monothérapie, comparativement à la metformine,
avaient un risque de mortalité significativement
augmenté sous sulfamides de première ou seconde
génération (de + 24 à + 61 %), et un risque d’insuf-
fisance cardiaque congestive augmenté d’environ
25 % sous sulfamide de seconde génération (15). En
France, la quasi-totalité des patients sous sulfamides
reçoit une molécule dite de seconde génération.
Sans distinction de génération, chez des patients
canadiens sous antidiabétique en monothérapie,
les sulfamides à fortes doses étaient associés à un
risque d’insuffisance cardiaque supérieur à celui des
patients sous faibles doses de sulfamides, et à celui
des patients sous metformine. On peut évoquer un
biais de confusion dans ce type d’étude rétrospective,
où la forte dose peut être le reflet de l’ancienneté
et de la sévérité du diabète, mais aucun effet n’était
associé à la metformine à forte dose, comparati-
vement à la faible dose de metformine (16). Globa-
lement, les arguments sont faibles pour affirmer
un effet délétère des sulfamides vis-à-vis du risque
d’insuffisance cardiaque, mais la comparaison avec
la metformine semble favorable à cette dernière.
Glitazones
Les glitazones, ou thiazolidinediones, sont des
ligands de PPAR-γ (Peroxisome Proliferator-Activated
Receptor gamma), un facteur de transcription
exprimé dans le tissu adipeux, mais aussi au niveau
de l’endothélium, des cellules bêta du pancréas et
des macrophages. En ce qui concerne l’effet métabo-
lique recherché, leur cible moléculaire est située
essentiellement au niveau des adipocytes dont ils
stimulent la croissance en modifiant le phénotype
dans un sens métaboliquement plus favorable :
les adipocytes, dont les dépôts augmentent en
situation sous-cutanée et régressent modérément
dans leur localisation abdominale, sont en moyenne
de plus petite taille et ont un profil sécrétoire d’adi-
pocytokines, telle l’adiponectine, plus favorable.
Ils sont plus sensibles à l’action de l’insuline, et,
par l’intermédiaire des adipocytokines, d’autres

La Lettre du Cardiologue Risque Cardiovasculaire • n° 438 - octobre 2010 | 19
DOSSIER THÉMATIQUE
tissus périphériques améliorent leur sensibilité à
l’insuline : le muscle et le foie. Ces traitements sont
donc associés par nature à une prise de poids, un
élément a priori défavorable chez les insuffisants
cardiaques. Cette prise de poids est liée à la crois-
sance adipeuse, mais aussi à la rétention hydrosodée.
La prise de poids moyenne la première année est de
l’ordre de 4 kg, répartis de façon équivalente entre
l’augmentation de la masse grasse et la rétention
hydrosodée. Elle se poursuit au cours des années de
traitement ultérieur à un rythme moins soutenu. Ces
observations sont similaires pour les 2 représentants
de la classe, la pioglitazone et la rosiglitazone. La
traduction clinique de cette rétention hydrosodée
comprend également des œdèmes périphériques
fréquents (de l’ordre de 20 %) et une élévation
des peptides natriurétiques (17). Les mécanismes
à l’origine des œdèmes ne sont pas parfaitement
clairs : une interaction des glitazones avec les trans-
porteurs de sodium au niveau des tubules et des
canaux collecteurs est probable, peut-être également
une augmentation du transport hydroélectrique au
niveau de la muqueuse intestinale. Sur cette base,
et d’après des essais de courte durée, la rétention
hydrosodée associée aux glitazones pourrait être
limitée de façon importante par une coprescription
de diurétiques de type amiloride.
Les grands essais cliniques qui ont évalué l’une ou
l’autre des glitazones par rapport à un placebo, de
même que plusieurs études observationnelles de
grande taille ont indiqué que le risque de décom-
pensation congestive à l’insuffisance cardiaque
(ayant conduit à une hospitalisation avec le
diagnostic d’insuffisance cardiaque congestive)
était presque doublé de façon similaire par l’une
ou l’autre glitazone. Ce risque est-il simplement lié
à une décompensation d’une insuffisance cardiaque
connue ou latente via la rétention hydrosodée, ou les
glitazones ont-elles un effet délétère sur la structure
et la fonction myocardique ? Les arguments expéri-
mentaux, mais surtout les résultats de 2 essais sur
52 semaines, comparant l’un la rosiglitazone à
un sulfamide, le glibenclamide, l’autre la rosigli-
tazone à un placebo chez des patients avec une
insuffisance cardiaque de stade NYHA I ou II,
ont indiqué de façon concordante que les glita-
zones n’étaient pas associées à une altération de
la fraction d’éjection du ventricule gauche ou à
d’autres marqueurs fonctionnels (18, 19). Dans ces
études, le traitement de l’insuffisance cardiaque,
en particulier le recours aux diurétiques, était plus
intense dans les groupes sous glitazone. Un petit
essai comparant le glimépiride, un sulfamide, à la
rosiglitazone pendant 16 semaines chez 12 patients
sous meformine a même suggéré une amélioration
de la fonction diastolique sous glitazone (20). Une
récente analyse a porté sur plus de 20 000 patients
traités par pioglitazone ou rosiglitazone dans 7 essais
randomisés. Elle montrait que, comparativement aux
témoins, les sujets sous glitazone avaient un risque
augmenté de 72 % de décompensation d’insuffisance
cardiaque, une augmentation cependant qui n’était
pas associée à une élévation du risque de mortalité
cardiovasculaire (− 7 %, non significatif). Lors d’une
analyse rétrospective d’un registre américain portant
sur plus de 16 000 patients diabétiques, avec insuf-
fisance cardiaque, les glitazones, comparées à
d’autres traitements non insulinosensibilisateurs
(ni glitazone ni metformine) étaient associées à un
profil cardiovasculaire en demi-teinte : si le risque
de décès dans l’année était diminué de 13 % signi-
ficativement, le risque de réadmission hospitalière
était, lui, augmenté (12). D’autres études, également
observationnelles, chez des vétérans américains ne
relevaient ni ce bénéfice sur la mortalité ni cette
association avec de nouvelles hospitalisations pour
insuffisance cardiaque.
Qu’en est-il lorsque l’insuffisance cardiaque est déjà
connue ? Dans la plupart des essais randomisés,
elle constituait un critère d’exclusion. Une étude,
déjà mentionnée ci-dessus, a comparé la rosigli-
tazone à un placebo pendant 1 an chez 224 patients
au stade I ou II de la NYHA. Hormis les œdèmes,
aucun événement clinique n’était affecté par la
rosiglitazone sur cette période relativement brève.
Dans l’étude PROactive, où la pioglitazone était
comparée à un placebo chez plus de 5 000 diabé-
tiques à haut risque cardiovasculaire, le nombre de
patients traités pour une insuffisance cardiaque à
l’inclusion n’était pas précisé (les sujets des classes II
à IV de la NYHA étaient exclus). Cependant, près
de la moitié des patients avaient un antécédent
d’infarctus du myocarde. L’incidence des hospitali-
sations pour insuffisance cardiaque a été de 6 % sous
pioglitazone, contre 4 % sous placebo (p = 0,007).
La mortalité par insuffisance cardiaque était en
revanche similaire. Des analyses exploratoires
ultérieures ont rapporté que le risque de mortalité
ou de présenter un événement cardiovasculaire
majeur après une première poussée d’insuffisance
cardiaque était inférieur sous pioglitazone. Ces
poussées seraient donc plus fréquentes mais “moins
graves” sous pioglitazone, un argument indirect pour
soutenir un simple effet de rétention (21).
Les arguments sont-ils définitifs pour contre-
indiquer les glitazones chez les insuffisants

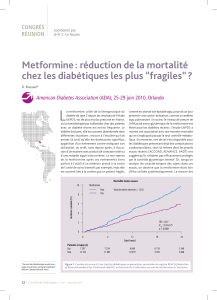
Antécédent
d’insuffisance cardiaque
non
oui
n/N n/N
Yes No HR ajusté p
221/6,002 488/9,120 0,80 p = 0,034
116/1,220 419/2,790 0,69 p = 0,006
0,5 1,0 1,5 2,0
En faveur de
la metformine
P d’interaction : p = 0,39
Metformine
n/N : nombre de décès sur 2 ans/nombre total de patients dans le groupe.
Figure 1. Risque de mortalité associée à la metformine dans le registre REACH pour les
patients diabétiques en prévention secondaire (le taux de mortalité des patients sous
metformine est comparé à celui des patients non traités par la metformine, avec ajuste-
ment sur de multiples facteurs de risque cardiovasculaire et un score de propension lié
à la prescription de metformine, afin de limiter le biais d’indication). La metformine est
globalement associée à une réduction (ajustée) de la mortalité de 24 %, un effet similaire
qu’il y ait ou non un antécédent d’insuffisance cardiaque.
20 | La Lettre du Cardiologue Risque Cardiovasculaire • n° 438 - octobre 2010
Traitement antidiabétique et insuffisance cardiaque
DOSSIER THÉMATIQUE
Sécurité cardiovasculaire
des antidiabétiques
cardiaques ? Cette thérapeutique est associée à
un effet antidiabétique modéré avec une baisse
de l’ordre de 1 à 1,5 % de l’HbA1c à 6 mois. Les
autres bénéfices sont relativement peu consistants :
on sait que la rosiglitazone est sur la sellette en
raison d’un possible risque d’augmentation de l’inci-
dence des infarctus du myocarde – bien que non
définitivement avéré –, alors que la pioglitazone
a été associée en revanche à un possible bénéfice
au regard de la coronaropathie, mais là aussi non
avéré puisqu’il ne s’agissait que d’un critère de
jugement secondaire (22). La balance n’est donc
pas favorable à l’utilisation de ces traitements chez
les insuffisants cardiaques. Toutefois, il est à noter
qu’aucune augmentation de la mortalité totale ou
cardiovasculaire n’a été observée sur l’ensemble des
études ou des méta-analyses. En ce qui concerne la
rétention hydrosodée, les études observationnelles
ont montré que les prescripteurs, maintenant très
bien avertis de ce risque, le géraient en intensifiant
les traitements cardioprotecteurs, en particulier en
recourant facilement aux diurétiques. Les recom-
mandations sont de ne pas utiliser cette classe dès
que le patient est en stade I de la NYHA.
Metformine
La metformine est un traitement antidiabétique
efficace (baisse de l’HbA1c de 1 à 2 %) de la classe
des biguanides, dont elle est le seul représentant.
La phenformine a été utilisée jusque dans les
années 1970 et son retrait a été précipité par son
implication dans plusieurs centaines de cas d’acidose
lactique, une situation dramatique, puisque la
mortalité de cette pathologie est de l’ordre de
50 %. La metformine a hérité de l’aura sulfureuse
de la phenformine, bien qu’elle en diffère sur de
nombreux points : elle ne connaît pas de métabo-
lisme hépatique et est excrétée intacte par le rein.
Augmente-t-elle le risque d’acidose lactique ?
Cela a été admis comme une évidence jusqu’à très
récemment. Les mentalités commencent à évoluer
en raison de plusieurs observations. Elle a été, en
raison du passé de la phenformine, interdite sur
le marché américain jusqu’en 1996. Elle a alors
été réintroduite avec une pharmacovigilance très
active. Cela a fourni l’occasion d’observer si l’inci-
dence des acidoses lactiques chez les diabétiques
augmentait après l’introduction de la metformine :
ni cette étude américaine de pharmacovigilance
ni 2 autres cohortes rétrospectives américaine et
canadienne n’ont mis en évidence un surrisque
associé à la metformine. Un facteur de confusion
vient notamment du fait que le diabète, de par sa
nature et également des comorbidités qui lui sont
fréquemment associées, est un facteur de risque
d’acidose lactique. Par exemple, dans l’étude
américaine, 2,6 % des patients diabétiques non
traités par metformine ont présenté une acidose
lactique, un taux nettement supérieur à celui
d’une population non diabétique. En revanche, la
proportion pour les patients diabétiques traités
par metformine n’était que de 2,3 %, et donc non
significativement différente. Aucune étude ne nous
fournit de données spécifiquement chez les patients
présentant un diabète et une insuffisance cardiaque,
une condition qui suffit à augmenter considéra-
blement le risque d’acidose lactique. Cependant,
nous avons récemment présenté les résultats d’un
registre mettant en évidence une réduction de la
mortalité de 24 % chez les sujets diabétiques du
registre REACH (REduction of Atherothrombosis
for Continued Health) en prévention secondaire
associée à la metformine : cette réduction était
encore plus marquée chez les sujets ayant, en plus
d’un antécédent athérothrombotique, un antécédent
d’insuffisance cardiaque, ce qui suggère que si l’on
ne peut exclure que le risque sous metformine
 6
6
 7
7
1
/
7
100%