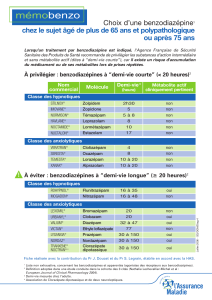
Lire l'article complet

Nonobstant ces interro-
gations essentiellement
méthodologiques, le
médecin peut s’interro-
ger sur l’importance de
ce “syndrome” à
l’échelle de sa pratique
quotidienne : “Plutôt
que de consacrer leur
énergie à des symp-
tômes d’interruption
rares, mineurs et tran-
sitoires, les cliniciens
seraient mieux inspirés
de se concentrer sur les
problèmes bien plus
importants de l’effica-
cité, de la tolérance et
du devenir du patient”
(11). Pour ne se limiter
qu’au seul paramètre
de la demi-vie, quels
sont donc “les pro-
blèmes bien plus
importants” que
d’éventuelles réactions
mineures à l’interrup-
tion de traitement, et
dont il n’a jamais été démontré rigou-
reusement qu’elles étaient plus fré-
quentes sous un agent que sous un
autre ?
En fait, nombre de ces problèmes
(prévision de la réponse, durée de la
rémission, rechute, récidive) sont
malheureusement peu documentés en
dépit de leur importance : certes, ils
ont suscité d’innombrables éditoriaux
ou articles d’opinion mais fort peu
d’études cliniques ou d’investigations
épidémiologiques fiables. Malgré
cette rareté des données solides, le
prescripteur dispose cependant d’une
certaine marge d’action sur certains
paramètres importants de la maladie
dépressive, eux-mêmes plus ou moins
liés à la demi-vie des antidépresseurs
: précocité de la réponse thérapeu-
tique, par exemple, ou sécurité du
patient, ou encore observance.
Obtenir une réponse
le plus rapidement
possible
Quoique chaque lance-
ment d’une spécialité
s’accompagne d’alléga-
tions contraires, dont la
durée de vie est propor-
tionnelle à l’habileté de
l’équipe de marketing
concernée, aucun antidé-
presseur ne peut, à l’heure
actuelle, se voir imputer
un avantage cliniquement
significatif dans la préco-
cité de la réponse ; nous ne
saurions trop recomman-
der au lecteur incertain sur
ce point de se reporter pré-
cisément aux études cli-
niques censées justifier les
allégations contraires et
d’en apprécier tant la vali-
dité méthodologique que
l’extrapolabilité… S’il est
donc illusoire d’imaginer que les proprié-
tés pharmacodynamiques intrinsèques
donnent au prescripteur une marge de
manœuvre pour choisir un produit censé
être plus rapidement actif que d’autres, il
reste néanmoins des paramètres à prendre
en compte qui jouent, au moins indirecte-
ment, sur la précocité de la réponse.
La facilité d’ajustement posologique
Avec un produit à longue demi-vie, l’im-
pact d’une modification de dose sur la
réponse du patient n’est que lentement
déchiffrable. Il est encore plus incertain,
si l’apparition progressive d’un métabolite
154
mise au point
Mise au point
Act. Méd. Int. - Psychiatrie (17) n° 5, mai 2000
Depuis peu, un faux débat s’est constitué sur le risque de
“syndrome d’interruption brutale“ sous inhibiteurs de
la recapture de la sérotonine (IRS). D’un point de vue d’evi-
dence-based medicine, aucune preuve sérieuse n’a été
citée à l’appui de ce concept ; il est flagrant, au contraire,
que la plupart des propos sur la question proviennent
d’éditoriaux ou d’articles parus dans des suppléments de
revues – toutes sources dont les faiblesses méthodologiques
sont connues. De plus, et en se plaçant cette fois d’un point
de vue pharmaco-épidémiologique, des biais majeurs ont
été négligés dans la perception différentielle du risque inhé-
rent aux divers antidépresseurs actuellement sur le marché ;
il est évident, par exemple, que, les choix de prescription
étant fortement déterminés par le niveau d’anxiété du
déprimé (5), il existe un facteur de confusion important
entre l’antidépresseur choisi et le risque d’une résurgence
de symptômes anxieux à l’arrêt du traitement : or, la plu-
part des manifestations cliniques citées à l’appui du
concept de “syndrome” d’interruption brutale ressemblent
à des symptômes anxieux…
Place de la demi-vie
dans le rapport bénéfice/risque des antidépresseurs
M. Girard*
* Versailles.
ACTUALITÉ PSY MAI 2/09/02 15:17 Page 154

155
actif de demi-vie plus prolongée vient
compliquer le tableau : “Une complica-
tion spécifique à la fluoxétine tient à sa
demi-vie extrêmement longue […]. Cela
est vrai pour les interactions non seule-
ment pharmacocinétiques, mais encore
pharmacodynamiques” (15 ; c’est moi
qui souligne). La situation devient quasi-
ment inextricable lorsque le métabolite
actif est supposé exercer un effet inhibi-
teur sur la molécule mère (2, 6). Les dif-
ficultés qui en résultent pour ajuster les
posologies d’un antidépresseur à longue
demi-vie sont bien connues des clini-
ciens (14).
La facilité de substitution
Dans une pathologie où l’on s’attend, en
moyenne, à une réponse insuffisante
chez quelque 30 % des patients, envisa-
ger dès la première prescription une
éventuelle substitution après quelques
semaines ne traduit pas, chez le prescrip-
teur, une névrose d’échec mais un réflexe
sain de bon usage. Or, il est évident que
l’arrêt d’un composé à très longue demi-
vie, avec des métabolites actifs dont l’éli-
mination peut prendre plusieurs
semaines, est susceptible de conduire à
des problèmes aigus en pratique cli-
nique – surtout si le potentiel d’interac-
tions de ce composé interdit, durant toute
cette durée, l’introduction d’un autre
antidépresseur : c’est précisément le cas
de la fluoxétine, dont l’élimination peut
prendre jusqu’à cinq semaines (9, 15), et
dont les interactions, potentiellement
graves avec les tricycliques et les inhibi-
teurs de la monoamine oxydase – fus-
sent-ils sélectifs –, sont parfaitement
documentées (4) (voir ci-dessous).
Diverses publications ont illustré les
situations dramatiques auxquelles peut
conduire la longue demi-vie d’un antidé-
presseur (1, 10).
Devant une telle abondance de données
fondamentales et cliniques validées, on
s’étonne que tant d’attention ait été
accordée récemment au rôle de la demi-
vie dans le problème mineur et médicale-
ment peu significatif du “syndrome”
d’interruption brutale, tandis qu’en
parallèle, on se soit si rarement préoccupé
d’examiner si la demi-vie d’un antidé-
presseur ne devrait pas, en pratique,
constituer un paramètre clé dans le choix
d’un traitement de première intention…
Gérer les risques
Avec un médicament, il est sécurisant de
savoir que le traitement pourra être arrê-
té facilement en cas de nécessité. Cette
exigence tout à fait banale, eu égard au
risque d’effets indésirables ou de patho-
logie intercurrente, se trouve encore
accrue dans une pathologie comme la
dépression, dont les thérapeutiques ont
également le potentiel de provoquer des
réponses paradoxales. Il va de soi qu’il
est d’autant plus facile d’arrêter un traite-
ment en cas d’urgence que sa demi-vie
est brève.
La perspective d’un arrêt motivé par une
complication urgente évoque les traite-
ments correcteurs, rappelant de nouveau
l’hypothèque des interactions : éliminée
beaucoup plus lentement que les autres
inhibiteurs de la recapture de la sérotoni-
ne (IRS) et réputée être l’IRS qui expose
le plus aux interactions cliniquement
significatives, la fluoxétine maximise le
risque de réaction nocive à l’introduc-
tion d’un éventuel traitement correcteur
(14).
Les difficultés susmentionnées d’ajuste-
ment posologique soulèvent la question
d’une éventuelle liaison entre la dose
administrée et la fréquence ou la gravité
des problèmes de tolérance. Bien que
nous n’ayons pas connaissance d’une
investigation systématique sur cette cor-
rélation, on notera que, lors des essais cli-
niques entrepris avec les IRS, le taux de
sorties d’essai semble généralement lié à
la dose (12).
Qu’elle complique l’interruption de trai-
tement ou qu’elle brouille l’ajustement
posologique, une demi-vie longue tendra
plus à compliquer la tâche du prescrip-
teur qu’à la faciliter.
Minimiser les interactions
La lecture des revues consacrées à la
pharmacocinétique des IRS est parfois
trompeuse en ceci qu’elles se concen-
trent souvent sur le potentiel d’inhibition
des divers composés de la classe avec le
système du cytochrome P450. Or, d’une
part, ces données in vitro ne disent pas
grand-chose des phénomènes obser-
vables in vivo, qui dépendent aussi des
métabolites, et moins encore des taux
systémiques effectifs. D’autre part, en
thérapeutique, d’innombrables interac-
tions ont pu être identifiées, qui se limi-
tent généralement à de simples fluctua-
tions pharmacocinétiques sans traduction
clinique évidente : avec les antidépres-
seurs – comme avec bien d’autres médi-
caments – le véritable problème des
interactions tient aux effets indésirables
documentés qui en résultent.
Il n’est que de consulter n’importe quel-
le base de données pour constater que la
fluoxétine apparaît, et de loin, comme
l’IRS ayant suscité le plus grand nombre
de publications rapportant des interac-
tions médicamenteuses médicalement
significatives. Sans prétendre en faire ici
l’inventaire systématique, mentionnons
que des interactions cliniquement symp-
tomatiques – certaines graves, voire
fatales – ont été rapportées avec les tricy-
cliques, les IMAO, le bupropion, le
lithium, la carbamazépine et d’autres
antiépileptiques, la buspirone, les benzo-
diazépines, l’halopéridol et d’autres neu-
roleptiques, les bêtabloquants, les anti-
histaminiques, la warfarine, le
sumatriptan… (nous renvoyons le lecteur
à la base de données Reactions pour une
sélection de références bibliographiques
mise au point
Mise au point
ACTUALITÉ PSY MAI 2/09/02 15:17 Page 155

sur le sujet ; voir également le Tableau ci-
contre). La portée pharmacoépidémiolo-
gique de ces interactions tient au fait qu’un
antidépresseur est souvent destiné au trai-
tement d’un patient recevant d’autres thé-
rapeutiques – et il suffit de penser aux
déprimés avec une pathologie neuropsy-
chiatrique sous-jacente (par exemple,
Parkinson, épilepsie, suites d’accident vas-
culaire cérébral), ou aux sujets gériatriques
chez lesquels, comme chacun sait, la pré-
valence de la dépression est élevée.
Bien que loin d’être exhaustive, la base de
données Reactions (1983-1999) ne repré-
sente qu’une sélection des articles les plus
significatifs concernant la tolérance, parus
dans la littérature internationale. En dépit
du fait que la recherche par mots clés n’est
pas d’une discrimination parfaite, certains
médicaments peuvent être simplement
cités à l’occasion d’une complication
imputable à une autre cause.
L’interrogation de cette base permet un
intéressant pointage, toutes choses égales
par ailleurs. Les résultats de cette interro-
gation appliquée à divers agents de la clas-
se des IRS sont fournis dans le Tableau ci-
contre.
Certes, il convient d’être très prudent
avant d’en induire une fréquence plus éle-
vée sur la base de publications plus fré-
quentes : certains produits ont été plus
consommés que d’autres, l’expérience
après commercialisation est plus longue
pour certains que pour d’autres, il existe,
enfin, des biais de publication plus ou
moins subtils. En d’autres termes, ce n’est
pas nécessairement parce que la fluoxéti-
ne a suscité le plus grand nombre de publi-
cations sur le problème des interactions
qu’elle expose effectivement davantage à
ce risque. Toutefois, deux remarques s’im-
posent à l’esprit lorsque l’on cherche à
apprécier la pertinence des publications
sur le sujet à l’échelle des populations :
– dans une classe, bien souvent, ce ne
sont pas les composés les plus anciens qui
sont les plus exposés au biais de surnoti-
fication, mais plutôt les plus récents ;
– la portée pharmacoépidémiologique
d’une plus grande fréquence d’interac-
tions rapportées se renforce tout de même
lorsque cette plus grande fréquence
observée en clinique, est en accord avec
les prévisions qui pouvaient être faites sur
la base des données fondamentales
(demi-vie, inhibition du cytochrome,
métabolites).
Quoi qu’il en soit, et ce sera notre conclu-
sion sur ce thème, le nombre d’observa-
tions publiées sur les effets cliniquement
significatifs de la fluoxétine et de cette
substance seule (plusieurs centaines)
dépasse le nombre d’observations
publiées de “syndromes” d’interruption
brutale pour l’ensemble des IRS (proba-
blement pas plus d’une trentaine), les-
quels ne font état que d’effets générale-
ment mineurs, voire bénins et
systématiquement régressifs. C’est une
illustration frappante du propos de
Pollock, que nous avons cité en introduc-
tion sur “les problèmes bien plus impor-
tants”, en pratique, que les réactions d’in-
terprétation problématique parfois liées à
l’arrêt d’un IRS.
Optimiser l’observance
Et, puisque nous en sommes à réfléchir sur
les questions de signification clinique,
qu’on nous permette de relever une éton-
nante incohérence du raisonnement qui
entend faire du “syndrome” d’interruption
brutale un important paramètre d’inobser-
vance et d’échec du traitement antidépres-
seur. L’espace d’un raisonnement par l’ab-
surde, admettons que les composés à demi-
vie brève exposent significativement plus
souvent à ce type de “syndrome” que les
composés à demi-vie longue. De deux
situations cliniques antagonistes – un
patient qui arrête indûment son traitement et
qui s’en trouve mal, et un autre qui s’en trou-
ve bien – laquelle verra, le plus probable-
ment, le patient reprendre son médicament ?
La portée de ce raisonnement par l’absur-
de est encore renforcée dans le cadre
d’une indication comme la dépression.
Une analyse récente (8), en effet, identifie
les déterminants suivants de l’observan-
ce : précocité de la réponse, fréquence des
effets indésirables, désir de vérifier, après
quelques mois, la nécessité du traitement
chez les patients qui ont correctement
répondu et qui tendent à faire une “inter-
ruption test”. Confortée par l’expérience
clinique, la constatation que nombre des
déprimés améliorés par leur traitement
tentent une interruption après quelques
mois afin de vérifier s’ils peuvent se pas-
ser de médicament va diamétralement à
l’encontre du beau fantasme sur la longue
demi-vie pour garantir “l’interruption
sans risque” : il est évident, en effet, que
plus une interruption de traitement sera
asymptomatique, plus elle encouragera le
patient à l’inobservance.
N’est-ce pas précisément la symptomato-
logie à l’arrêt qui est généralement invo-
quée pour expliquer la difficulté
qu’éprouvent les anxieux à interrompre
mise au point
Mise au point
Act. Méd. Int. - Psychiatrie (17) n° 5, mai 2000 156
Nombre total Mots clés
Médicament de citations adverse-reactions drug-interactions
fluoxétine 615 230 94
fluvoxamine 173 63 36
paroxétine 201 81 21
sertraline 237 91 22
citalopram 42 11 6
Tableau. Réactions indésirables et interactions médicamenteuses dans la classe des IRS : interro-
gation de la base de données Reactions (1983-1999).
ACTUALITÉ PSY MAI 2/09/02 15:17 Page 156

157
leur benzodiazépine ? Dans sa naïveté
résolument coupée des réalités cliniques,
l’histoire du “syndrome” d’interruption
brutale a été mal construite : il aurait fallu
prétendre que les phénomènes d’interrup-
tion brutale exposaient les patients sous
IRS de demi-vie brève au risque d’une
véritable dépendance ! Mais la cohérence
du raisonnement physiopathologique en
aurait dénoncé plus crûment encore la
discordance d’avec la réalité clinique ou
épidémiologique…
Conclusion
Au terme de la présente analyse et avec le
recul de plusieurs années supplémen-
taires, on ne peut que souscrire à un juge-
ment déjà émis voici longtemps dans le
contexte a priori peu commercial des
revues publiées par le prestigieux New
England Journal of Medicine : “Les don-
nées publiées sur l’effet antidépresseur de
la fluoxétine ne [suffisent] pas à expli-
quer sa popularité.” (7). L’état d’esprit du
présent article, toutefois, n’est pas celui
de la publicité comparative : aux anti-
podes des controverses souvent indi-
gentes alimentées par le marketing des
fabricants, nous sommes surtout intéressé
par l’élargissement de l’éventail théra-
peutique mis à la disposition des prescrip-
teurs. Contrairement à ce qui s’est dit trop
longtemps, le développement du premier
IRS n’a pas débouché sur un antidépres-
seur “miracle” mais a permis – pour la
première fois depuis longtemps dans cette
indication thérapeutique – un très impor-
tant élargissement des options thérapeu-
tiques notamment pour ce qui concernait
la tolérance : contrairement, là encore, à
ce qui s’est trop longtemps dit, la fluoxé-
tine n’est pas un antidépresseur globale-
ment “mieux” toléré que ses compara-
teurs plus anciens, mais cette substance
offrait, pour la première fois, un profil de
tolérance radicalement différent, qui élar-
gissait fort significativement la marge de
manœuvre des prescripteurs en matière
de bénéfices ou de risques attendus avec
leur traitement. Comme classe thérapeu-
tique, ensuite, et par rapport à ce qu’il est
usuel d’observer en pharmacologie, les
IRS témoignent d’une notable hétérogé-
néité, et la plus grande part de cette hété-
rogénéité est en rapport, précisément,
avec les caractéristiques pharmacociné-
tiques très différentes des membres de la
classe (12) : elle contribue, là encore, à la
liberté de choix en matière de prescrip-
tion – et il convient de s’en féliciter. Le
trouble surgit quand, sous des pressions
commerciales par trop évidentes, certains
leaders d’opinion se mettent en tête d’in-
venter des supériorités supposées sur la
base d’arguments peut-être brillants en
surface, mais dont la validité expérimen-
tale et, parfois même, la logique ne résis-
tent pas à un examen approfondi.
Cet article, qui n’avait pas la prétention
d’apporter des données fondamentales
ou cliniques nouvelles, s’est présenté
comme un simple travail de réflexion,
dans le cadre d’une controverse récente
dont l’émergence même semble aberran-
te au terme d’un siècle dont la seconde
moitié a été consacrée à définir des prin-
cipes rigoureux pour la recherche cli-
nique, dans un contexte désormais mar-
qué par les exigences de
l’evidence-based medicine et l’épisté-
mologie critique de la pharmacoépidé-
miologie. Certains lecteurs trouveront
dans les lignes qui précèdent des motifs
de réflexion utiles pour leur pratique.
Quant à ceux qui jugeraient que l’auteur
“y est allé fort” ou qu’il a “poussé le
bouchon un peu loin”, ils y auront au
moins compris que la recherche clinique
opère le plus souvent sur des “données
molles” (3), et qu’avec un peu d’imagi-
nation – sinon de perversité –, on peut
leur faire dire bien des choses : qu’ils
acceptent de s’en souvenir lors de la pro-
chaine controverse sans aucun intérêt
pour la pratique clinique ou la santé
publique…
Références
1. Coplan J.D., Gorman J.M. Detectable levels
of fluoxetine metabolites after discontinuation :
an unexpected serotonin syndrome. Am J
Psychiatry 1993 ; 150 : 837.
2. Fava M., Rappe S.M., Pava J.A. et coll.
Relapse in patients on long-term fluoxetine treat-
ment : response to increased fluoxetine dose. J
Clin Psychiatry 1995 ; 56 : 52-5
3. Feinstein A.R. Clinical biostatistics. II.
Statistics versus science in the design of experi-
ments. Clin Pharmacol Ther 1970; 11: 282-92.
4. Finley P.R. Selective serotonin reuptake inhi-
bitors : pharmacologic profiles and potential
therapeutic distinctions. Ann Pharmacother
1994 ; 28 : 1359-69.
5. Garrision G.D., Levin G.M. Factors affecting
prescribing of the newer antidepressants. Ann
Pharmacotherapy 2000 ; 34: 10-4
6. Goldberg J.F., Kocsis J.H. Relapse during
SSRI treatment for depression. Medscape Mental
Health 1996 ; 1 (11).
7. Gram L.F. Fluoxetine. N Engl J Med 1994 ;
331 : 1354-61.
8. Kaplan E.M. Antidepressant noncompliance
as a factor in the discontinuation syndrome. J
Clin Psychiatry 1997 ; 58 (suppl 7) : 31-6.
9. Leonard B.E. The comparative pharmacology
of new antidepressants. J Clin Psychiatry 1993 ;
54 (8, suppl) : 3-15.
10. MacLeod S., Young B. Fatal serotonin syn-
drome : a report of two cases. Can J Clin
Pharmacol 1995 ; 2 : 131-2.
11. Pollock B.G. Discontinuation symptoms and
SSRIs. J Clin Psychiatry 1998 ; 59 : 535-6.
12. Preskorn S.H. Pharmacokinetics of antide-
pressants : why and how they are relevant to treat-
ment. J Clin Psychiatry 1993 ; 54 (suppl) : 14-34.
13. Preskorn S.H. Antidepressant drug selec-
tion : criteria and options. J Clin Psychiatry
1994 ; 55 (suppl A) : 6-22.
14. Preskorn S.H. Clinically relevant pharmaco-
logy of selective serotonin reuptake inhibitors.
An overview with emphasis on pharmacokinetics
and effects on oxydative drug metabolism. Clin
Pharmacokinet 1997 ; 32 (suppl 1) : 1-21.
15. Van Harten J. Clinical pharmacokinetics of
selective serotonin reuptake inhibitors. Clin
Pharmacokinet 1993 ; 24 : 203-320.
mise au point
Mise au point
ACTUALITÉ PSY MAI 2/09/02 15:17 Page 157
1
/
4
100%