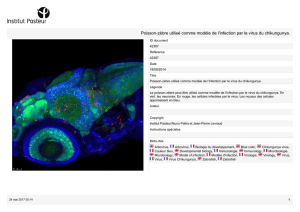
P L’épidémie de Chikungunya à la Réunion (2005-2007) : é

La Lettre de l’Infectiologue - Tome XXII - n° 5 - septembre-octobre 2007
éditorial
éditorial
178
L’épidémie de Chikungunya à la Réunion (2005-2007) :
qu’avons-nous vraiment appris ?
The Reunion Chikungunya outbreak (2005-2007): what have we really learnt?
C. Chastel*
“It’s unclear why the outbreak is so ferocious”.
M. Enserik, Science, 24 février 2006
Pour l’Institut de veille sanitaire, l’île de la Réunion est
entrée en “phase inter-épidémique” depuis le 19 avril
2007. L’issue enfi n favorable d’une épidémie dont
l’ampleur a surpris tout le monde off re la possibilité d’en
dresser un premier bilan.
D’ABORD QUELQUES CHIFFRES
Cette épidémie a provoqué beaucoup de souffrances, un
encombrement hospitalier considérable et des répercussions
graves sur le tourisme local. Depuis mars 2005, plus du
tiers de la population de l’île (environ 780 000 habitants) a
été infecté. Sont apparues des formes graves, inhabituelles,
du système nerveux central (SNC), du foie, des reins, de la
peau, et une soixantaine de cas d’infection materno-fœtale.
On a enregistré 260 décès directement ou indirectement
imputables au virus Chikungunya (CHIK), 898 cas importés
en métropole (1) et au moins 40 dans le reste de l’Europe.
QUE SAVAIT-ON DU VIRUS CHIK
AVANT CETTE ÉPIDÉMIE ?
En réalité, beaucoup de choses (2). Il était connu depuis
1952, en Tanzanie, où il avait provoqué une épidémie rurale
dont le vecteur était Ædes ægypti. Dès son émergence, sa
symptomatologie essentielle était établie : fièvre élevée, algies
diverses, éruption cutanée et arthralgies très invalidantes.
Il fut ensuite isolé hors d’Afrique, en Thaïlande (1960),
au Cambodge (1961) et en Inde (1963). Classé comme
Alphavirus, sa morphologie en microscopie électronique
fut précisée dès 1967. La souche prototype S27 de Tanzanie
fut entièrement séquencée : son génome était constitué de
15 505 nucléotides.
Le virus CHIK fut reconnu responsable d’épidémies plus ou
moins sévères dans toute l’Afrique tropicale, en Asie du Sud-
Est et en Inde. En Afrique de l’Est et au Sénégal, sa survie
dans la nature était assurée par des cycles zoonotiques
sauvages associant des singes (11 espèces) et des moustiques
forestiers (au moins 14 espèces, surtout des Ædes). En Asie,
il était principalement entretenu dans des cycles urbains ou
suburbains associant l’homme et Æ. ægypti.
Sur le plan clinique, sa “bénignité” était toute relative. Les
manifestations articulaires douloureuses pouvaient persister
pendant des semaines, des mois, voire des années (3). Des
atteintes neurologiques étaient connues chez l’enfant, en
Inde, au Cambodge et en Thaïlande. Des myocardites et des
péricardites avaient été décrites en Asie, de même que des
formes hémorragiques chez l’enfant (Inde, Thaïlande), mais
qui n’évoluaient pas vers un choc hypovolémique, comme c’est
le cas pour la dengue hémorragique. Il ne s’agissait sûrement
pas d’un virus “peu connu”, puisque, à la fin de l’année 2005,
pas moins de 506 références concernant ce virus, son pouvoir
pathogène et son épidémiologie étaient accessibles.
DES PATHOLOGIES NOUVELLES ET GRAVES
ÉMERGENT DANS LE SUD-OUEST DE L’OCÉAN INDIEN
Dès septembre 2005, des formes cliniques graves, jamais encore
décrites dans la littérature, furent observées à la Réunion (4-7),
et elles se multiplièrent durant l’acmé de l’épidémie, de fin 2005
aux premiers mois de 2006. Il s’agissait d’atteintes très diverses :
Des formes neurologiques de l’adulte, méningo-encéphalites
ou polyradiculonévrites, peu nombreuses, mais ayant nécessité
constamment une aide respiratoire. Curieusement, dans ces
encéphalites, l’imagerie médicale s’est montrée moins perfor-
mante que l’EEG (4, 6). L’étiologie CHIK de ces atteintes ainsi que
celle des autres formes graves ont été établies grâce à la RT-PCR
et/ou à la recherche des IgM spécifiques, dans le sang et le LCR.
* Laboratoire de virologie, faculté de médecine, 29238 Brest.

La Lettre de l’Infectiologue - Tome XXII - n° 5 - septembre-octobre 2007
éditorial
éditorial
179
Des hépatites graves ou fulminantes survenues dans la
semaine suivant une infection par le virus CHIK. Ces malades
étaient souvent éthyliques, avaient pris du paracétamol
ou des médications locales mal définies. Ils présentaient
des pathologies associées sévères. Tous étaient ictériques.
Cinq décès sont survenus dans les cinq premiers jours de
l’hospitalisation. Sur le plan histologique (8), il s’agissait
d’hépatite nécrosante submassive ou d’une atteinte
parenchymateuse plus limitée. La présence du virus dans le
tissu hépatique a été démontrée par RT-PCR chez deux des
trois malades pour lesquels cette recherche a été effectuée.
Des atteintes cutanées sévères. Chez l’enfant (9), on a
décrit des éruptions bulleuses contemporaines de l’infection à
CHIK, mais aussi de la prise d’ibuprofène ou de paracétamol.
La présence du virus a été démontrée par RT-PCR dans le
liquide bulleux. Ces manifestations pouvaient être associées
à des lésions endobuccales et pouvaient concerner plus de
10 % de la surface corporelle. Elles s’accompagnaient parfois
d’une myocardite ou évoluaient en décollements étendus. La
pathogénie de ces dermatoses bulleuses reste à préciser (9).
Chez l’adulte, des lésions cutanées ont été observées dans
près de la moitié des cas (10). Il pouvait s’agir d’un classique
exanthème du tronc et des membres, parfois œdémateux,
souvent associé à du prurit. De rares cas de décollement
cutané et des séquelles dyschromiques (hyperpigmentation
localisée) ont été signalés.
Le problème de la transmission materno-fœtale du
virus. C’est l’une des grandes révélations de l’épidémie de
la Réunion, de tels phénomènes impliquant des Alphavirus
étant très rares et n’ayant été décrits qu’avec les virus Ross
River ou ceux des encéphalites équines américaines (WEE,
VEE).
Deux types d’observations ont été faites. Chez des femmes
dont la grossesse s’est terminée avant la 22e semaine
d’aménorrhée, l’origine de l’arrêt de la grossesse était
imputable au virus CHIK, celui-ci ayant été mis en évidence
dans le liquide amniotique, le placenta ou le cerveau des fœtus
(11). Chez d’autres femmes dont la grossesse s’est terminée
après la 22e semaine d’aménorrhée et qui étaient virémiques
au moment de l’accouchement, certains nouveau-nés
présentaient un tableau franc d’infection par le virus CHIK,
confirmé par la virologie. Cette infection est apparue entre le
troisième et le septième jour suivant la naissance ; elle était
caractérisée par de la fièvre (inconstante), une prostration
douloureuse, l’impossibilité de téter, un exanthème
maculo-papuleux et un œdème des extrémités. Elle a pu se
compliquer de convulsions, d’une thrombopénie sévère ou
d’une coagulation intravasculaire disséminée (CIVD) [12].
Des décès plus ou moins rattachables au virus. Un
total de 260 certificats de décès mentionnant le virus CHIK
comme cause du décès (6) a été établi, notamment pendant
la phase la plus marquée de l’épidémie. Si dans quelques cas,
peu nombreux (des enfants sans antécédents pathologiques
reconnus), un rôle direct du virus CHIK peut être retenu,
dans l’immense majorité des autres cas, seul un rôle indirect
peut être avancé. En effet, il s’agit de personnes âgées, voire
très âgées, plus ou moins dépendantes, présentant des
pathologies associées très lourdes (respiratoires, cardiaques,
hépatiques, rénales ou endocriniennes) que l’infection virale
a pu décompenser, comme c’est le cas en métropole lorsque
la grippe sévit. Il n’y a pratiquement pas eu d’autopsies (8).
Cependant, une surmortalité générale a été observée dans
l’île durant les 4 premiers mois de 2006 (13), bien corrélée à
l’acmé de l’épidémie, ce qui est en faveur d’un rôle indirect
du virus.
Les aspects pathologiques des infections CHIK
importées en métropole. À Paris, à l’hôpital de la Pitié-
Salpêtrière, 22 malades adultes, de retour d’un séjour à la
Réunion, aux Comores ou à l’île Maurice, chez lesquels le
diagnostic CHIK a été confirmé par immunocapture ELISA,
ont fait l’objet d’investigations cliniques et biologiques (14).
L’âge moyen était de 47 ans (extrêmes : 25-72 ans), avec
une nette prédominance féminine. Tous ont présenté de la
fièvre et des arthralgies (poignets, chevilles, genoux) pouvant
persister plus d’un mois. Thrombopénie et élévations des
transaminases sériques furent fréquemment décelées :
dans 50 % et 57 % des cas, respectivement. Un exanthème
maculo-papuleux, parfois prurigineux, était présent
chez 77 % des patients, siégeant sur l’abdomen, le tronc,
la région lombaire et les membres, mais il n’y avait pas
d’éruptions bulleuses ou de décollements cutanés. Aucune
des formes cliniques graves décrites à la Réunion n’a été
observée, mais l’effectif est faible. Néanmoins, des facteurs
socioculturels, iatrogéniques et de terrain fragilisé ont pu
jouer un rôle majeur dans la pathogénie de ces tableaux
cliniques inhabituels.
À Marseille, à l’HIA Laveran et à l’hôpital Nord, 47 malades
ont été suivis après leur retour du sud-ouest de l’Océan
indien, entre février 2005 et avril 2007, leur infection à CHIK
étant confirmée par la sérologie, la RT-PCR ou une culture
virale en cellules Vero E6 (15). Un exanthème maculo-
papuleux a été trouvé dans 95,7 % des cas, et la fièvre était
présente lors de la première semaine d’évolution chez 53 %
des patients. L’âge moyen était de 45,1 ans et le sex-ratio
équilibré. Huit malades furent hospitalisés, dont deux pour
une forme grave de la maladie, mettant en jeu le pronostic
vital (septicémie à Gram négatif, myocardite). Des arthralgies

La Lettre de l’Infectiologue - Tome XXII - n° 5 - septembre-octobre 2007
éditorial
éditorial
180
persistant au-delà de 10 jours furent notées chez 38 malades,
limitant considérablement leurs possibilités de déplacement
ou leurs activités journalières. L’IRM a permis d’apporter
des informations originales sur la nature et la localisation
anatomique de ces lésions rhumatismales. Le traitement, à
base d’antalgiques et d’anti-inflammatoires non stéroïdiens,
est seulement suspensif.
Sans le secours d’un laboratoire de virologie spécialisé, il est
impossible de distinguer les manifestations habituelles des
infections provoquées par le virus CHIK ou par les virus de la
dengue des arboviroses souvent endémiques dans les mêmes
régions du globe (14, 15).
QUEL CHEMINEMENT GÉOGRAPHIQUE
POUR LE VIRUS CHIK
ENTRE 2004 ET 2007 ?
Les données épidémiologiques recueillies en Afrique de l’Est,
les informations fournies par la surveillance satellitaire (16,
17) et les travaux d’épidémiologie moléculaire réalisés en
France, au Kenya, à Hong Kong et aux États-Unis (18-25)
permettent de suivre le virus dans son expansion temporo-
spatiale. Probablement échappé d’un cycle zoonotique
sauvage de l’Afrique de l’Est, il a provoqué des épidémies
urbaines sur la côte du Kenya, à Lamu (juin-juillet 2004), puis
à Mombasa (novembre 2004). De là, il a gagné la République
islamique des Comores (fin janvier 2005), puis l’île Maurice
et la Réunion (mars 2005), Mayotte (avril 2005) et enfin
les Seychelles et Madagascar. D’octobre 2005 à mars 2006,
il s’est propagé dans l’Inde du Sud et du Centre. De 1,3 à
1,8 million de personnes ont été touchées, parmi lesquelles
plusieurs sont décédées à la suite d’une défaillance rénale ou
d’une encéphalite (26, 27). En même temps, le trafic aérien
international a largement contribué à la diffusion du virus
sur une partie de la planète – de la Guyane française à Hong
Kong –, notre pays détenant le record du nombre de cas
importés (1).
COMMENT EXPLIQUER CETTE ÉPIDÉMIE,
SON EXTENSION EXPLOSIVE
ET SA GRAVITÉ À LA RÉUNION ?
Ce sont des facteurs climatiques (16, 17) qui auraient permis
la réémergence du virus CHIK à Lamu et à Mombasa. Cette
région côtière du Kenya aurait subi en 2004 une sécheresse
sans précédent, ce qui aurait entraîné un stockage de l’eau
dans de mauvaises conditions, la prolifération d’Æ. ægypti et
la dérivation du virus vers l’homme. Ensuite, les déplacements
à l’intérieur de la communauté comorienne régionale ont
assuré la diffusion du virus vers les Comores et les autres îles,
l’avion jouant un rôle essentiel. Enfin, sur l’île de la Réunion,
plusieurs facteurs anthropiques ont conjugué leurs effets
pour assurer le succès émergent du virus CHIK :
l’absence totale d’immunité de la population face à un
virus n’ayant jamais été actif dans cette région du monde ;
la mise en évidence dans les souches virales isolées au
cours de l’épidémie d’une mutation originale (A 226V)
intéressant la glycoprotéine de surface E1. Cette mutation
était absente au début de l’épidémie, mais présente chez
plus de 90 % des isolats viraux, à partir de septembre 2005.
Elle aurait permis une meilleure adaptation des virus au
vecteur local Ædes albopictus, augmentant ses capacités
vectorielles (19). D’ailleurs, le virus CHIK a été isolé de lots de
ce moustique récoltés à la Réunion (21) ;
l’abondance à la Réunion de ce vecteur considéré
a priori comme peu efficace (28), tandis que Æ. ægypti
y avait pratiquement disparu depuis les campagnes de
démoustication réalisées contre le paludisme. Æ. albopictus
est une espèce très agressive, d’une grande plasticité, qui peut
se nourrir aussi bien sur l’homme que sur les animaux, et
qui a profité des multiples gîtes favorables que lui apportait
la population : vasques des cimetières, plantes domestiques,
végétation luxuriante non élaguée, déchets domestiques
multiples ;
un retard évident dans la prise de conscience des
autorités sanitaires, locales et nationales, de la gravité de la
situation. Ce fut en particulier le cas pour le lancement trop
tardif de campagnes de démoustication très médiatisées, à
base d’insecticides toxiques, mal acceptées par une population
dont 60 % étaient persuadés que les moustiques n’étaient pour
rien dans l’épidémie. Il aurait fallu s’attaquer au vecteur dès
la fin de la première vague épidémique de 2005, au moment
où, avec l’arrivée de l’hiver austral, la transmission était
devenue très faible. Espérant naïvement que l’hiver suffirait
à résoudre le problème, on a malheureusement attendu
l’acmé de la deuxième poussée épidémique, explosive et très
virulente, du début 2006 pour songer enfin sérieusement à
organiser une véritable lutte antivectorielle. Il était trop
tard, le vecteur ayant à nouveau massivement proliféré, et
la masse de virus en circulation était devenue incontrôlable
(2). Bref, une accumulation de facteurs écoclimatiques,
entomologiques, virologiques et, surtout, humains, favorables
à l’épidémisation de la maladie.

La Lettre de l’Infectiologue - Tome XXII - n° 5 - septembre-octobre 2007
éditorial
éditorial
181
POUR L’AVENIR, PLUS D’INQUIÉTUDES
QUE DE CERTITUDES
En quelques années, le virus CHIK est devenu un pathogène
de premier plan, pantrope et capable de tuer. Cette évolution
défavorable doit beaucoup à des facteurs anthropiques
aggravés par des changements climatiques profonds en
Afrique de l’Est. Pour le moment, l’épidémie s’est arrêtée à la
Réunion, mais un cas importé de Madagascar y a récemment
été enregistré (InVS, 30 juin 2007). L’île n’est pas à l’abri
d’autres intrusions, et le virus a également pu s’installer dans
quelque réservoir animal, primate sauvage ou moustique, de
la région, attendant son heure. Il a réémergé en avril dernier
aux Seychelles et, surtout, il est apparu au Gabon, début juin,
le nombre de cas passant en trois semaines de 5 000 à 14 000.
Il peut à tout moment s’exporter dans d’autres régions
du monde où sont installés Æ. ægypti ou Æ. albopictus, y
compris le bassin méditerranéen et le Sud de la France pour
ce dernier moustique (18).
Une surveillance épidémiologique à l’échelle mondiale
s’impose, éventuellement aidée par des moyens satellitaires
puissants. En France, la dengue et les infections à virus CHIK
sont enfin inscrites sur la liste des maladies à déclaration
obligatoire. Soyons vigilants ! ■
RéféRences bibliogRaphiques
1. InVS. Cas de Chikungunya importés en métropole durant l’épidémie à la
Réunion. Bilan de la surveillance à partir des données de laboratoire : 1er avril
2005-31 janvier 2007. (Point au 22 mars 2007). 1-7.
2. Chastel C. Chikungunya : de l’ombre à la lumière en 50 ans. Med Trop 2006;
66:360.
3. Brighton SW, Prozesky AW, de La Harpe AL. Chikungunya virus infection: a
retrospective study of 107 cases. S Afr Med J 1983;63:313-5.
4. Martinet O, Winer A, Reboux AH, Blanchet E, Gaüzère BA. Infection à Chikun-
gunya : formes graves en réanimation. Med Mal Infect 2006;36:S52-S54.
5. Paganin F, Borgherini G, Straikowsky F. Chikungunya à l’île de la Réunion :
chronique d’une épidémie annoncée. Presse Med 2006;35:641-6.
6. Gaüzère BA, Martinet O, Reboux AH, Lebrun G, Jarrar-Bandjee MC. Infec-
tion due au Chikungunya à la Réunion : formes graves “émergentes” de l’adulte
en service de réanimation du centre hospitalier départemental de Saint-Denis,
de mai 2005 à mai 2006. Bull Soc Path Exot 2007;100:158-60.
7. Pialoux G, Gaüzère BA, Jauréguiberry S, Strobel M. Chikungunya, an epide-
mic arbovirosis. Lancet Infect Dis 2007;7:319-27.
8. Huerre M, Michot L, Barbara G et al. Chikungunya : données anatomo-
pathologiques. Bull Soc Path Exot 2007;100:160-1.
9. Herbin G, Robin S. Exanthème bulleux chez l’enfant: toxidermie aux AINS ou
Chikungunya. La Lettre de l’Infectiologue 2006;21:139.
10. Talarmin F, Staïkowsky F, Schoenlaub P et al. Manifestations cutanéo-
muqueuses de l’infection par le virus Chikungunya chez l’adulte à la Réunion.
Med Trop 2007;67:167-73.
11. Lenglet Y, Barau G, Robillard PY et al. Infection à Chikungunya chez la
femme enceinte et risque de transmission materno-fœtale. J Gynecol Obstet Biol
Reprod 2006;35:378-83.
12. Touret Y, Randrianaivo H, Michault A et al. Transmission materno-fœtale
précoce du virus Chikungunya. Presse Med 2006;35:1656-8.
13. Josseran L, Paquet C, Zehgnoun A et al. Chikungunya disease outbreak,
Reunion Island. Emerg Infect Dis 2006;12:1994-5.
14. Hochedez P, Jaureguibery S, Debruyne M et al. Chikungunya infection in
travelers. Emerg Infect Dis 2006;12:1565-7.
15. Simon F, Parola P, Grandodam M et al. Chikungunya infection: An emerging
rheumatism among travelers returned from Indian Ocean Islands. Report of
47 cases. Medicine 2007;86:123-37.
16. Epstein PR. Chikungunya fever resurgence and global warming. Am J Trop
Med Hyg 2007;76:403-4.
17. Chretien JP, Anyamba A, Bedno SA et al. Drought-associated Chikungunya
emergence along costal East Africa. Am J Trop Med Hyg 2007;76:405-7.
18. Parola P, de Lamballerie X, Jourdan J et al. Novel Chikungunya virus
variant in travelers returning from Indian Ocean Islands. Emerg Infect Dis
2006;12:1493-9.
19. Schuff enecker I, Iteman I, Michault A et al. Genome microevolution of
Chikungunya viruses causing the Indian Ocean outbreak. PLOS Medicine
2006;3:1058-70.
20. Yergolkar P, Tandale BV, Arankole VA et al. Chikungunya outbreaks caused
by African genotype. India Emerg Infect Dis 2006;12:1580-3.
21. Bessaud M, Peyrefi tte CN, Pastorino BAM et al. Chikungunya virus strains,
Reunion Island outbreak. Emerg Infect Dis 2006;12:1604-6.
22. Lee N, Wong CK, Lam WY et al. Chikungunya fever, Hong Kong. Emerg
Infect Dis 2006;12:1790-2.
23. Lanciotti RS, Kosoy OL, Laven JJ et al. Chikungunya virus in US travelers
returning from India. Emerg Infect Dis 2007;13:764-7.
24. Charrel RN, de Lamballerie X, Raoult D. Chikungunya outbreaks – e
globalization of vectorborne diseases. N Engl J Med 2007;356:769-71.
25. Brisse S, Iterman I, Schuff enecker I. Chikungunya outbreaks. N Engl Med
2007;356:2650.
26. Mudur G. Failure to control mosquitoes has led to two fever epidemics in
India. Brit Med J 2006;333:773.
27. Ravi V. Re-emergence of Chikungunya virus in India. Indian J Med Microbiol
2006;24:83-4.
28. Reiter P, Fontenille D, Paupy C. Ædes albopictus as an epidemic vector of
Chikungunya virus: another emerging problem? Lancet Infect Dis 2006;6:463-4.
1
/
4
100%