LA CHIMIOTHÉRAPIE DE PREMIÈRE LIGNE DU CANCER COLORECTAL MÉTASTATIQUE

LA CHIMIOTHÉRAPIE DE PREMIÈRE LIGNE
DU CANCER COLORECTAL MÉTASTATIQUE
DOIT-ELLE ÊTRE AGRESSIVE ?
POUR (d’après J.L. Misset)
En préambule, le Pr Misset revient sur le terme de chimiothé-
rapie agressive, en signalant qu’il s’agit non pas d’administrer
des traitements vécus comme une agression par les patients,
mais d’employer une chimiothérapie optimale dès la première
ligne de traitement, impliquant un bénéfice en termes de qua-
lité de vie et de survie. C’est maintenant possible grâce au déve-
loppement de nouveaux traitements efficaces dans le cancer
colorectal.
Sur la base d’études datant du début des années 90, l’intérêt de
commencer une chimiothérapie systémique dès le diagnostic de
la maladie métastatique plutôt que de mettre en route le traite-
ment lors de l’apparition des symptômes est admis. Cela a en
effet un impact en termes non seulement de taux de réponse, mais
également de survie globale et de survie sans symptômes (1, 2).
La chimiothérapie considérée comme optimale devrait être celle
qui entraîne le plus fort taux de réponse, celui-ci étant corrélé à
une augmentation de la survie (3). Le taux de réponse dépend des
drogues et des doses administrées à chaque cycle. L’exemple cité
est celui de la chronomodulation, où le taux de réponse passe de
10 à 40 % lorsque la dose-intensité de 5-FU passe de 1 500 à
1800 mg/m2/semaine pour un schéma 5-FU/acide folinique, et
de 30 à 67 % lorsque la dose-intensité de 5-FU passe de 800 à
1400 mg/m2/semaine pour un schéma 5-FU/acide folinique +
oxaliplatine. Il s’agit donc de déterminer la dose optimale, mais
également le mode d’administration et les traitements les plus
efficaces. L’efficacité de l’oxaliplatine en association à un schéma
5-FU/acide folinique a été démontrée en première ligne méta-
statique au travers de deux études de phase III. Un essai rapporte
un taux de réponse de 53 % dans le bras avec oxaliplatine admi-
nistrée en perfusion de 6 heures et 5-FU/acide folinique chrono-
modulé contre 16 % dans le bras 5-FU/acide folinique chrono-
modulé seul (p < 0,001), et une augmentation de la survie sans
progression (médiane 8,7 mois vs 6,1 mois, respectivement,
p=0,048) en faveur du bras oxaliplatine (4). La survie globale
n’est pas significativement différente dans les deux bras (19,9 vs
19,4 mois), mais il faut signaler que les cross-over étaient auto-
risés (57 % des patients).
La deuxième étude a comparé le schéma LV5FU2 au même
schéma, auquel était ajouté l’oxaliplatine (5). Le taux de ré-
ponse est de 50,7 % dans le bras avec oxaliplatine contre 22,3 %
dans le bras contrôle (p = 0,0001). La différence de survie sans
progression est également en faveur du bras avec oxaliplatine
(9 vs 6,2 mois, p = 0,0001). En revanche, la survie médiane
n’est pas significativement différente entre les deux bras (16,2
vs 14,7 mois). Cependant, l’analyse des résultats atteste que
l’adjonction d’oxaliplatine au schéma LV5FU2 en première ligne
thérapeutique est un facteur pronostique d’augmentation signifi-
cative de la survie (p = 0,0001), indépendamment de la chimio-
thérapie reçue en deuxième ligne (oxaliplatine ou CPT11) (6).
Un autre argument en faveur de l’administration d’emblée du
traitement le plus efficace repose sur l’analyse de la qualité de
vie. Que ce soit avec le 5-FU, le CPT11 ou l’oxaliplatine, un
taux de réponse élevé est associé à une meilleure qualité de vie.
Pour le 5-FU, deux études mettent en évidence un bénéfice en
médiane de survie sans symptômes dans le bras traité par 5-FU
par rapport au groupe contrôle traité par soins de confort (1, 7).
Un essai de phase III a démontré une augmentation de survie
globale et de qualité de vie chez des patients traités en deuxième
ligne par CPT11, comparés à un groupe de patients recevant un
traitement symptomatique seul (8). L’analyse des données de
l’étude LV5FU2 versus LV5FU2 + oxaliplatine en première
ligne métastatique montre une qualité de vie globale identique
pour les deux bras, mais une durée de survie sans progression et
sans détérioration de la qualité de vie significativement allon-
gée pour le bras avec oxaliplatine (9).
Chez les patients symptomatiques pour qui le soulagement est
une urgence, la chimiothérapie la plus efficace d’emblée est éga-
lement indiquée. Ceci s’adresse notamment aux patients souf-
frant de volumineuses masses tumorales, d’une occlusion intes-
tinale ou d’une carcinose péritonéale.
Le concept de chimiothérapie optimale en première ligne
s’intègre dans une démarche multidisciplinaire, à savoir une
concertation entre le médecin et le chirurgien. L’expérience de
l’hôpital Paul-Brousse réalisée chez des patients ayant des méta-
stases hépatiques exclusives non résécables d’emblée est rap-
CONGRÈS
10
La Lettre du Cancérologue - Volume IX - no1 - février 2000
Oxaliplatine dans les cancers digestifs : acquisitions
récentes et nouvelles stratégies
EORTC-FFCD, jeudi 24 juin 1999
●
C. Tournigand*
* Hôpital Saint-Antoine, Paris.

portée. Cent cinquante et un patients ont reçu une chimiothé-
rapie par 5-FU, acide folinique et oxaliplatine d’emblée (10).
Cinquante et un pour cent d’entre eux ont été opérés et 38 %
ont bénéficié d’une résection tumorale complète, incluant quatre
réponses complètes pathologiques. Le taux de survie à cinq ans
des patients ayant bénéficié d’une résection secondaire des
métastases à visée curatrice est de 50 %. L’analyse multivariée
des facteurs prédictifs de résécabilité montre que les deux fac-
teurs indépendants sont le pourcentage d’envahissement hépa-
tique initial ( 25 % ou > 25 %) et la réponse maximale à la
chimiothérapie.
Instaurer un traitement de première ligne le plus efficace pos-
sible vise à obtenir le taux de réponse le plus élevé. Même si la
corrélation entre taux de réponse et survie n’est pas retrouvée
dans l’ensemble des études, un des deux essais administrant une
combinaison 5-FU/acide folinique et CPT11 en première ligne
montre une augmentation de la médiane de survie. De même,
l’“Extended Access Program”, reprenant les données des patients
traités par oxaliplatine, montre qu’il existe un parallèle entre le
taux de réponse, le temps jusqu’à progression et la survie glo-
bale lorsque l’on compare les différents schémas d’administra-
tion de l’oxaliplatine ou du 5-FU (11). Les modèles statistiques
permettent également d’établir une corrélation entre le taux de
réponse et la survie (3).
Enfin, le dernier argument présenté est plus général et pro-
vient de l’expérience acquise dans les autres localisations
tumorales. En effet, au long cours, l’intérêt de réserver les
drogues les plus actives pour la rechute ou la progression
n’a jamais fait ses preuves. Pour le cancer colorectal méta-
statique, il semble donc préférable aujourd’hui de débuter
d’emblée par le schéma thérapeutique ayant la plus forte acti-
vité antitumorale.
CONTRE (d’après D. Cunningham)
Il convient dans un premier temps de définir ce que l’on
entend par chimiothérapie agressive. Il s’agit d’une association
de drogues administrées d’emblée selon un schéma recherchant
un maximum d’efficacité initiale. Quels objectifs cherche-t-on à
atteindre pour les patients traités en première ligne ? Augmenter
la survie, améliorer la qualité de vie et pallier les symptômes chez
la majeure partie des malades ou augmenter les chances de sur-
vie à long terme chez quelques patients seulement ? La solution
repose sur l’identification des patients susceptibles de bénéficier
d’un traitement agressif. Un traitement séquentiel peut présenter
de nombreux avantages : cette attitude thérapeutique permet de
réduire la toxicité et de réserver des traitements de deuxième ligne
efficaces. D’autre part, la chimiothérapie séquentielle pré-
serve la chimiosensibilité des cellules tumorales. Les inconvé-
nients sont notamment la prolongation du temps de traitement des
patients, le faible taux de réponses complètes et la faible propor-
tion de patients chez qui on peut envisager une métastasectomie.
Afin d’étudier l’impact des chimiothérapies de deuxième ou troi-
sième ligne, Sobrero a évalué dans le cadre d’une étude rando-
misée les taux de contrôle tumoral (réponse complète + réponse
partielle + stabilisation) du groupe contrôle (traité par 5-FU et
méthotrexate) et du groupe expérimental (traité par 5-FU/ métho-
trexate en alternance avec 5-FU/acide folinique), en première
ligne puis au cours des deuxième et troisième lignes de traite-
ment (12). Alors que le taux de contrôle tumoral en première
ligne est supérieur dans le bras expérimental, les résultats sont
inversés en deuxième et en troisième ligne, la survie globale étant
identique entre les deux groupes de patients. L’utilisation séquen-
tielle de différents agents anticancéreux pourrait donc être aussi
efficace que leur administration d’emblée en association.
SYNTHÈSE (d’après P. Rougier)
Le choix thérapeutique en première ligne de chimiothérapie du
cancer colorectal métastatique soulève trois interrogations. La
première est l’évaluation du rapport entre le taux de réponse à la
chimiothérapie et le bénéfice pour le patient : un taux de réponse
élevé aura-t-il un impact en termes de survie pour le patient, et
quelle est la proportion de patients dont la première ligne est un
échec en raison d’une chimiothérapie trop peu agressive? La
deuxième est la prise en compte de l’efficacité des deuxièmes
lignes de chimiothérapie, après échec du 5-FU à fortes doses ;
par exemple : est-on capable de compenser un premier traitement
peu actif par une deuxième ligne plus efficace ? La troisième
concerne le profil des patients à qui l’on propose une chimio-
thérapie : existe-t-il des critères d’âge, d’état général, de fonc-
tions rénale, hépatique ou médullaire ?
Arguments pour un traitement d’emblée agressif
En termes de survie globale, il a été montré que la chimiothéra-
pie est un facteur pronostique significatif de la réponse au trai-
tement et de la survie. Par ailleurs, par rapport à un traitement
5-FU/acide folinique, les études de première ligne montrent une
augmentation de la survie globale chez les patients recevant un
traitement associant 5-FU/acide folinique et oxaliplatine (16,2
versus 14,7 mois – non significatif) (5) ou 5-FU et CPT11 (16,8
versus 14 mois ; p = 0,03) (13). Enfin, un des intérêts d’une chi-
miothérapie agressive en première ligne est de pouvoir rendre
opérables des patients métastatiques inopérables d’emblée : c’est
le cas chez 16 % des patients ayant reçu un schéma chronomo-
dulé de 5-FU/acide folinique + oxaliplatine, entraînant une sur-
vie à 3 et 5 ans de 54 % et 40 % respectivement (14).
Le taux de réponse, pris souvent comme critère d’efficacité d’une
chimiothérapie, est-il lié à un bénéfice clinique pour le patient ?
Les données de la littérature montrent qu’une réponse objective
est liée non seulement à une amélioration des symptômes (15),
mais également à une augmentation de la survie sans progression
et de la survie globale (3), cela sans détérioration de la qualité de
vie (9). Les molécules actuellement à notre disposition sont
actives en deuxième ligne, après échec d’un traitement par 5-FU.
Cependant, seuls 30 à 50 % des patients reçoivent une chimio-
thérapie de deuxième ligne. Quelle aurait été l’évolution des 50
à 70 % des patients non traités en deuxième ligne s’ils avaient
reçu une chimiothérapie agressive d’emblée ?
Arguments contre un traitement d’emblée agressif
Si le critère essentiel d’évaluation des traitements repose sur le
taux de réponse objective, la stabilisation tumorale peut égale-
ment avoir un effet symptomatique, retrouvé chez 64 % des
11
La Lettre du Cancérologue - Volume IX - no1 - février 2000

patients dans une étude de phase III (15). Le contrôle tumoral a aussi
un impact sur la survie sans progression et la survie globale (16).
Chez les patients traités par 5-FU continu en première ligne, seuls
20 % sont en situation d’échec précoce. Enfin, même si une chi-
miothérapie agressive en première ligne peut permettre une résec-
tion des métastases et une augmentation de la survie, cette straté-
gie ne s’adresse qu’à une faible proportion de patients, évaluée
à 3 à 5 % de ceux inclus dans les essais prospectifs randomisés.
Après un échec du 5-FU en première ligne, l’impact du CPT11
en deuxième ligne sur la survie et la qualité de vie a été claire-
ment démontré par deux essais randomisés publiés récemment.
Le CPT11 comparé à un traitement symptomatique augmente de
22,4 % la survie à un an, et de 13% à un an comparé à du 5-FU
continu (8, 17). D’autre part, l’efficacité des traitements de
deuxième ligne peut éventuellement expliquer l’absence de dif-
férence de survie significative entre deux traitements de première
ligne, comme c’est le cas dans l’essai comparant LV5FU2 et
LV5FU2 + oxaliplatine, pour lequel 33,8 % des patients ont reçu
de l’oxaliplatine ou du CPT11 en deuxième ligne.
Enfin, la chimiothérapie n’est pas le seul facteur pronostique qui
influence la survie. L’indice de performance, le nombre de sites
envahis, le pourcentage d’envahissement hépatique sont autant
de facteurs pronostiques qui entrent en ligne de compte, et sont
souvent plus importants que le type de chimiothérapie initial. Les
patients âgés, quant à eux, constituent une population chez
laquelle le 5-FU a une activité antitumorale, mais parfois au prix
d’une toxicité plus marquée. Ils sont en outre généralement moins
demandeurs de traitements intensifs.
En conclusion, les patients de moins de 70 ans, en bon état géné-
ral (EG 0-1), avec une fonction hépatique normale, peuvent béné-
ficier d’une chimiothérapie agressive permettant une améliora-
tion des symptômes, du contrôle tumoral et un allongement du
temps jusqu’à progression. En cas de réponse tumorale, un geste
chirurgical doit être discuté. Chez les patients âgés et/ou ayant
une altération de l’état général, un schéma de 5-FU administré
de façon optimale doit rester la règle.
À l’avenir, les efforts devront porter sur l’identification de facteurs
pronostiques biologiques permettant de sélectionner les patients
en fonction de l’effet attendu de la chimiothérapie. Parmi eux, on
peut citer le statut p53, l’expression de la thymidylate synthase,
etc. Les patients résistants au 5-FU (par exemple en raison d’une
forte expression de thymidylate synthase) se verront alors propo-
ser une polychimiothérapie d’emblée. De nouvelles études rando-
misées devraient donc explorer ces concepts et préciser le groupe
de patients qui bénéficieront d’une chimiothérapie agressive.
NEUROTOXICITÉ DE L’OXALIPLATINE
Le point de vue du neurophysiologiste (d’après A. Sebille)
L’effet neurotoxique des dérivés du platine s’exerce sur le neurone
sensitif périphérique, au niveau du ganglion rachidien. D’un point
de vue physiopathologique, cette toxicité s’explique par un arrêt
de la synthèse protéique, qui conduit à une altération de la fonc-
tion axonale et à une dégénérescence centripète des deux branches
de l’axone. À la lumière des connaissances acquises avec le cis-
platine, la neurotoxicité de l’oxaliplatine a été étudiée par l’enre-
gistrement des fibres sensitives cutanées et des fibres nerveuses
proprioceptives. Dans l’étude présentée, les potentiels sensitifs du
nerf sural et du nerf médian ont été enregistrés, ainsi que l’activité
motrice du nerf médian. Le critère retenu pour la comparaison de
la toxicité au cours des cycles d’oxaliplatine est l’amplitude des
potentiels sensitifs, reflet du nombre d’axones fonctionnels, et le
pourcentage de recrutement du réflexe monosynaptique du triceps
sural. Deux cent cinquante enregistrements ont été réalisés chez
92 patients traités par oxaliplatine tous les quinze jours. Vingt-sept
patients ont eu une exploration fonctionnelle dès le début du trai-
tement et 4 cycles plus tard et 14 patients ont eu un enregistrement
aux cycles 1, 4 et 8. Les amplitudes moyennes ont été comparées
entre le début de traitement et lors des 4eet/ou 8ecycles. Les résul-
tats de cette étude montrent que l’amplitude décroît de façon signi-
ficative entre le premier et le quatrième cycle (p = 0,02). La dimi-
nution d’amplitude se poursuit entre le 4eet le 8ecycle avec une
différence très significative (p < 0,001). En rapportant l’ensemble
des amplitudes de potentiels sensitifs en fonction de la dose cumu-
lée d’oxaliplatine reçue, on observe une relation linéaire entre ces
deux paramètres. Ainsi, l’amplitude est réduite de moitié pour une
dose cumulée d’oxaliplatine de 1 600 mg. Ces résultats indiquent
qu’il existe une dégénérescence axonale des fibres nerveuses sen-
sitives liée à la dose cumulée d’oxaliplatine.
Une des particularités de la neurotoxicité de l’oxaliplatine est
l’exacerbation des symptômes par le froid. Les enregistrements
électrophysiologiques réalisés au niveau musculaire montrent des
anomalies de type myotonique, liées à une altération de la fonc-
tion des canaux sodiques. Les enregistrements réalisés au niveau
de l’éminence thénar au repos et lors d’une contraction volon-
taire retrouvent un tracé typique de myotonie.
La neurotoxicité de l’oxaliplatine s’exerce sur les neurones sen-
sitifs, au niveau du ganglion rachidien. Cette toxicité est étroite-
ment liée à la dose cumulée reçue par le patient. L’oxaliplatine
se lierait probablement à la membrane des cellules nerveuses en
fonction de la concentration plasmatique, provoquant ainsi une
altération des canaux ioniques transmembranaires responsable
de phénomènes semblables à ceux de la myotonie.
Le point de vue du clinicien (d’après C. Louvet)
La toxicité limitante de l’oxaliplatine, seul ou en association avec
un schéma 5-FU/acide folinique, est neurologique. Il s’agit d’une
neuropathie périphérique sensitive, réversible. Elle se manifeste
initialement dans les heures qui suivent la perfusion sous la forme
de dysesthésies exacerbées par le froid localisées au niveau des
extrémités distales, voire de la sphère pharyngolaryngée. Ces
symptômes sont fréquents lors des premières cures et l’intensité
en est faible. Après plusieurs cycles, une toxicité cumulative
apparaît, les dysesthésies ou paresthésies persistent entre les
cycles et 15 % des patients développent une gêne fonctionnelle
après avoir reçu une dose cumulée de 800 mg/m2d’oxaliplatine.
Une étude rétrospective sur le délai d’apparition et l’évolution
de la neurotoxicité a été présentée. Trente-quatre patients ayant
au moins 6 mois de suivi après l’apparition d’une neurotoxicité
de grade 3 ont été étudiés. Ce groupe de patients comporte
19 hommes et 15 femmes, de 62 ans d’âge moyen. Dix-huit
patients avaient un indice de performance de 0 et 16 un indice de
CONGRÈS
12
La Lettre du Cancérologue - Volume IX - no1 - février 2000

performance de 1 ou 2. Dix patients recevaient l’oxaliplatine en
première ligne thérapeutique et 24 en deuxième ligne. Les doses
par cycle étaient de 85 mg/m2chez 19 patients et de 100 mg/m2
chez 15 patients. Les cycles étaient administrés tous les 15 jours.
Le délai médian de survenue d’une neuropathie de grade 3 est de
23 semaines, et à 30 semaines, la probabilité d’avoir une telle
toxicité est de 91 %. En ce qui concerne l’évolution clinique, la
médiane de récupération a été de 12 semaines, 77% des patients
récupérant à 20 semaines et 88 % à 30 semaines.
Une étude complémentaire a cherché à mettre en évidence des fac-
teurs individuels de risque de développer une neuropathie de grade
3 (impotence fonctionnelle). Pour cela, les données de 150 patients
traités par oxaliplatine en deuxième ligne pendant un minimum de
6cycles ont été étudiées. Trente-six patients ont développé une neu-
ropathie de grade 3 et 114 une neuropathie de grade 0, 1 ou 2. En
comparant les caractéristiques de ces deux groupes de patients, seul
le sexe a une répartition significativement différente dans les deux
groupes : le sexe féminin est associé à une plus forte fréquence de
neuropathies de grade 3. Ceci peut être le reflet d’une susceptibi-
lité plus importante chez les femmes, mais peut aussi correspondre
à une plus grande acuité dans la perception des symptômes.
En conclusion, quelques recommandations peuvent être formu-
lées quant à l’utilisation de l’oxaliplatine, vis-à-vis de sa neuro-
toxicité. Tout d’abord, la décision de poursuivre l’administration
d’oxaliplatine ne doit être basée que sur l’examen neurologique
complet du patient et non sur le calcul de la dose-intensité ou de
la dose cumulative. D’autre part, alors que l’administration d’oxa-
liplatine ne présente pas de risque en présence d’une neuropathie
de grade 1, la présence d’un grade 2 doit conduire à une prudence
particulière, à un examen et un interrogatoire méticuleux. Enfin,
il est impératif d’interrompre le traitement dès l’apparition d’une
neuropathie de grade 3, à savoir une impotence fonctionnelle qui
doit être objectivée de façon précise. Il faut également signaler
que la réintroduction de l’oxaliplatine après normalisation de
l’examen neurologique peut être envisagée. L’intérêt de l’exa-
men électrophysiologique comme outil prédictif au niveau indi-
viduel n’est pas encore établi.
OXALIPLATINE EN ASSOCIATION : NOUVELLES DONNÉES
(d’après M. Ducreux)
Pendant plus de quarante ans, le 5-fluoro-uracile a été la pierre
angulaire des traitements du cancer colorectal. Depuis 1996, de
nouvelles molécules ont démontré leur efficacité chez les patients
ayant un cancer colorectal métastatique, que ce soit en première
ou en deuxième ligne après échec d’un traitement par 5-FU. Les
mécanismes d’action de ces nouvelles drogues sont différents,
de même que leur spectre de toxicité. Cela ouvre de nouvelles
perspectives étant donné les nouvelles associations de drogues
qui pourront être élaborées.
Oxaliplatine et raltitrexed
Rationnel
L’oxaliplatine et le raltitrexed sont deux molécules récentes ayant
démontré leur efficacité en première ligne, avec des taux de
réponse en monothérapie de 20 à 24 % pour l’oxaliplatine et de
14 à 20 % pour le raltitrexed en phase III (26 % en phase II).
L’intérêt de leur association réside dans leur mécanisme d’action
différent, l’oxaliplatine ayant pour cible l’ADN, au sein duquel
il crée des adduits intrabrins, et le raltitrexed étant un inhibiteur
de la thymidylate synthase. In vitro, il a été démontré qu’ils
avaient une cytotoxicité additive (18). Par ailleurs, l’expérience
acquise lors des essais de phase I et II a montré que ces deux
molécules avaient une toxicité différente, la principale toxicité
de l’oxaliplatine étant la neuropathie périphérique et celle du ral-
titrexed la diarrhée et la leucopénie. Enfin, le schéma thérapeu-
tique en association offre l’avantage d’être aisé puisque chaque
drogue s’administre toutes les trois semaines.
Étude de phase I
L’étude de phase I raltitrexed + oxaliplatine consistait à admi-
nistrer le raltitrexed en perfusions de 15 minutes, suivies
45 minutes plus tard de la perfusion d’oxaliplatine, en deux
heures. Ce schéma était répété toutes les trois semaines. Les doses
respectives étaient 2 mg/m2et 85 mg/m2au premier palier. Les
doses 3,75 et 130 mg/m2(palier 7) correspondaient aux doses
toxiques. Le palier 6 (3,5 mg/m2de raltitrexed et 130 mg/m2
d’oxaliplatine) constituent les doses maximales tolérées. Les
doses recommandées sont les suivantes : raltitrexed : 3 mg/m2
i.v. 15 minutes, suivi 45 minutes plus tard par oxaliplatine :
130 mg/m2i.v. 2 heures, les cycles étant répétés toutes les trois
semaines.
Quarante-cinq patients ont été évalués pour l’efficacité antitu-
morale de la combinaison. Vingt-deux pour cent des patients ont
eu une réponse objective et 40 % avaient une maladie stable. Dans
cette étude, 17 patients avaient un mésothéliome et, parmi eux,
8 ont répondu, ce qui correspond à un taux de réponse de 47 %.
Chez les dix patients ayant un cancer colorectal déjà lourdement
prétraité, 6 avaient une stabilisation de la maladie.
Étude de phase II
Par la suite, la FNCLCC a entrepris un essai multicentrique de
phase II chez des patients atteints de cancer colorectal métasta-
tique en première ligne thérapeutique. Ces patients ont reçu le
raltitrexed à la dose de 3 mg/m2et l’oxaliplatine à la dose de
130mg/m2, toutes les trois semaines. L’évaluation était faite après
trois cycles de traitement. L’objectif principal était le taux de
réponse. Les résultats préliminaires ont été présentés à l’ASCO
1999(19). Soixante et onze patients ont été inclus dans cette étude
entre juin et décembre 1998. La tolérance évaluée sur 53 patients
ayant reçu les deux drogues à la pleine dose recommandée en
monothérapie retrouve 17 % de neutropénie de grade 3-4, 6 %
de diarrhée, 6 % de thrombopénie de grade 3-4, 9 % de nausées
ou de vomissements, 9 % d’augmentation des transaminases
ALAT. Un décès toxique a été signalé. Le taux de réponse glo-
bal est de 59,5 % (IC 47-72) pour les 59 premiers patients dont
les dossiers ont été expertisés de manière indépendante. Trente-
deux pour cent des patients ont eu une stabilisation de leur mala-
die et 8,5 % étaient progressifs. La durée médiane des réponses
était de plus de 5 mois, de même que le temps médian jusqu’à
progression. Cette étude se poursuit et sera prolongée par une
étude randomisée.
13
La Lettre du Cancérologue - Volume IX - no1 - février 2000

Oxaliplatine et CPT11
Rationnel
Ces deux molécules ont maintenant fait la preuve de leur effica-
cité chez les patients ayant un cancer colorectal métastatique,
avec des taux de réponse en première ligne et en monothérapie
de 20 à 24 % pour l’oxaliplatine et de 15 à 20 % pour le CPT11.
Leur mécanisme d’action est là encore différent : le CPT11 est
un inhibiteur de la topo-isomérase I. In vitro, les deux drogues
ont un effet antitumoral synergique sur des lignées cellulaires
coliques humaines (20). Enfin, l’oxaliplatine et le CPT11 pré-
sentent des toxicités différentes.
Études de phase I-II
Trois études de phase I-II ont été réalisées en deuxième ligne
de traitement de cancers colorectaux métastasés, selon un
schéma toutes les deux semaines ou toutes les trois semaines.
Vingt-quatre patients ont été évalués dans le schéma bimensuel.
Les doses recommandées sont de 85 mg/m2d’oxaliplatine et de
200 mg/m2de CPT11. Le taux de réponse est de 29 %, le délai
jusqu’à progression de 7,4 mois et la survie globale de 15,8
mois. Pour la combinaison toutes les trois semaines, les doses
recommandées sont de 85 mg/m2d’oxaliplatine et 180 mg/m2
de CPT11 (21, 22).
Étude de phase II
Un essai publié récemment a étudié l’association d’oxaliplatine
(85 mg/m2J1 et J15) et d’irinotécan (80 mg/m2J1, J8, J15) (23).
Un facteur de croissance granulocytaire était administré en fonc-
tion de la numération leucocytaire. Trente-six patients atteints de
cancer colorectal métastatique ont été inclus dans cette étude.
Tous les patients avaient précédemment reçu un traitement par
fluoropyrimidines. Le taux de réponse est de 42 % (IC 26 %-
59 %), avec 26 % de patients stables et 22 % de patients pro-
gressifs. La survie médiane est de plus de 11 mois. Les princi-
pales toxicités de grade 3-4 ont été la diarrhée (19 % des patients),
les nausées et vomissements (17 %), la neutropénie (12 %) et la
thrombopénie (6 %). Dix-neuf pour cent des patients ont présenté
une alopécie.
Conclusion
Ces résultats établissent l’efficacité des schémas d’association
tels qu’oxaliplatine + raltitrexed ou oxaliplatine + CPT11. La
toxicité est modérée et les schémas d’administration sont simples
et acceptables pour le patient. À l’heure actuelle, des essais de
phase III sont en cours afin de déterminer le bénéfice clinique de
ces divers schémas thérapeutiques.
PERSPECTIVES
(d’après E. van Cutsem)
Les études cliniques réalisées ces dernières années ont permis de
confirmer l’activité de l’oxaliplatine chez les patients ayant un
cancer colorectal avancé. L’association d’oxaliplatine et d’un
schéma de 5-FU/acide folinique s’est révélé plus actif que l’asso-
ciation 5-FU/acide folinique chez les patients traités en première
ligne. En outre, il a également été montré que l’association oxa-
liplatine + 5-FU/acide folinique était efficace chez des patients
ayant progressé sous le même schéma 5-FU/acide folinique.
Enfin, l’oxaliplatine est un dérivé du platine dont la tolérance est
satisfaisante, avec un profil de toxicité bien connu et aisément
gérable en pratique courante.
Compte tenu de ces observations d’efficacité et de bonne tolé-
rance, plusieurs questions se posent pour l’avenir : peut-on opti-
miser l’efficacité de l’association en testant de nouveaux sché-
mas d’oxaliplatine et de 5-FU/acide folinique ? Peut-on améliorer
les résultats en modifiant la séquence d’administration des
drogues ? Quelle serait la place d’autres associations avec l’oxa-
liplatine ? Quels sont les facteurs prédictifs de réponse à l’oxa-
liplatine ? Quelle est la place de l’oxaliplatine en situation adju-
vante ou néoadjuvante ? Quelle est l’efficacité de l’oxaliplatine
dans d’autres indications ? La réponse viendra des nouveaux
essais thérapeutiques, en cours ou à venir, dont E. van Cutsem
expose les principes.
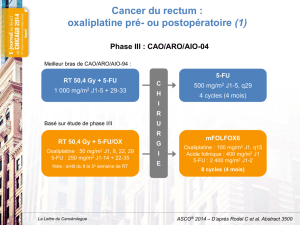
De nombreuses études de phase III en première ligne métasta-
tique sont actuellement en cours. Deux études comparent l’effi-
cacité d’une association de deux schémas 5-FU acide folinique
avec et sans oxaliplatine, basés sur les résultats en faveur du bras
comprenant l’oxaliplatine dans l’essai comparant LV5FU2 à
LV5-FU2 + oxaliplatine. Une étude américaine (EFC7110) com-
pare un schéma de 5-FU/acide folinique de type Mayo Clinic à
une association d’oxaliplatine à 130 mg/m2et de 5-FU bolus et
acide folinique faibles doses, toutes les trois semaines. Le
deuxième essai (N9741 : NCI, NCCTG et CALGB) est un essai
randomisé nord-américain à six bras : 5-FU/acide folinique de
type Mayo Clinic ; 5-FU/acide folinique / CPT11 hebdomadaire ;
CPT11 J1 et 5-FU/acide folinique J2 à J5 toutes les trois
semaines ; oxaliplatine et CPT11 toutes les trois semaines ; oxa-
liplatine J1 et 5-FU / acide folinique bolus J1 à J5 toutes les trois
semaines ; FOLFOX 4 (LV5FU2 + oxaliplatine 85 mg/m2/
2semaines).
Deux études visent à déterminer la modalité optimale d’admi-
nistration de l’oxaliplatine (dose intensité, chronomodulation).
L’étude OPTIMOX compare un schéma de type FOLFOX 4 au
schéma FOLFOX 7 qui comprend une association LV5FU2 sim-
plifié et de l’oxaliplatine à 130 mg/m2tous les 15 jours. Dans ce
deuxième bras, 6 cycles seront administrés, suivis par 12 cycles
de chimiothérapie sans oxaliplatine, puis reprise de l’oxalipla-
tine pour 6 cycles supplémentaires. L’objectif principal est la sur-
vie sans progression. Le deuxième essai (EORTC) compare un
schéma bimensuel de 5-FU en perfusion continue (1,5 à 1,8 g/m2
sur 22 heures J1 J2) et d’acide folinique (600 mg/m2) associé à
de l’oxaliplatine à 100 mg/m2tous les 15 jours, à un schéma 5-
FU/acide folinique/oxaliplatine chronomodulés, tous les 15 jours.
L’objectif principal est la survie à deux ans.
La comparaison entre oxaliplatine et CPT11 en association avec
un schéma 5-FU/acide folinique est une des questions posées par
l’essai nord-américain déjà présenté précédemment (N9741).
L’essai du GERCOR C97 est, quant à lui, un essai de stratégie
comparant un schéma Folfox puis Folfiri (LV5FU2 simplifié +
CPT11) lors de la progression à la séquence inverse. L’objectif
principal est la survie sans progression après la deuxième ligne
thérapeutique.
CONGRÈS
14
La Lettre du Cancérologue - Volume IX - no1 - février 2000
 6
6
1
/
6
100%