Pour la 1

Pour la 1ère fois dans le domaine de l’anticoagulation des patients FA*, depuis 40 ans d’utilisation des AVK
* Fibrillation atriale. AMM obtenue le 01/08/2011
DÉNOMINATION DU MÉDICAMENT ET FORME PHARMACEUTIQUE*:
Pradaxa 110 mg et Pradaxa 150 mg, gélules.
COMPOSITION QUALITATIVE ET QUANTITATIVE*:
Chaque gélule
contient 110 ou 150 mg de dabigatran etexilate (sous forme de mésilate). Excipients dont colorant jaune orangé (E110).
DONNÉES CLINIQUES: Indications thérapeutiques:
Prévention
de l’accident vasculaire cérébral (AVC) et de l’embolie systémique (ES) chez les patients adultes présentant une brillation atriale non valvulaire associée à un ou plusieurs des facteurs de
risque suivants : Antécédent d’AVC, d’accident ischémique transitoire ou d’embolie systémique ; Fraction d’éjection ventriculaire gauche < 40 % ; Insufsance cardiaque symptomatique,
classe ≥ 2 NewYork Heart Association (NYHA); Âge ≥ 75 ans; Âge ≥ 65 ans associé à l’une des affections suivantes: diabète, coronaropathie ou hypertension artérielle.
Posologie et mode
d’administration*: Posologie:
La dose quotidienne recommandée est de 300 mg (1 gélule de 150 mg deux fois/jour). Le traitement doit être poursuivi au long cours. En cas d’intolérance
au dabigatran, les patients doivent être prévenus de la nécessité de consulter immédiatement leur médecin traitant an de passer à d’autres alternatives thérapeutiques adaptées pour la
prévention de l’AVC et de l’ES associée à une brillation atriale. Cas particuliers: Sujets âgés, patients présentant un risque hémorragique, insufsance rénale, administration concomitante de
Pradaxa et des inhibiteurs puissants de la P-glycoprotéine (P-gp) (amiodarone, quinidine ou vérapamil), poids, sexe, insufsance hépatique, passage de Pradaxa à un anticoagulant par voie
parentérale, passage d’un anticoagulant par voie parentérale à Pradaxa, passage de Pradaxa aux antagonistes de la vitamine K (AVK), passage des AVK à Pradaxa, cardioversion, population
pédiatrique, dose oubliée.
Mode d’administration:
Les gélules de Pradaxa doivent être avalées entières avec de l’eau, avec ou sans aliments. Les patients doivent avoir pour instruction de ne
pas ouvrir les gélules, car cela pourrait augmenter le risque de saignement.
Contre-indications:
Hypersensibilité à la substance active ou à l’un des excipients mentionnés en rubrique «Liste
des excipients»; Insufsance rénale sévère (ClCr < 30 mL/min) ; Saignement évolutif cliniquement signicatif; Lésion ou maladie à risque signicatif de saignement majeur, telle qu’ulcération
gastrointestinale en cours ou récente, présence de néoplasies malignes à haut risque de saignement, lésion cérébrale ou rachidienne récente, intervention chirurgicale cérébrale, rachidienne ou
ophtalmique récente, hémorragie intracrânienne récente, varices oesophagiennes connues ou suspectées, malformations artérioveineuses, anévrysme vasculaire ou anomalie vasculaire majeure
intrarachidienne ou intracérébrale; Traitement concomitant avec tout autre agent anticoagulant, par exemple héparine non-fractionnée (HNF), héparines de bas poids moléculaire (énoxaparine,
dalteparine, etc), dérivés de l’héparine (fondaparinux, etc), anticoagulants oraux (warfarine, rivaroxaban, apixaban, etc), sauf en cas de changement de traitement pour Pradaxa ou inversement
(Cf«Posologie et mode d’administration») ou en cas d’administration d’HNF aux doses nécessaires au maintien de la perméabilité d’un cathéter central veineux ou artériel (Cf«Interactions avec
d’autres médicaments et autres formes d’interactions»); Insufsance hépatique ou maladie du foie susceptible d’avoir un impact sur la survie; Traitement concomitant avec le kétoconazole
administré par voie systémique, la ciclosporine, l’itraconazole, le tacrolimus et la dronédarone.
Mises en garde spéciales et précautions d’emploi*:
Insufsance hépatique; Risque
hémorragique; Administration de brinolytiques pour le traitement des AVC ischémiques aigus; Interactions avec les inducteurs de la P-gp; Actes chirurgicaux et interventions : Phase pré-
opératoire, rachianesthésie/anesthésie péridurale/ponction lombaire, patients avec un risque accru de saignements en période post-opératoire; Patients à haut risque de mortalité chirurgicale et
présentant des facteurs de risque intrinsèques d’événements thromboemboliques; Infarctus du myocarde; Patients porteurs de prothèses valvulaires cardiaques; Colorants.
Interactions avec
d’autres médicaments et autres formes d’interactions*:
Anticoagulants et antiagrégants plaquettaires; Interactions liées au prol métabolique du dabigatran etexilate et du dabigatran;
Interactions avec des transporteurs: inhibiteurs de la P-gp, inducteurs de la P-gp, autres médicaments ayant une incidence sur la P-gp, substrats de la P-gp; Traitement concomitant avec des
inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) ou des inhibiteurs sélectifs de la recapture de la sérotonine et de la noradrénaline (IRSNA); pH gastrique.
Fécondité, grossesse et
allaitement*. Effets sur l’aptitude à conduire des véhicules et à utiliser des machines*. Effets indésirables*:
Au total, 22% des patients présentant une brillation atriale traités pour
la prévention de l’AVC et de l’ES (traitement à long terme allant jusqu’à 3ans) ont présenté des effets indésirables. Les effets indésirables les plus fréquemment rapportés ont été des saignements,
survenant au total chez 16,5% des patients présentant une brillation atriale traités en prévention de l’AVC et de l’ES. Bien que de fréquence faible dans les essais cliniques, des saignements majeurs
ou sévères peuvent survenir et, indépendamment de la localisation, peuvent conduire à un handicap, à une menace du pronostic vital, voire même à une issue fatale.
Surdosage*. Propriétés
pharmacodynamiques*:
Groupe pharmacothérapeutique: inhibiteurs directs de la thrombine.
Propriétés pharmacocinétiques*. Données de sécurité précliniques*. DONNÉES
PHARMACEUTIQUES*. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHÉ: Pradaxa 110 mg, gélules:
(60 x 1 gélule): EU/1/08/442/007 - CIP 34009 385 262 0 2 – Prix: 75,78€ / CTJ:
2,53€.
Pradaxa 150 mg:
(60 x 1 gélule): EU/1/08/442/011 - CIP 34009 419 453 8 0 – Prix: 75,78€ / CTJ: 2,53€.
CONDITIONS DE PRESCRIPTION ET DE DÉLIVRANCE:
Médicament soumis à
prescription médicale.
Liste I.
Boîtes de 60 x 1 gélule: Remboursées Sec. Soc à 65% - Agréé collect.
DATE DE PREMIÈRE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION:
Date
de première autorisation: Pradaxa 110 mg: 18 mars 2008; Pradaxa 150 mg: 01 août 2011.
DATE DE MISE À JOUR DU TEXTE:
30 août 2012.
TITULAIRE DE L’AUTORISATION DE MISE SUR LE
MARCHÉ:
Boehringer Ingelheim International GmbH, D-55216 Ingelheim am Rhein. Allemagne. Représentant local: Boehringer Ingelheim France, 14 rue Jean Antoine Baïf, 75013 Paris. Information
médicale: 12 rue André Huet 51100 Reims -
Information médicale: 03 26 50 45 33.
*Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence Européenne
du Médicament (EMA) ht t p://
www.ema.europa.eu/
ou sur demande auprès du Laboratoire.
Pradaxacommunes_FA110-150-MLA-300812-v1.doc
AVC PRÉVENTION
12-896 - 09/2012 - Boehringer Ingelheim France S.A.S.
Pour en savoir plus : www.anticoagulant.fr
Simplement efficace
E
N
P
R
É
V
E
N
T
I
O
N
D
E
S
A
V
C
D
A
N
S
L
A
F
A
Groupe Consensus
Attitudes
Recommandations ESC 2012
sur la prise en charge de
l’infarctus avec sus-décalage
de ST (partie II)
Recommandations européennes 2012
sur l’insuffisance cardiaque chronique :
la prise en charge
Thérapie cellulaire :
bilan d’une décennie
Quiz ECG
Art et Cœur
Le cœur vendéen
Congrès
European Society of Cardiology (Munich)
N°1 en audience* chez les hospitaliers toutes périodicités confondues
* Lecture au numéro moyen - Source : Enquête CESSIM automne 2012 (recueil cumulé entre octobre 2011 et janvier 2012, puis de mars à juin 2012).

CONSENSUS CARDIO
pour le praticien
- N° 82 • Octobre 2012
L’
impartialité, même dans le domaine scientifique, est décidément bien difficile à res-
pecter. Une amusante étude publiée dans le New England Journal of Medicine
(1)
nous
le rappelle.
Les auteurs, pharmacologues américains, ont voulu voir si la mention de l'origine des finance-
ments d'études cliniques modifiait la perception et l'interprétation de leurs résultats par les
médecins. La méthodologie de cette étude randomisée est originale et astucieuse : 503 inter-
nistes ont eu à lire des résumés d'études factices, de qualité méthodologique variable, testant
l'intérêt de médicaments imaginaires. Les abstracts mentionnaient soit un financement public
par le National Institute of Health (NIH), soit un financement privé par un laboratoire pharma-
ceutique, soit ne précisaient pas la source de financement. Les médecins étaient ensuite inter-
rogés sur la qualité de l'étude, leur niveau de confiance dans ses résultats et leur désir de pres-
crire le médicament évalué.
Comme on pouvait l'espérer, la qualité méthodologique des essais est évaluée correctement et
la volonté de prescription des nouveaux traitements dépend directement de la rigueur perçue
des études : plus l'étude est jugée rigoureuse, plus les médecins sont prêts à utiliser les traite-
ments évalués. En revanche, la mention d'un financement de l'étude par un industriel amène
les lecteurs à avoir un regard beaucoup plus critique : les études sont jugées moins rigoureuses,
la confiance dans les résultats est plus faible et le souhait de prescrire les nouveaux médicaments
est moindre. Ainsi, à qualité d'étude identique, la volonté de prescrire un nouveau médicament
est diminuée d'un tiers par rapport à une étude dont le financement n'est pas mentionné, et de
moitié par rapport à une étude financée par le NIH.
Ces résultats sont inquiétants à plus d'un titre. Avant tout, ils démontrent que le regard porté
sur les résultats d'études publiées n'est pas neutre, mais modulé par des facteurs qui ne devraient
pourtant pas intervenir, dès lors que la qualité scientifique du travail est considérée comme indis-
cutable. Ils témoignent ensuite d'un réel climat de suspicion vis-à-vis des laboratoires pharma-
ceutiques, résultant sans doute d'affaires douloureuses plus ou moins récentes, où le comporte-
ment des industriels avait été plus qu'anormal (par exemple en taisant des résultats négatifs
pour ne présenter que des données positives), mais peut-être plus encore du climat général de
suspicion relayé par de nombreux médias à l’égard de l'industrie pharmaceutique. Ils révèlent
enfin une naïveté surprenante envers les scientifiques eux-mêmes et les organismes d'Etat, lais-
sant supposer que les cliniciens les considèrent comme un véritable rempart contre tout conflit
d'intérêts.
Quelle belle image d'Epinal ! C'est tout simplement oublier les progrès majeurs qui ont pu
être accomplis à la suite d'essais entièrement financés par l'industrie pharmaceutique. C'est aussi
oublier que le financement par un organisme public n'est pas une garantie de probité scienti-
fique : le choix des thèmes à soutenir n'est jamais innocent, et l'intérêt, en termes de notoriété
essentiellement, des auteurs à publier plus de résultats positifs que de résultats négatifs est éga-
lement un moteur puissant, susceptible, lui aussi, d'entraîner de réels biais dans la présentation
des données.
Finalement, cette jolie étude (financée par l'université d'Harvard !) devrait nous aider à remet-
tre les pendules à l'heure : il est essentiel de garder son esprit critique lors de l'analyse de tout
travail scientifique, quel qu'en soit le financeur, privé comme public. Des outils spécifiques, comme
la déclaration préalable du plan d'étude sur le site clinicaltrials.gov, sont d'ailleurs là pour aider
à y voir plus clair. ■
Nicolas Danchin
Rédacteur en chef
Editorial
Rédacteur en chef
Nicolas Danchin
Comité éditorial
Eric Abergel
Loïc Belle
Didier Blanchard
Eric Bruckert
Bernard Chevalier
Stéphane Cosson
Yves Cottin
Nicolas Danchin
Denis Duboc
(chef de rubrique Généalogie)
Jean-Noël Fabiani
Laurent Fauchier
Pascal Guéret
(chef de rubrique Art & Cœur)
Alain Hagège
Yves Juillière
Serge Kownator
Jean-François Leclercq
Jean-Yves Le Heuzey
Gilles Lemesle
Eloi Marijon
Nicolas Meneveau
(rédacteur en chef
du Cahier de cardiologie interventionnelle)
Jean-Jacques Mourad
Franck Paganelli
Atul Pathak
Pascal Poncelet
Etienne Puymirat
Philippe Romejko
David Rosenbaum
Simon Weber
Directeur de la publication
Yves Nadjari
Directeur médical
Sarah Cohen
Directeur général
Alexandre Nadjari
Secrétaire de rédaction
Virginie Condamine
Chargées de clientèle
Rim Boubaker
Audrey Dufaud
Nolwenn Gauthier
Rym Oussalah
Coordination commerciale
Valérie Renouf
Rédactrice graphiste
Lara Eve
Groupe Consensus,
46-48, rue Lauriston, 75116 Paris
Téléphone : 01 53 65 87 70
Publicité : [email protected]
Rédaction : [email protected]
ISSN : 1767-5162
Site internet : www.consensus-online.fr
Corlet Imprimeur SA - ZI, route de Vire
14110 Condé-sur-Noireau, France
Prix au numéro : 4,50
€
Groupe Consensus
3
Image d'Epinal
1.
Kesselheim AS, et al. N Engl J Med 2012; 367: 1119-27.
EditoSommaire:modeles 19/10/12 15:45 Page 3

Sommaire• numéro 82 • Octobre 2012
5
Dans tous les domaines, dans le
présent et encore plus dans le
futur, ce critère sera un élément
de base qui fera consensus dans
toute l'humanité.
Qu'il me soit permis de l'évoquer
dans trois exemples :
- Le premier est une source de satisfaction consi-
dérable. Il s'agit de la dernière étude Cessim
(organisme dont j'ai toujours loué la qualité).
Elle montre que notre journal Consensus
Cardio est plus que jamais une référence,
comme en témoigne l'enquête d’audience ville-
hôpital : avec 61,6% d’audience moyenne au
numéro, nous passons premier sur la cible Hôpi-
tal, quelle que soit la fréquence de parution.
Sur la ville, nous maintenons la position forte
de premier des mensuels (63,7% d’audience
moyenne au numéro). L'aventure du groupe
Consensus est le témoignage de la qualité de
notre concept. Synonyme de Recommandations
et des modalités de leur application dans la pra-
tique courante, le terme Consensus est mainte-
nant le message essentiel des grands congrès
internationaux. Merci au comité de rédaction
dirigé par Nicolas Danchin et à toute l'équipe ;
merci à vous chers lecteurs pour votre fidélité
et votre attachement au titre.
- Le deuxième est la place donnée à la thérapeu-
tique au Congrès de l’ESC à Munich où le médi-
cament a été à l'honneur. Ce numéro donne
une large place aux informations essentielles à
en retenir.
- La troisième réflexion est issue de notre pra-
tique courante : les nouvelles dispositions en
pharmacie concernant les génériques. Que le
souci d'économie hante les pouvoirs publics,
cela se comprend. Prenons cependant un cas
précis : un patient âgé, modeste, ayant le 100%
aura des difficultés pour avancer l'argent s’il
veut ses médicaments habituels. Prenant des
génériques, le problème de l'observance (notre
lutte permanente) risque de se poser chez ce
type de patient. Ne risque-t-on pas de voir les
résultats sur la santé d'une mauvaise observance
avec paradoxalement un retentissement éco-
nomique mettant en cause les économies
recherchées ?
A suivre…
Yves Nadjari
Directeur de la publication
* Source : Enquête CESSIM automne 2012 (recueil cumulé
entre octobre 2011 et janvier 2012, puis de mars à juin 2012).
Résultats complets disponibles pour les adhérents sur
www.cessim.fr
Éditorial
13
•
Image d'Epinal
Nicolas Danchin
Attitudes
06
•
Recommandations ESC 2012 sur la prise en charge
de l’infarctus avec sus-décalage du segment ST (partie II)
Nicolas Danchin
10
•
Recommandations européennes 2012 sur l’insuffisance
cardiaque chronique : la prise en charge
Albert Hagège
14
•
Thérapie cellulaire : bilan d’une décennie
Philippe Menasché
CONSENSUS CARDIO
pour le praticien
- N° 82 • Octobre 2012
La qualité finit toujours
par payer !
Art et Cœur
19
•
Le cœur vendéen
Marie-Cécile Bouju
Congrès
42
•
European Society of Cardiology (Munich)
ECG
13
•
Quiz ECG
Jean-François Leclercq
18
•
Réponse Quiz
51
•
Actualité
Photo couverture :
© BSIP
Cahier de cardiologie interventionnelle
21
•
Editorial
Nicolas Meneveau
22
•
Indications de l’angioplastie ad hoc : que disent les
recommandations ?
Luc Lorgis, Caroline Brulliard, Olivier Hachet, Philippe Buffet,
Isabelle L’Huillier, Aurélie Gudjoncik, Yves Cottin
26
•
La voie radiale expose-t-elle vraiment le patient
et l’opérateur à des doses de rayons supérieures ?
Jean-Louis Georges
31
•
Prévention des complications hémorragiques en angioplastie
Nicolas Meneveau
35
•
Alcoolisation septale : résultats, indications
Patrick Ohlmann
37
•
EuroPCR 2012
Ce numéro comporte un supplément de 16 pages « ESC
2012 : le TAVI dans les nouvelles recommandations » et un
supplément de 4 pages « Les nouvelles recommandations
de l’European Society of Cardiology sur le STEMI ».
EditoSommaire:modeles 22/10/12 11:06 Page 5

CONSENSUS CARDIO
pour le praticien
- N° 82 • Octobre 2012
6
IFMC - recommandations - sociétés savantes - pratique clinique I
Attitudes
Après le long chapitre consacré à la
prise en charge en pleine phase
aiguë, les recommandations
STEMI de 2012 (1) s'intéressent à la
phase hospitalière et à la transi-
tion vers la reprise d'une vie aussi
normale que possible. Le principal
changement, par rapport aux recom-
mandations de 2008, est la rétrogradation des bêtablo-
quants en classe IIa (un niveau de classe I étant maintenu
dès que sont présents des signes d'insuffisance cardiaque
ou une dysfonction ventriculaire gauche).
Durée et conditions d’hospitalisation
Après avoir rappelé la nécessité d’une hospitalisation en
soins intensifs (I, C), est abordée la problématique de la durée
du séjour hospitalier. Il est recommandé un séjour d’au moins
24 heures en soins intensifs (I, C), ensuite une hospitalisa-
tion de 24 à 48 heures supplémentaires dans un lit ayant un
monitoring ECG peut être envisagée (IIb, C). Le lever peut
être très précoce, en l’absence de dégâts ventriculaires impor-
tants ou de complications. Lorsque l’angioplastie est réali-
sée dans un centre tertiaire, un retour le jour même vers
l’hôpital initial peut être envisagé dans certains cas (IIb, C),
en maintenant le monitoring ECG continu pendant le trans-
port. Enfin, une sortie d’hôpital précoce (72 heures) peut
être envisagée chez les patients à bas risque, à condition
d’avoir organisé la réadaptation et le suivi ultérieur (IIb, B).
Examens d’imagerie
L’échographie a une place de premier plan : dès l’admission, en
cas de doute diagnostique (I, C) à condition de ne pas reporter
la coronarographie si ses résultats ne sont pas concluants ; en
phase aiguë, l’échographie est obligatoire pour évaluer la fonc-
tion ventriculaire gauche (I, B), mais l’IRM peut constituer une
alternative si l’échographie est impossible (IIb, C). Chez les
patients multitronculaires, une imagerie de stress (scintigraphie,
échographie, IRM, PET) doit être programmée avant ou après
la sortie de l’hôpital, pour rechercher des signes d’ischémie ou
de viabilité (I, A). La recherche de viabilité est importante chez
les patients ayant une dysfonction ventriculaire gauche mar-
quée ; aucune méthode n’offre une supériorité décisive par rap-
port aux autres. En revanche, le scanner coronaire n’a pas sa
place en routine (III, C).
Autres marqueurs de risque
Un bilan lipidique doit être systématiquement réalisé, dès
que possible après l’admission ; de même, la glycémie à jeun
et la créatinine doivent faire partie du bilan systématique.
Prise en charge à la sortie
➜
Mode de vie
En raison du risque élevé de nouvel accident coronaire, la
prise en charge au long cours est essentielle, et les premières
bases doivent en être jetées dès la phase hospitalière. L’in-
térêt et l’importance d’avoir un mode de vie favorable doi-
vent être expliqués au patient. Ainsi, chaque hôpital doit
avoir un programme anti-tabac (I, B), ainsi qu’un protocole
spécifique pour l’arrêt du tabac (I, C).
Des conseils nutritionnels adaptés doivent être donnés aux
patients : alimentation diversifiée, avec apports accrus de
fruits et légumes, de céréales et de poisson, remplacement
des graisses saturées et trans par des acides gras mono- ou
polyinsaturés, apport calorique adapté pour éviter la prise
de poids, enfin, chez les hypertendus, réduction des apports
en sel. De même, une réflexion doit être menée avec chaque
patient pour obtenir une activité physique régulière d’un
niveau suffisant. Un programme de réadaptation fondé sur
l’entraînement à l‘effort est recommandé (I, B). Un niveau
de pression artérielle optimal doit être obtenu et des pro-
grammes spécifiques de gestion du stress peuvent être béné-
fiques.
La reprise d’activité doit se discuter au cas par cas, en parti-
culier en fonction de l’étendue des séquelles ventriculaires
et de la persistance éventuelle d’une ischémie myocardique ;
d’une façon générale, un arrêt de travail prolongé doit être
évité. La reprise d’une activité sexuelle peut habituellement
être rapide. Enfin, les vols long-courriers doivent être évités
pendant 4 à 6 semaines en cas d’ischémie ou de dysfonction
ventriculaire gauche marquées.
➜
Médicaments
L’aspirine à faible dose (75-100 mg) doit être utilisée systé-
matiquement et indéfiniment (I, A), sauf en cas de véritable
intolérance, et le clopidogrel constitue alors une alternative
(I, B). Une double antiagrégation est recommandée (aspi-
rine + prasugrel ou aspirine + ticagrelor, de préférence à
Nicolas Danchin
HEGP, Paris
Recommandations ESC 2012
sur la prise en charge de l'infarctus
avec sus-décalage du segment ST (partie II)
N_Danchin:attitude 19/10/12 15:46 Page 6

7
CONSENSUS CARDIO
pour le praticien
- N° 82 • Octobre 2012
aspirine + clopidogrel) chez les patients ayant eu une angio-
plastie (I, A). La durée du double traitement est débattue :
il est recommandé pour une durée pouvant atteindre un an
chez tous les patients après angioplastie (I, C), avec un trai-
tement d’au moins un mois en cas d’utilisation de stent nu
(I, C) et de 6 mois minimum après utilisation d’un stent actif
(IIb, B). Pour les patients n’ayant pas eu de stent, une dou-
ble antiagrégation doit être envisagée, pour une durée maxi-
male d’un an (IIa, C). Chez les patients ayant un risque
hémorragique élevé, il est conseillé d’envisager un traite-
ment par IPP (IIa, C).
En cas d’indication indiscutable d’anticoagulation, un trai-
tement oral est recommandé en plus du traitement anti-
agrégant (I, C) ; il convient alors de réduire au minimum la
durée du double traitement antiagrégant (I, C). En cas de
thrombus intraventriculaire gauche, un traitement anticoa-
gulant doit être mis en route pour un minimum de 3 mois
(IIa, B). Enfin, chez les patients traités par aspirine et clopi-
dogrel, une faible dose de rivaroxaban (2,5 mg 2 fois/j) peut
être envisagée (IIb, B) (Tableau 1).
Un traitement bêtabloquant doit être envisagé dès la phase
hospitalière et poursuivi par la suite, en l’absence de contre-
indication (IIa, B) ; les bêtabloquants doivent être prescrits
en cas d’insuffisance cardiaque ou de dysfonction ventricu-
laire gauche (I, A). L’utilisation intraveineuse des bêtablo-
quants peut être envisagée à l’admission en l’absence
d’insuffisance cardiaque, si la pression artérielle et la fré-
quence cardiaque sont élevées (IIb, B) ; ils ne doivent pas
être utilisés en cas d’hypotension ou d’insuffisance cardiaque
(III, B). Le vérapamil peut être envisagé comme alternative
aux bêtabloquants si ces médicaments sont contre-indiqués
et s’il n’y a pas d’insuffisance cardiaque (IIb, B).
Un traitement par statines à forte dose doit être prescrit et
poursuivi, en l’absence d’intolérance, quel que soit le niveau
de cholestérol (I, A). Après 4 à 6 semaines, une nouvelle prise
de sang doit permettre de vérifier si l’objectif de 0,70 g/l est
atteint (IIa, C).
Les IEC doivent être prescrits dès les 24 premières heures chez
les patients avec des signes d’insuffisance cardiaque, une dys-
fonction ventriculaire gauche systolique, un diabète ou un
infarctus antérieur (I, A). Chez les autres patients, ils doivent
être envisagés, sauf en cas de contre-indication (IIa, A). En
cas d’intolérance aux IEC, les ARA II, et de préférence le val-
sartan, constituent une alternative en cas d’insuffisance car-
diaque ou de dysfonction ventriculaire gauche (I, B). En l’ab-
sence d’insuffisance rénale ou d’hyperkaliémie, un
antagoniste de l’aldostérone (par exemple l’éplérénone),
est indiqué chez les patients avec une fraction d’éjection
≤ 40%, ayant une insuffisance cardiaque ou un diabète
(I, B) (Tableau 2, p 8).
Complications de l’infarctus
avec sus-décalage du segment ST
➜
Insuffisance cardiaque
Le traitement de l’insuffisance cardiaque modérée (classe
Killip II) repose sur l’oxygénothérapie (I, C), les diurétiques
de l’anse (I, C), les IEC, en l’absence d’hypotension, hypovo-
lémie ou insuffisance rénale (I, A), avec un ARA II (valsartan)
comme alternative en cas d’intolérance aux IEC (I, B). Un
antialdostérone comme l’éplérénone doit être utilisé si la
fraction d’éjection est ≤40 % (I, B). Les nitrés intraveineux,
le nitroprussiate, doivent être envisagés en cas de pression
artérielle élevée (IIa, C) et les diurétiques thiazidiques en cas
d’intolérance aux IEC et aux ARA II (IIa, C).
En cas d’œdème pulmonaire (classe Killip III), le traitement
Recommandations sur les
traitements antithrombotiques
Classe Niveau
Un traitement par aspirine à faible dose (75-
100 mg) est recommandé indéfiniment
après STEMI
I A
Chez les patients intolérants à l'aspirine, le
clopidogrel est indiqué comme alternative à
l'aspirine
I B
Un double traitement antiagrégant par aspirine et
prasugrel ou aspirine et ticagrelor (de préférence
à aspirine et clopidogrel) est recommandé chez
les patients traités par angioplastie
I A
Le double traitement par aspirine et antagoniste
des récepteurs à l'ADP par voie orale doit être
continué jusqu'à un maximum de 12 mois avec
un minimum de :
I C
• 1 mois pour les patients ayant eu un stent nu I C
• 6 mois pour les patients ayant eu un stent actif IIb B
Le double traitement antiagrégant doit être utilisé
pendant un an maximum chez les patients
n'ayant pas eu de stent
IIa C
Une protection gastrique par IPP doit être
envisagée pour la durée du double traitement
antiagrégant chez les patients à risque
hémorragique élevé
IIa C
En cas de thrombus intraventriculaire, une
anticoagulation doit être débutée pour un
minimum de 3 mois
IIa B
Chez des patients sélectionnés recevant de
l'aspirine et du clopidogrel, le rivaroxaban à
faible dose (2 fois 2,5 mg) peut être envisagé si
le risque hémorragique est faible
IIb B
En cas d'indication claire d'anticoagulants (par
exemple, fibrillation atriale avec score CHA2DS2-
VASC ≥2 ou prothèse valvulaire mécanique), un
traitement anticoagulant doit être institué en
plus du traitement antiagrégant
I C
Chez les patients nécessitant un triple traitement
antithrombotique (double traitement antiagrégant
et anticoagulant), par exemple après pose de
stent et indication impérative d'anticoagulation,
la durée du double traitement antiagrégant doit
être aussi courte que possible pour réduire le
risque de saignement
I C
Tableau 1.
N_Danchin:attitude 19/10/12 15:46 Page 7
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
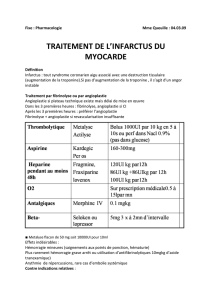
1
/
45
100%