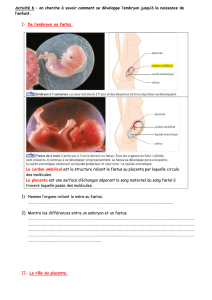
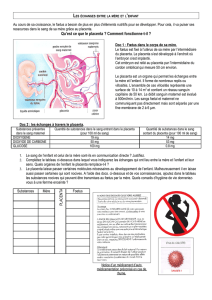
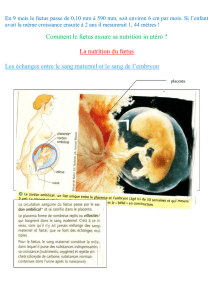
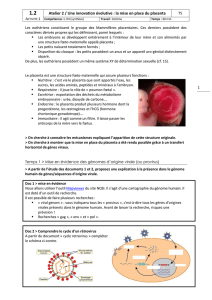
Le Placenta

Le Placenta
Plan :
Introduction
1) Le développement et les différents types de placenta
1.1. De la fécondation à l’implantation : l’origine du placenta
1.2.
Implantation et différents types de placenta
a) Placentas indécidués
b) Placentas décidués
2) Villosités placentaires et structure du placenta chez
l’espèce humaine
2.1. Les villosités placentaires
2.2. Le placenta à maturité
2.3. Evolution du placenta
3) Rôles du placenta
3.1. Le placenta : une annexe dédiée aux échanges
a) L’ interface placentaire
b) Le transport des nutriments
b) Le transport des nutriments
d) Echanges gazeux
3.2. Rôle endocrine
a) Les hormones peptidiques
b) Les hormones stéroïdes
3.3. Rôle de protection du fœtus
3.4. Régulation homéostatiques
Conclusion

Introduction :
D’un point de vue évolutif, ce n’est que tardivement, c’est à dire chez les Vertébrés et à
partir des Reptiles, que les animaux développent des annexes embryonnaires : ce sont des
éléments transitoires non organogènes, qui assurent à l’embryon des fonctions de protection,
d’autonomie métabolique et qui permettent son implantation dans la muqueuse.
Ces annexes permettent à ces animaux d’avoir un développement qui se déroule entièrement
en milieu aérien terrestre.
Les annexes sont au nombre de trois seulement chez les Sauropsidés (Reptiles + Oiseaux) et
les Mammifères Protothériens (= Monotrèmes = Ornithorynque, Echidné), ce sont la vésicule
vitelline, l’amnios et l’allantoïde. Il apparaît chez les Mammifères Euthériens une 4
e
annexe :
le placenta. Or les Euthériens ont des œufs de type alécithe, c’est à dire dépourvus de réserve.
Ainsi, le placenta permet à ces animaux de présenter l’originalité d’un œuf de type alécithe et
un mode vivipare.

1) Le développement et les différents types de placenta
Chez les Mammifères Euthériens, aux œufs alécithes, les annexes embryonnaires se
développent avant la gastrulation ou en même temps.
1.1. De la fécondation à l’implantation : l’origine du placenta
L’ovocyte fécondé se transforme rapidement en un blastocyste. Celui-ci comprend une
couche périphérique de blastomères : le trophoblaste, une lumière et une masse cellulaire
interne : l’embryoblaste (futur embryon). Puis, une fois parvenu dans la cavité utérine et après
avoir passé 2 à 3 jours à l’intérieur de celle-ci, l’embryon s’implante par son pôle
embryonnaire au stade blastocyste.
Les tissus de la mère et de l’embryon participent tous les 2 à l’implantation : Le placenta
est produit par l’interaction entre l’endomètre et les tissus de l’embryon. L’implantation du
blastocyste semble impliquer une reconnaissance cellulaire avec des glycoprotéines
membranaires. Les cellules du trophoblaste prolifèrent et le trophoblaste se divise en 2
couches :
- une couche interne de cellules mononuclées : le cytotrophoblaste ( couche de Langhans).
- une couche externe, qui provient de la fusion de cellules du cytotrophoblaste pour
donner un syncytium multinucléé continu : le syncytiotrophoblaste.
Le cytotrophoblaste est également doublé vers l’intérieur d’une somatopleure (
mésoderme) extra-embryonnaire. Trophoblaste et somatopleure extra-embryonnaire,
constituent le chorion. En même temps, une cavité appelée cœlome extra-embryonnaire se
forme.
A partir de là, on distingue 2 types d’implantations, chacune correspondant à 2 types de
placenta :

1.2. Implantation et différents types de placenta
Selon le degré d’incrustation du chorion au niveau de la muqueuse utérine et la + ou –
grande corrosion de celle-ci par le tissu trophoblastique, à la parturition, une partie de la
muqueuse peut être éliminée en étant accompagnée ou non d’un processus hémorragique. On
parle de placentation déciduée ou indéciduée, selon qu’il y ait ou non hémorragie au moment
de la mise bas.
a) Placentas indécidués
L’implantation de l’embryon n’entraîne aucune lésion de l’embryon au niveau de
l’endomètre et l’expulsion du placenta se fait sans hémorragie. Le trophoblaste est accolé à
l’épithélium utérin. La corrosion du tissu utérin, si elle a lieu, ne lèse aucune structure
vasculaire maternelle. 2 types :
- type épithélio-chorial : chez les Equidés, Suidés, Cétacés et quelques
ruminants.
Ce type est considéré comme primitif. Les villosités choriales s’insèrent
entre les digitations de la muqueuse utérine, mais c’est un simple accolement
entre les structures utérines et embryonnaires, il n’y a aucune lésion.
placenta diffus, car les villosités sont réparties sur toute la surface du
trophoblaste.
- type conjonctivo-chorial ou syndesmochorial ou encore méso-chorial : chez les
ruminants. L’épithélium utérin est corrodé et devient discontinu, les échanges
sont plus intimes : 5 couches cellulaires seulement séparent le sang fœtal du
sang maternel.
De plus, un épithélium mixte sous une forme syncytiale peut se créer à la
suite de fusions entre cellules utérines et chorioniques. Les villosités sont
regroupées sous forme de plages ou cotylédons placenta cotylédonaire.
b) Placentas décidués
Le tissu trophoblastique pénètre profondément dans la muqueuse utérine, provoquant une
atteinte plus ou moins poussée du système vasculaire utérin. A la mise bas, une partie de

l’endomètre est détruite ou rejetée, cette partie est appelée caduque ou décidue. Il s’ensuit une
hémorragie. Deux types :
- type endothélio-chorial : chez les Carnivores, quelques chiroptères ou
insectivores (taupe).
Au niveau de l’endomètre, l’épithélium à disparu et le conjonctif est en
partie résorbé, mais sans léser les vaisseaux maternels : il ne subsiste que
l’endothélium des capillaires qui fait barrière entre le trophoblaste et les sang
maternel. Lors de la parturition, ces vaisseaux subissent un arrachement
entraînant une hémorragie limitée. Les villosités sont réparties en une ceinture
autour du sac embryonnaire placenta zonaire.
- placenta hémo-chorial : chez les Rongeurs, insectivores, Chiroptères et la
totalité des Primates.
Le chorion a corrodé de façon plus poussée le tissu maternel : les parois
des vaisseaux maternels sont détruites. Il se forme des lacunes sanguines au
sein du syncytiotrophoblaste. L’embryon s’enfonce complètement dans la
muqueuse utérine et chez la femme, la pénétration de l’embryon à l’intérieur
de la muqueuse utérine est totale au 13
e
jour de gestation.
Par contre, les parois vasculaires chorioniques (embryonnaires) ne sont pas
détruites. Ainsi, on n’observe jamais de mélange sanguin entre les deux
circulations fœtale et maternelle. Les villosités ne subsistent que sous la forme
d’une ou deux plages discoïdales placenta discoïdal.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%