Six1 regulates stem cell repair potential and self renewal

Six1 regulates stem cell repair potential
and self renewal during skeletal muscle
regeneration
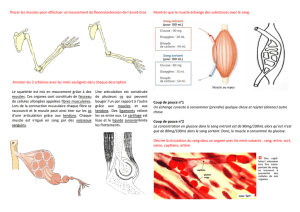
Les muscles squelettiques sont des structures striées
contractiles, fixées aux os par les tendons, qui permettent le mouvement du corps dans l'espace.
Un muscle squelettique est constitué de cellules multinucléées (myofibres) qui contiennent les
fibrilles contractiles. L'homéostasie du tissu musculaire adulte dépend d'une population de
progéniteurs quiescents situés dans une niche autour des myofibres : les cellules satellites (SCs).
Ces cellules souches commises dans le lignage musculaire sont responsables de la croissance
post-natale et de la capacité du tissu musculaire adulte à se régénérer suite à un traumatisme ou à
un effort répété. Au cours de la régénération musculaire, les SCs sortent de quiescence, vont
proliférer puis se différencier pour former de nouvelles myofibres ou s'auto-renouveler et
reconstituer la niche satellite dans le nouveau tissu. Nous avons étudié le rôle du facteur de
transcription Six1 dans la physiologie des SCs du muscle adulte. Nous avons constaté que Six1 est
exprimé dans toutes les SCs, et que l’invalidation conditionnelle du gène Six1, spécifiquement dans
ces cellules, ne perturbe pas leur quiescence. En revanche, Six1 est nécessaire pour la
différentiation en myofibres des SCs ex vivo, et pour la régénération du muscle squelettique in vivo.
Ceci via le contrôle de l’expression des facteurs de régulation myogénique MyoD et Myogénine
(mais pas de Myf5). De plus, nous avons montré que Six1 est un important régulateur de l’auto-
renouvellement des SCs, via le contrôle de la signalisation Dusp6-ERK1/2. Nos travaux définissent
ainsi le rôle important de l’homéoprotéine Six1 dans l’homéostasie des cellules souches
musculaires adultes in vivo.
Satellite cells (SCs) are stem cells that mediate skeletal muscle growth and regeneration. Here, we
observe that adult quiescent SCs and their activated descendants expressed the homeodomain
transcription factor Six1. Genetic disruption of Six1 specifically in adult SCs impaired myogenic cell
differentiation, impaired myofiber repair during regeneration, and perturbed homeostasis of the stem
cell niche, indicated by an increase in SC self-renewal. Six1 regulated the expression of the
myogenic regulatory factors MyoD and Myogenin, but not Myf5, suggesting that Six1 acts on
divergent genetic networks in the embryo and in the adult. Moreover, we demonstrate that Six1
regulates the ERK1/2 pathway during regeneration via direct control of Dusp6 transcription. Muscles
lacking Dusp6 were able to regenerate properly but showed a marked increase in SC number
following regeneration. We conclude that Six1 homeoproteins act as a rheostat system to ensure
proper regeneration of the tissue and replenishment of the stem cells pool during the events that
follow skeletal muscle trauma.
Références :
The Journal of Cell Biology - Published September 3, 2012
www.jcb.org/cgi/doi/10.1083/jcb.201201050
Contact chercheur :
Fabien Le Grand
Inserm U1016 / Institut Cochin
24, rue du Faubourg Saint Jacques
Tél. : 01 44 41 24 36 - fabien.le-grand@inserm.fr
1
/
1
100%