Lire l'article complet

Mise au point
Mise au point
17
POINTS FORTS
La thrombose de stent est un événement clinique grave.
Les facteurs de risque de thrombose de stent sont muti-
factoriels : liés au patient, à la lésion, à la procédure, au stent
(drogue et polymère).
Le risque de saignement lié au traitement double anti-
agrégant plaquettaire doit être pris en compte.
La durée optimale du traitement double antiagrégant
plaquettaire est inconnue
Mots-clés: Thrombose – Stent - Traitement antiagrégant
plaquettaire.
Keywords : Thrombosis – Stent - Dual antiplatelet therapy.
La Lettre du Cardiologue - n° 412 - février 2008
Quel traitement antiplaquettaire après mise en place
d’un stent actif ?
Which antiplatelet after drug coated stent?
IPG. Helft*
agressive adoptée. Le mérite revient à Barragan d’avoir ima-
giné et montré dans un registre que l’association ticlopidine-
aspirine diminuait nettement la fréquence des thromboses
subaiguës de stent en même temps que le taux des compli-
cations hémorragiques. A. Schömig et al. ont ensuite validé,
selon les règles de l’evidence-based medicine, la supériorité de
cette association sur le traitement comprenant des antivita-
mines K (cette étude randomisée étant conduite alors que la
communauté cardiologique considérait déjà la bithérapie anti-
agrégante comme le traitement le plus efficace)[2].
En 1993, deux études randomisées démontraient la supério-
rité du traitement par stent coronaire sur le traitement par
ballonnet en termes de réduction de la resténose angiographi-
que et de nécessité d’une seconde revascularisation sur la lé-
sion traitée. Il s’est ensuivi un engouement considérable pour
la mise en place de stents dans le traitement percutané des
lésions coronaires, plus de 80 % des procédures comprenant
alors la mise en place d’au moins un stent. Le principal incon-
vénient de la mise en place d’un stent était l’hyperplasie inti-
male qu’il induisait. La subocclusion de stent (diminuée par
l’administration du traitement double antiplaquettaire) restait
un problème initialement non entièrement résolu de l’ordre
de 3 % (soit supérieur au traitement par ballonnet seul), dont
la fréquence allait diminuer grâce à l’application des opéra-
teurs à apposer le mieux possible le grillage métallique dans
la paroi coronaire. Il n’en demeure pas moins que la facilité
croissante de la mise en place des stents (rendue possible par
les progrès considérables des stents eux-mêmes, des guides et
des cathéters supports) et le raccourcissement de la durée des
procédures résultant des stents, couplés à leur efficacité sur
la resténose, expliquent l’engouement de la communauté car-
diologique pour cet outil. Néanmoins, il faut garder à l’esprit
qu’aucune démonstration d’une diminution de la mortalité ou
de la survenue d’un infarctus du myocarde liée à l’utilisation
du stent n’avait été faite (et cela demeure vrai à ce jour).
C’est ensuite le clopidogrel, nouvelle thiénopyridine (dont le
développement pharmacologique fut assez pauvre) qui mar-
qua un nouveau progrès dans la prise en charge des patients
bénéficiant d’un stent, en remplaçant la ticlopidine. En effet,
la ticlopidine peut entraîner des effets indésirables hématolo-
giques sévères, parmi lesquels l’agranulocytose et le purpura
thrombotique thrombocytopénique (PTT), deux pathologies
potentiellement fatales.
L’étape suivante, majeure pour le développement de l’angio-
plastie coronaire, a été l’introduction des stents actifs. La stan-
ding ovation lors de la première communication réservée à la
* Institut de cardiologie, hôpital de la Pitié-Salpêtrière, Paris.
La cardiologie interventionnelle, en particulier l’avène-
ment des stents coronaires, a marqué un progrès indé-
niable dans la prise en charge de la maladie coronaire.
Le traitement antiplaquettaire double, associant thiénopyri-
dine et aspirine pour une courte durée, de quelques semaines,
s’est rapidement imposé comme le traitement de référence à
l’ère des stents nus de première génération. La question de la
durée de ce traitement antiagrégant double reste inconnue à
ce jour pour les stents coatés dits “actifs” et représente un sujet
majeur de préoccupation du clinicien prenant en charge les
patients porteurs de ce type de stents.
L’utilisation de matériel introduit par voie percutanée a été
initialement proposée il y a plus de quatre décennies par
C.T. Dotter et M.P. Judkins au niveau des artères périphé-
riques. Treize ans plus tard, l’ingénieux A.R. Grüntzig a élé-
gamment développé avec succès une technique percutanée
d’angioplastie par ballonnet pour le traitement de sténoses co-
ronaires (1). Puis J. Palmaz et son équipe ont introduit et dif-
fusé l’utilisation de stents montés sur des ballons dans les ar-
tères périphériques. Peu de temps après, en mars 1986, J. Puel
fut le premier à implanter avec succès un stent coronaire chez
l’homme. Rapidement, le grave problème de l’occlusion su-
baiguë de stent se posa, en dépit de la stratégie anticoagulante
LC412-ok.indd 17 25/02/08 11:06:07

Mise au point
Mise au point
18
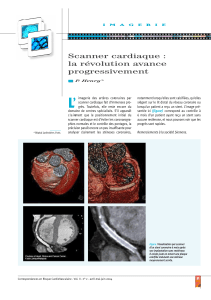
B
C
A
Figure. Coronarographie montrant une sténose serrée de l’IVA
moyenne (A), le résultat après stenting (B) et la thrombose
intrastent survenue à J7 (C).
B
C
La Lettre du Cardiologue - n° 412 - février 2008
publication de l’étude RAVEL augurait bien de l’enthousiasme
que susciteraient à leur tour les études similaires testant le
stent Cypher® (recouvert de sirolimus) et le stent Taxus® (re-
couvert de paclitaxel), études prouvant de façon convaincante
l’efficacité de ces deux stents actifs sur la fréquence de la resté-
nose et la nécessité de revascularisation secondaire (3).
En 2005, les recommandations de la Société européenne de
cardiologie pour les procédures coronaires interventionnelles
notaient que la thrombose de stent n’était pas apparue comme
un problème significatif sur la période du suivi des principaux
essais des stents actifs, période qui était inférieure à un an (4) ;
cela bien entendu lorsque le clopidogrel était prescrit conjoin-
tement à l’aspirine selon les recommandations en vigueur (2
à 3 mois avec le Cypher®, 6 mois avec le Taxus®). Il était men-
tionné cependant que la couverture endothéliale complète au
niveau des stents actifs pouvait nécessiter jusqu’à 2 ans. Ces
recommandations prenaient également la précaution de dire
que les registres en cours et futurs seraient importants pour
confirmer les résultats antérieurs et s’assurer que leurs résul-
tats étaient similaires à ceux des études randomisées. L’arrêt
prématuré du clopidogrel était déjà noté comme associé à un
risque accru de thrombose (4). En cas de chirurgie extracar-
diaque programmée, l’utilisation des stents actifs devait rester
prudente. En conclusion, dans ces recommandations euro-
péennes de 2005, la poursuite du clopidogrel en association
avec l’aspirine était préconisée pour une durée de 6 à 12 mois
avec un niveau de preuve IC. Au contraire, la recommanda-
tion avec un niveau de preuve IA était de 3 à 4 semaines en cas
d’utilisation d’un stent nu.
Au congrès européen de Barcelone en 2006, un vent de pa-
nique se leva après deux communications très médiatisées
et, surtout, en raison des craintes suscitées par une possible
augmentation de l’incidence des thromboses de stent actif
(en comparaison de l’incidence des thromboses de stent non
actif). Quelques mois plus tard, la parution dans un même
numéro du New England Journal of Medicine de plusieurs ar-
ticles reprenant ce thème et l’analyse détaillée des données des
patients inclus dans les premiers essais randomisés comparant
stent actif et stent nu a permis de tempérer les craintes ini-
tiales (5). Quelle est la raison de cette agitation médiatique ?
Elle procède de ce que la thrombose de stent n’est pas un phé-
nomène anodin. Certes, il s’agit d’un accident rare, mais aux
conséquences cliniques potentiellement gravissimes avec le
décès ou l’infarctus grave dans 30 et 50 % des cas (figure).
Différents facteurs de risque de thrombose de stent ont été
identifiés, certains liés au patient, d’autres à la lésion et d’autres
encore à la procédure. Le problème complexe de la com-
pliance du patient, et surtout de la résistance aux différents
agents antiplaquettaires, intervient. L’insuffisance rénale,
le diabète et la dysfonction ventriculaire sont des facteurs de
risque de thrombose de stent, de même que la multiplicité
des stents, leur longueur, leur éventuelle surapposition et les
lésions de bifurcation. Enfin, l’arrêt transitoire ou non de la
bithérapie antiagrégante est associé à la thrombose de stent,
même tardivement après sa mise en place.
Initialement, à la suite des études pilotes ayant mené à la mise
à notre disposition des stents au sirolimus et au paclitaxel, la
bithérapie était recommandée pour 3 mois avec le sirolimus
et pour 6 mois avec le paclitaxel. Compte tenu de l’associa-
tion entre l’interruption d’un agent antiplaquettaire (il s’agit
le plus souvent du clopidogrel) et le phénomène de throm-
bose de stent, l’opportunité d’une durée prolongée au-delà
LC412-ok.indd 18 25/02/08 11:06:08

Mise au point
Mise au point
19
La Lettre du Cardiologue - n° 412 - février 2008
Quant au problème économique, il est le suivant : le coût jour-
nalier du clopidogrel (75 mg/j) en France est d’environ 2 euros,
soit plus de 730 euros par an ; quelque 50 000 patients bénéfi-
cient annuellement de la mise en place d’un stent coaté ; 1 an
supplémentaire de clopidogrel pour l’ensemble de ces patients
revient donc à environ 40 millions d’euros. Il faut s’aviser que
s’il fallait poursuivre “longtemps” la bithérapie, pour chaque
procédure avec mise en place d’un stent actif, au surcoût du
stent actif par rapport au stent nu (près de 1 000 euros actuel-
lement en France) s’ajouterait celui du traitement antiagrégant
plaquettaire. Il faut également se rendre compte que cette
prescription prolongée n’arrange pas les affaires de ceux qui
veulent faire des économies dans les soins médicaux. Et cela
s’est déjà inscrit dans le cadre des Recommandations pour une
prescription efficiente des antiagrégants plaquettaires publiées
le 5 janvier 2007 dans le Journal officiel de la République fran-
çaise, qui préconisent un traitement par aspirine + clopidogrel
pendant 1 à 12 mois puis par aspirine seule en cas de syndro-
mes coronariens aigus traités ou non par angioplastie ! Il s’agit
d’un raccourci saisissant qui ne prend pas en compte la notion
de stent et encore moins celle de stent actif. Il est établi que
beaucoup de patients sont actuellement de manière injustifiée
sous clopidogrel, mais la solution n’est certainement pas de
priver de clopidogrel ceux qui en ont besoin !
Comme rappelé précédemment, la thérapie antiagrégante
plaquettaire n’est pas seule en cause dans le phénomène de
thrombose de stent. Dans près d’un cas sur deux, elle ne semble
d’ailleurs pas impliquée.
Un autre problème de la bithérapie antiagrégante est celui
des patients qui nécessitent une chirurgie urgente imprévue
la première année suivant la mise en place d’un stent actif
(8). Le chirurgien devra impérativement être interrogé sur la
nécessité absolue de l’interruption du traitement antiagrégant.
Si indispensable, on essaiera d’interrompre uniquement le
clopidogrel quelque 5 jours seulement avant l’intervention,
en le reprenant le plus tôt possible.
Dans le cas des syndromes coronaires aigus sans susdécalage
du segment ST, les recommandations européennes récentes
préconisent, outre l’aspirine à vie, la poursuite du clopidogrel
pendant 1 an en l’absence de risque excessif de saignement
(niveau de preuve IA). Cela repose notamment sur l’étude
CURE, dont les conclusions avaient été discutées, l’essentiel
du gain apporté par la bithérapie apparaissant lors des 3 pre-
miers mois du traitement. Néanmoins, l’application de ces re-
commandations simplifie la question de la durée optimale de
la bithérapie dans le cadre des procédures interventionnelles
(fréquentes) réalisées dans ce contexte.
Directions futures
En attendant le grand essai randomisé qui répondra peut-être
à la difficile question de la durée optimale du traitement
antiagrégant double, il existe une piste intéressante qui
consiste à mieux identifier les patients à haut risque de
thrombose intrastent. Le consensus actuel est de prescrire la bi-
thérapie antiagrégante plaquettaire (Plavix® = clopidogrel +
de 6 mois, voire indéfiniment, a été envisagée. Le thème de la
durée optimale de la bithérapie après mise en place d’un stent
actif est ainsi devenu une question centrale de la cardiologie
contemporaine, pour les angioplasticiens comme pour les pra-
ticiens ayant en charge des patients porteurs d’un stent actif.
Les premiers réalisent que la sûreté de leur geste peut être
compromise par un éventuel arrêt, volontaire ou non, par le
patient d’un “simple” médicament ; les seconds, qui suivent
les patients à long terme, s’interrogent à chaque consultation
sur l’opportunité de poursuivre la bithérapie. Les données dont
nous disposons à l’heure actuelle ne permettent pas de trancher
définitivement. Par exemple, on ne connaît pas le pourcentage
de patients interrompant l’un des deux antiagrégants après la
période minimale de 3 à 6 mois et qui heureusement ne dé-
veloppent pas de thrombose intrastent. Les attitudes actuelles
varient entre la période minimale de 3 à 6 mois et une pres-
cription de la bithérapie ad vitam aeternam. Certaines études
actuelles inciteraient à une prescription prolongée. Ainsi, sur
une cohorte non randomisée suivie à 2 ans, le traitement par
un stent actif avec de l’aspirine et du clopidogrel au-delà de 1 an
était associé à une survie sans infarctus améliorée à 2 ans (6).
Ces données imparfaitement convaincantes ont cependant mo-
tivé des recommandations de l’AHA préconisant une durée de la
bithérapie d’au moins 1 an ainsi que le report de toute chirurgie
non urgente au-delà de la première année (7). Il n’en demeure
pas moins qu’en dépit de travaux rétrospectifs et d’arguments
expérimentaux divers, la durée optimale du traitement double
antiagrégant plaquettaire ne pourra sans doute être déterminée
que par un grand essai scientifique randomisé bien mené.
Si une interruption trop précoce des antiagrégants plaquet-
taires risque de favoriser une thrombose de stent, quels sont
les risques d’une prolongation de la bithérapie ?
Ils sont de deux ordres. D’une part, le risque de saignement pro-
voqué par la bithérapie, d’autre part, le problème économique
engendré par cette prescription prolongée. C’est la raison pour
laquelle les recommandations récentes préconisent la prolonga-
tion de la bithérapie à au moins 12 mois chez les patients à faible
risque de saignement (7). Mais les risques de saignement élevés,
et parallèlement de thrombose, peuvent aller dans le même sens,
comme dans le cas des insuffisants rénaux, ce qui ne simplifie pas
notre tâche. L’idée de poursuivre la bithérapie jusqu’à la survenue
d’un saignement n’est peut-être pas non plus la plus opportune si
le premier saignement est grave (hémorragie intracérébrale, par
exemple). Il conviendrait plutôt d’identifier les patients à risque
de thrombose de stent. D’autre part, il faut mettre en balance
deux risques qui sont faibles et, partant plus difficiles à compa-
rer : le risque thrombotique et le risque hémorragique. Il faut
admettre que le risque de saignement est logiquement majoré
par la bithérapie par rapport à la monothérapie par aspirine. En
moyenne, le risque annuel de saignement grave sous bithérapie
antiagrégante plaquettaire passe de l’ordre de 1 % à 2 % si l’on se
réfère aux études MATCH et CHARISMA. Pour un patient de
50 ans, bénéficiant de la mise en place d’un stent actif, quel sera
alors le risque cumulé de saignement sur une période de 3 ou
4 décennies si la bithérapie est prolongée à vie ?
LC412-ok.indd 19 25/02/08 11:06:09

Mise au point
Mise au point
EXFORGE
®
5 mg / 80 mg, 5 mg / 160 mg et 10 mg / 160 mg ; comprimé pelliculé (amlodipine, valsartan). Forme, présentation et composition : Exforge® 5 mg / 80 mg : comprimés pelliculés dosés à 5 mg d'amlodipine et 80 mg de valsartan, boîtes de 30 et 90.
Exforge® 5 mg / 160 mg : comprimés pelliculés dosés à 5 mg d'amlodipine et 160 mg de valsartan, boîtes de 30 et 90. Exforge® 10 mg/160 mg : comprimés pelliculés dosés à 10 mg d'amlodipine et 160 mg de valsartan, boîtes de 30 et 90.
DONNEES CLINIQUES : Indications thérapeutiques : Traitement de l'hypertension artérielle essentielle. Exforge est indiqué chez les patients dont la pression artérielle n'est pas suffisamment contrôlée sous amlodipine ou valsartan en monothérapie. Posologie
et mode d’administration : La dose recommandée est d'1 cp/j. Exforge 5 mg/80 mg peut être administré si la pression artérielle n'est pas suffisamment contrôlée avec l'amlodipine 5 mg ou le valsartan 80 mg seuls. Exforge 5 mg/160 mg peut être
administré si la pression artérielle n'est pas suffisamment contrôlée avec l'amlodipine 5 mg ou le valsartan 160 mg seuls. Exforge 10 mg/160 mg peut être administré si la pression artérielle n'est pas suffisamment contrôlée avec l'amlodipine
10 mg ou le valsartan 160 mg seuls ou avec Exforge 5 mg/160 mg. CTJ : Exforge 5 mg/80 mg : 0,95 €(boîte de 30) ; 0,85 €(boîte de 90). Exforge 5 mg/160 mg : 1,16 €(boîte de 30) ; 1,04 €(boîte de 90). Exforge 10 mg/160 mg:
1,16 €(boîte de 30) ; 1,04 €(boîte de 90).Prendre Exforge au cours ou en dehors des repas avec un peu d'eau. L'adaptation individuelle de la dose de chacun des composants (amlodipine et valsartan) est recommandée avant de passer à
l'association à dose fixe. Le passage direct de la monothérapie à l'association à dose fixe peut être envisagé si il est cliniquement justifié. Pour des raisons de commodité, les patients qui prennent du valsartan et de l'amlodipine séparément sous forme
de comprimés ou de gélules, peuvent prendre à la place le dosage d'Exforge correspondant aux mêmes doses de ces deux composants. Altération de la fonction rénale: Aucun ajustement posologique n'est nécessaire en cas
d’altération de la fonction rénale légère à modérée. En cas d’altération modérée de la fonction rénale, surveiller les taux de potassium et de créatinine. Altération de la fonction hépatique : Attention particulière chez les patients présentant une altération
de la fonction hépatique ou des troubles dus à l'obstruction des voies biliaires. Chez les patients présentant une altération de la fonction hépatique légère à modérée sans cholestase, la dose maximale recommandée de valsartan est de 80 mg. Sujets
âgés (65 ans et plus): Une attention est requise lors de l’augmentation des doses chez les sujets âgés. Enfants et adolescents : Exforge ne doit pas être utilisé chez les patients âgés de moins de 18 ans. Contre-indications : Hypersensibilité aux substan-
ces actives, aux dihydropyridines ou à l’un des excipients. Altération sévère de la fonction hépatique, cirrhose biliaire ou cholestase. Altération sévère de la fonction rénale (DFG < 30 ml/min/1,73 m2) et patients sous dialyse. Grossesse (cf. Grossesse
et allaitement). Mises en garde spéciales et précautions d’emploi : Déplétion sodée et/ou volémique : Il est recommandé de corriger toute hypotension avant l'administration d'Exforge ou d'instaurer une surveillance médicale étroite au début du traitement.
En cas de survenue d’une hypotension avec Exforge, placer le patient en position couchée et perfuser au besoin du sérum physiologique en IV. Le traitement peut être repris, une fois la pression artérielle stabilisée. Hyperkaliémie : Précaution et contrôle
de la kaliémie si prise concomitante de suppléments potassiques, de diurétiques épargneurs du potassium, de substituts du sel contenant du potassium ou d'autres médicaments susceptibles d'augmenter les taux sériques de potassium. Sténose de
l’artère rénale : Pas de donnée concernant l'utilisation d'Exforge en cas de sténose de l’artère rénale bilatérale ou une sténose artérielle sur rein fonctionnellement unique. Transplantation rénale: Aucune expérience de la sécurité d'emploi en cas de trans-
plantation rénale récente. Altération de la fonction hépatique : Surveillance particulière chez les patients qui présentent une altération de la fonction hépatique légère à modérée ou des troubles dus à l'obstruction des voies biliaires. Chez les patients
présentant une altération de la fonction hépatique légère à modérée sans cholestase, la dose maximale recommandée de valsartan est de 80 mg. Altération de la fonction rénale : Pas d’ajustement posologique d'Exforge lors d'une altération faible à
modérée de la fonction rénale. En cas d’altération modérée de la fonction rénale, surveiller les taux de potassium et de créatinine. Hyperaldostéronisme primaire : Les patients présentant un hyperaldostéronisme primaire ne doivent pas être traités par
le valsartan (antagoniste de l'angiotensine II) ; leur système rénine-angiotensine est altéré par cette maladie. Insuffisance cardiaque : Du fait de l'inhibition du système rénine-angiotensine-aldostérone, des modifications de la fonction rénale sont à
prévoir chez les individus à risque. Chez les patients présentant une insuffisance cardiaque sévère dont la fonction rénale peut dépendre de l'activité du système rénine-angiotensine-aldostérone, le traitement par des inhibiteurs de l'enzyme de conver-
sion de l'angiotensine (IEC) ou par des antagonistes des récepteurs de l'angiotensine a été associé à une oligurie et/ou une augmentation progressive de l’urée sanguine et (dans de rares cas) à une insuffisance rénale aiguë et/ou au décès. Des résultats
similaires ont été rapportés avec le valsartan. Dans une étude à long terme de l'amlodipine, contrôlée contre placebo (PRAISE-2), réalisée chez des patients présentant une insuffisance cardiaque d'origine non ischémique de grade III ou IV de la classe
NYHA (New York Heart Association Classification), l'amlodipine a été associée à une augmentation des cas rapportés d'œdème pulmonaire ; l'incidence de l'aggravation de l'insuffisance cardiaque
versus
placebo n’était cependant pas significative.
Rétrécissement aortique et mitral, cardiomyopathie hypertrophique obstructive : Attention particulière en cas de rétrécissement aortique ou mitral ou une cardiomyopathie hypertrophique obstructive. Exforge n'a été étudié que dans la population des
patients hypertendus. Interactions avec d’autres médicaments et autres formes d’interaction : Interactions liées à l'amlodipine:
Associations nécessitant des précautions d'emploi :
- Inhibiteurs du CYP3A4. - Inducteurs du CYP3A4 (anticonvulsivants [ex. carbamazépine, phéno-
barbital,phénytoïne, fosphénytoïne, primidon], rifampicine, extrait de millepertuis).
Associations à prendre en compte :
- Autres : En monothérapie, l'amlodipine a été administrée en toute sécurité avec des diurétiques thiazidiques, des bêtabloquants, des IEC, des dérivés
nitrés d'action prolongée, la trinitrine/nitroglycérine sublinguale, la digoxine, la warfarine, l'atorvastatine, le sildénafil, des antiacides (gel d'hydroxyde d'aluminium, hydroxyde de magnésium, siméthicone), la cimétidine, des anti-inflammatoires non
stéroïdiens, des antibiotiques et des hypoglycémiants oraux. Interactions liées au valsartan :
Associations déconseillées :
- Lithium. -Diurétiques épargneurs de potassium, suppléments potassiques, substituts du sel contenant du potassium et autres substances susceptibles
d'augmenter les taux de potassium.
Associations nécessitant des précautions d'emploi :
- Anti-inflammatoires non stéroïdiens (AINS), y compris inhibiteurs sélectifs de COX-2, acide acétylsalicylique (> 3 g/jour) et AINS non sélectifs. - Autres : Aucune interaction cliniquement
significative n'a été mise en évidence entre le valsartan administré en monothérapie et les substances suivantes : cimétidine, warfarine, furosémide, digoxine, aténolol, indométacine, hydrochlorothiazide, amlodipine, glibenclamide. Interactions commu-
nes à l'association : Aucune étude d'interaction n'a été réalisée avec Exforge et d'autres médicaments.
Associations à prendre en compte :
- Autres antihypertenseurs. Grossesse et allaitement : Par précaution, Exforge ne doit pas être utilisé durant le 1er trimestre
de la grossesse. Un passage à un traitement alternatif approprié doit être réalisé à l'avance en cas de prévision d'une grossesse. Si une grossesse est découverte, Exforge doit être arrêté dès que possible. Il n’y a pas de données concernant l’utilisation
d’Exforge chez la femme enceinte. L’utilisation d’Exforge est contre-indiqué pendant le 2nd et 3ème trimestre de la grossesse. Si une exposition à Exforge a eu lieu au cours du 2nd trimestre de la grossesse, un contrôle échographique de la fonction rénale et
du crâne est recommandé. Chez les enfants exposés in utero aux antagonistes de l’angiotensine II, la survenue d’une hypotension, d’une oligurie et d’une hypokaliémie doit être étroitement suivie. Arrêter l’allaitement ou arrêter le traitement, en prenant
en compte l’importance du traitement pour la mère. Effets sur l’aptitude à conduire des véhicules et à utiliser des machines :Risque de sensations vertigineuses ou une fatigue. Effets indésirables : Les effets indésirables sont classés par fréquence, comme suit:
très fréquent (
≥
1/10) ; fréquent (
≥
1/100, < 1/10) ; peu fréquent (
≥
1/1 000, < 1/100) ; rare (
≥
1/10 000, < 1/1 000) ; très rare (< 1/10 000), y compris cas isolés. Affections cardiaques :Peu fréquent : Tachycardie, palpitations. Rare : Syncope. Affections
du système nerveux : Fréquent : Maux de tête. Peu fréquent : Sensations vertigineuses, somnolence, sensations vertigineuses posturales, paresthésie. Affections oculaires : Rare: Troubles visuels. Affections de l'oreille et du labyrinthe : Peu fréquent : Vertiges.
Rare : Acouphènes. Affections respiratoires, thoraciques et médiastinales : Peu fréquent : Toux, douleur pharyngolaryngée. Affections gastro-intestinales :Peu fréquent : Diarrhées, nausées, douleurs abdominales, constipation, sécheresse de la bouche. Affections
du rein et des voies urinaires : Rare: Pollakiurie, polyurie. Affections de la peau et du tissu sous-cutané : Peu fréquent: Eruption, érythème. Rare : Hyperhydrose, exanthème, prurit. Affections musculo-squelettiques et systémiques : Peu fréquent: Gonflement des
articulations, douleurs dorsales, arthralgie. Rare : Spasmes musculaires, sensation de lourdeur. Infections et infestations : Fréquent : Rhinopharyngite, grippe. Affections vasculaires :Peu fréquent : Hypotension artérielle orthostatique. Rare : Hypotension arté-
rielle. Troubles généraux et anomalies au site d'administration : Fréquent : œdème, œdème prenant le godet, œdème facial, œdème périphérique, fatigue, bouffées vasomotrices, asthénie, bouffées de chaleur. Affections du système immunitaire : Rare :
Hypersensibilité. Affections des organes de reproduction et du sein : Rare : Dysfonction érectile. Affections psychiatriques : Rare : Anxiété. Informations supplémentaires sur l'association: L’œdème périphérique, un effet indésirable connu de l’amlodipine, a été
généralement observé à une incidence plus faible chez les patients qui ont reçu l’association amlodipine/valsartan que ceux qui ont reçu l’amlodipine seule. L’incidence moyenne des œdèmes périphériques, calculée à partir des données obtenues avec
chaque dose, était de 5,1% avec l’association amlodipine/valsartan. Informations supplémentaires sur les composants individuels : Les événements indésirables rapportés avec l'un des composants individuels peuvent être des événements indésirables
potentiels avec Exforge, même s'ils n'ont pas été observés dans les essais cliniques de ce produit.
Amlodipine
: Les événements indésirables suivants, quelle que soit leur relation de causalité avec le médicament étudié, ont été rapportés dans les essais
cliniques avec l'amlodipine en monothérapie : le plus fréquent a été les vomissements. Les autres événements moins fréquents ont été : alopécie, troubles du transit, dyspepsie, dyspnée, rhinite, gastrite, hyperplasie gingivale, gynécomastie,
yperglycémie, impuissance, augmentation de la fréquence mictionnelle, leucopénie, malaise, modifications de l'humeur, myalgie, neuropathie périphérique, pancréatite, hépatite, thrombopénie, vascularite, angiœdème et érythème polymorphe. Des dou-
leurs angineuses, un ictère cholestatique, une augmentation des taux d'ASAT et d'ALAT, un purpura, des éruptions et un prurit peuvent survenir.
Valsartan
: Les événements indésirables suivants, quelle que soit leur relation de causalité avec le médicament
étudié, ont été rapportés dans les essais cliniques avec le valsartan administré en monothérapie dans l'indication d'hypertension artérielle: infections virales, infections des voies respiratoires supérieures, sinusite, rhinite, neutropénie, insomnie. Une
détérioration de la fonction rénale, en particulier en cas d'hypertension artérielle traitée par les diurétiques ou avec insuffisance rénale, angiœdème et une hypersensibilité (vascularite, maladie sérique) peuvent survenir. PROPRIETES PHARMACOLOGIQUES :
Propriétés pharmacodynamiques : Classe pharmacothérapeutique : antagonistes de l'angiotensine II, simples (valsartan), associations avec des dihydropyridines (amlodipine), code ATC : C09DB01 Liste I : Exforge 5 mg / 80 mg : EU/1/06/370/004 (2007) ;
CIP : 378 175.9 – boîte de 30. Prix : 28,53 €. Remb. Séc. soc. à 65%. Agréé Collect. Exforge 5 mg / 80 mg : EU/1/06/370/006 (2007) ; CIP : 378 177.1 – boîte de 90. Prix : 76,73 €. Remb. Séc. soc. à 65%. Agréé Collect. Exforge 5 mg / 160 mg :
EU/1/06/370/012 (2007) ; CIP : 378 178.8 – boîte de 30. Prix : 34,80 €. Remb. Séc. soc. à 65%. Agréé Collect. Exforge 5 mg / 160 mg : EU/1/06/370/014 (2007) ; CIP : 378 180.2 – boîte de 90. Prix : 93,78 €. Remb. Séc. soc. à 65%. Agréé Collect.
Exforge 10 mg / 160 mg : EU/1/06/370/020 (2007) ; CIP: 378 181.9 – boîte de 30. Prix: 34,80 €. Remb. Séc. soc. à 65%. Agréé Collect. Exforge 10 mg / 160 mg : EU/1/06/370/022 (2007) ; CIP : 378 183.1 – boîte de 90. Prix: 93,78 €. Remb. Séc. soc. à
65%. Agréé Collect. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE : Novartis Europharm Limited Wimblehurst Road Horsham West Sussex, RH12 5AB Royaume-Uni. Représentant local : Novartis Pharma S.A.S. : 2 et 4, rue Lionel Terray
92500 Rueil-Malmaison Tél : 01.55.47.60.00 Information et Communication Médicales : Tél : 01.55.47.66.00 icm.phfr@novartis.com.
Pour une information complète, consulter le texte intégral du résumé des caractéristiques du produit ou la monographie vidal.
FMI079-2
MLC_190X130 27/08/07 9:11 Page 1
aspirine pour une durée d’au moins un an chez les patients à
faible risque de saignement. Il est envisageable, mais cela reste
bien entendu à démontrer, qu’un autre antiagrégant plaquettaire
(en cours de développement) permette d’obtenir de meilleurs
résultats que la bithérapie actuelle. Une meilleure compréhen-
sion de la variabilité de la réponse plaquettaire sera utile, sur-
tout si l’on parvient à démontrer non seulement le lien entre
une faible réponse aux antiagrégants et une augmentation de
l’incidence des thromboses de stent, mais aussi une diminution
de cette incidence par l’augmentation des doses dans cette po-
pulation à risque. L’apport de la génétique sera peut-être décisif.
Des stents davantage biocompatibles et des polymères biodé-
gradables sont à l’étude et représentent une piste intéressante.
Reste à démontrer leur intérêt dans la diminution de la throm-
bose de stent. Des études longues seront nécessaires. Beaucoup
d’encre coulera encore avant qu’il ne soit possible d’apporter
une réponse définitive à cette question. ■
RÉfÉRences BIBLIOGRAPHIques
1. Grüntzig AR, Senning A, Siegenthaler WE. Nonoperative dilatation
of coronary-artery stenosis: percutaneous transluminal coronary angio-
plasty. N Engl J Med 1979;301:61-8.
2. Schöming A, Neumann FJ, Kastrati A et al. A randomized compa-
rison of antiplatelet and anticoagulant therapy after the placement of
coronary-artery stents. N Engl J Med 1996;334(17):1084-9.
3. Morice MC, Serruys PW, Sousa JE et al. A randomized comparison
of a sirolimus-eluting stent with a standard stent for coronary revascu-
larization. N Engl J Med 2003;349:1315-23.
4. Silber S, Albertsson P, Aviles FF et al. Guidelines for percutaneous
coronary interventions. Eur Heart J 2005;26:804-47.
5. Spaulding C, Daemen J, Boersma E, Cutlip DE, Serruys PW. A pooled
analysis of data comparing sirolimus-eluting stents with bare-metal
stents. N Engl J Med 2007;356:989-97.
6. Eisenstein EL, Anstrom KJ, Kong DF et al. Clopidogrel use and long-
term clinical outcomes after drug-eluting stent implantation. JAMA
2007;297:159-68.
7. Pinto Slottow TL, Waksman R. Overview of the 2006 Food and Drug
Administration Circulatory System Devices Panel meeting on drug-elu-
ting stent thrombosis. Catheter Cardiovasc Interv 2007;69(7):1064-74.
8. Grines CL, Bonow RO, Casey DE Jr et al.; American Heart Association,
American College of Cardiology, Society for Cardiovascular Angiogra-
phy and Interventions, American College of Surgeons, American Dental
Association, American College of Physicians. Prevention of premature dis-
continuation of dual antiplatelet therapy in patients with coronary artery
stents: a science advisory from the American Heart Association, American
College of Cardiology, Society for Cardiovascular Angiography and Inter-
ventions, American College of Surgeons, and American Dental Association,
with representation from the American College of Physicians. Circulation
2007;115(6):813-8.
LC412-ok.indd 20 25/02/08 11:06:10
1
/
4
100%