Devoir de contrôle N°2 Durée CHIMIE (7 points) Section

1
Direction régionale de Ben Arous Février 2013
---------------------------
Lycée.S.Mourouj1 Devoir de contrôle N°2
Section 4ème M3 :
Epreuve de Durée : 2 heures
CHIMIE (7 points)
Exercice N°1(3 points)
La décomposition du bromure de nitrosyle NOBr en monoxyde d’azote et dibrome est schématisée
par l'équation :
2NOBr 2NO + Br2
Tous les corps mis en jeu sont à l'état gazeux.
1- A la température 1 = 700°C, dans une enceinte de volume V1 = 1,25 L, on introduit 2 mol de
bromure de nitrosyle NOBr.
a- Compléter le tableau d’avancement sur la feuille à rendre avec les copies (0,75 pt)
b- Lorsque le système aboutit à un équilibre chimique, le nombre total de moles gazeuses dans
l’enceinte est égal à 2,5 mol.
*Déterminer l’avancement final xf1 de cette réaction (0,5 pt)
*Montrer qu’à la température 1, le taux d’avancement final est f1 = 0,5 (0,25 pt)
2-Le système est en équilibre dynamique, on chauffe l’enceinte à la température 2 =800°C,
a- Sachant qu’à la température 2, le nouvel avancement final est xf2 = 0,17 mol, déduire le caractère
énergétique de la réaction de décomposition bromure de nitrosyle et de sa réaction inverse.(1 pt)
b- Quel est l’effet de l’augmentation de la pression à température et volume constants sur
l’équilibre (0,5 pt)
Exercice N°2(4 points)
Toutes les solutions sont prises à 25°C température à laquelle le produit ionique de l’eau : Ke =10-14
On considère le couple A1/B1 tel que A1 l’acide fluorhydrique HF et B1 l’ion fluorure F-
le couple A2/B2 tel que A2 le méthylammonium CH3NH3+ et B2 le méthylamine CH3NH2 et le
couple HNO3/
-
3
NO
On donne les pKa des deux premiers couples
pKa1 = 3,17 pour le couple A1/B1
pKa2 = 10,72 pour le couple A2/B2
1-a-Ecrire les équations de la réaction de dissociation ionique dans l’eau de HF et CH3NH3+ et
donner les expressions des constantes d’équilibre Ka1 et Ka2 (1 pt)
b- Comparer les forces des acides A1 et A2 et déduire une comparaison de leurs bases
conjuguées (0,5pt)
2-On considère la réaction faisant intervenir les couples A1/B1 et A2/B2 dont l’équation est
A1 + B2 B1 + A2
a- Ecrire l’équation précédente en remplaçant A1, A2, B1 et B2 par leurs formules. (0,25 pt)
b- Donner l’expression de la constante d’équilibre K relative à cette équation, montrer
que K = 10pKa2-pKa1 et la calculer (1 pt)
3- On considère une solution aqueuse d’acide nitrique (HNO3) de concentration
C = 0,1 mol. L-1 et de pH = 1
a- Dresser le tableau d’avancement volumique (0,5 pt)
b- Montrer que HNO3 est un acide fort. (0,75 pt)

2
PHYSIQUE (13 points)
Exercice N°1(4,5 points)
On réalise le montage représenté sur la figure ci-dessous.
On donne :
La tension aux bornes du générateur : E
La capacité du condensateur : C = 2 F
L’inductance de la bobine : L
On bascule l’interrupteur K en position (1).puis en position (2)
1- Etablir l’équation différentielle relative à la tension uC(t) aux bornes du condensateur et donner
l’expression de la pulsation propre W0 de ce circuit (0,75pt)
2-a-Donner l’expression de l’énergie totale Etot du circuit (L,C) en fonction de L,C i et uC(0,5pt)
b- Montrer que l’énergie totale Etot du circuit (L,C) se conserve et donner son expression en
fonction de la f.é.m E et la capacité C. (0,75pt)
3- Déduire que uC, i, L, C et E vérifient la relation i².=
C
L
(
2
E
-
2
C
u
) (0,5pt)
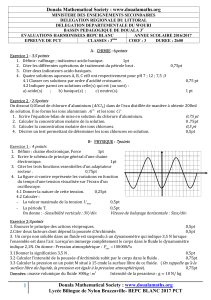
4- Un dispositif approprié nous a permis de tracer la courbe de
i² = f(
2
C
u
).
Déterminer à partir de cette courbe
a- L’inductance L de la bobine et déduire la pulsation propre W0 de ce circuit (0,75pt)
b- La tension E. (0,5pt)
c- Sachant qu’à l’origine de temps, uC =
E
2
et que le courant qui circule dans le circuit (L,C) est
négatif, donner l’expression de la tension uC en fonction du temps (0,75pt)
Exercice N°2(8,5 points)
On considère une portion de circuit constituée d’un résistor de résistance R0 en série avec une
bobine d’inductance L et de résistance interne r, un condensateur de capacité C = 40 F et un
ampèremètre de résistance supposée négligeable. Ce circuit est branché aux bornes d’un
générateur B.F délivrant une tension u(t) = UM sin (2N.t + u) de fréquence N réglable.
R0
C
A
G.B.F
(L, r)
i
M
A
B
i²(10-6A²)
2
C
u
(V²)
144
36
0
(1)
E
(2)
L
C
K

3
I-1- Représenter sur la feuille à rendre avec les copies, les connexions entre le montage et
l’oscilloscope afin de visualiser les tensions uR(t) sur la voie Y1 et uMA(t) sur la voie Y2 où le
signal est inversé ( uMA(t) est la somme des tensions aux bornes de la bobine et du
condensateur) (0,5pt)
2- Pour une fréquence N1, on observe sur l’écran de l’oscilloscope les courbes de la figure ci-
dessous et l’ampèremètre indique un courant d’intensité I = 141,4 mA.
a- Déterminer à partir des oscillogrammes, les grandeurs suivantes :
* La période T1 et déduire la fréquence N1. (0,75pt)
*Les valeurs maximales de uR(t) et uMA(t) (0,5pt)
*Le déphasage (uMA -uR ) de la tension uMA(t) par rapport à uR(t) (0,75pt)
b- Déterminer la résistance R0 du résistor
c- Sachant que l'intensité du courant i(t) est de la forme i(t) =
2
.sin(2Nt), donner les
expressions numériques de uR(t) et uMA(t). (0,25pt+0,5pt)
d- Montrer que la tension maximale aux bornes du condensateur est UCmax = 3,2V (0,5pt)
3- En utilisant la loi des mailles, établir l’équation différentielle en i(t) du courant considéré.
4-a- Sur la feuille à rendre avec les copies, on donne à l’échelle, la représentation graphique du
vecteur de Fresnel
OA
correspondant à la tension uR(t). Montrer que l’échelle utilisée est
1 cm 1 Volt (0,5pt)
b- Compléter à l’échelle, les vecteurs de Fresnel
AB
OB
et
3
V
associés respectivement aux
tensions uMA(t), u (t) et uC(t). (0,5pt)
c- Compléter les autres vecteurs de Fresnel et montrer que l’inductance de la bobine est
L = 0,023 H et que sa résistance r = 20 (0,5pt+0,5pt+0,5pt)
d- Vérifier que Umax = 12,8 V et que u =
π
10
rad (0,5pt)
e- Déterminer la puissance moyenne consommée par le circuit (0,5pt)
II- Pour une fréquence N2, les valeurs maximales de uR (t)et uMA (t) sont respectivement
URmax = 8,6V et UMAmax = 4,2 V
1- Montrer que le circuit est en état de résonance d’intensité (0,75pt)
2- Déterminer la fréquence N2 de la tension excitatrice (0,5pt)
3- Calculer le facteur de surtension Q du circuit. (0,5pt)
2
2
V
0,5 ms
uMA(t)
uR(t)

4
Nom et prénom :
………………………………..
N° :…………………
Classe :
Feuille à rendre avec les copies
Équation de la réaction
2 NOBr 2NO + Br2
État du
système
Avancement
en mol
Quantité de matière (mol)
Initial
0
0
0
Intermédiaire
x
Final
xf
Y1
Y2
R0
C
A
G.B.F
(L, r)
i
M
A
B
R0.Imax
Axe des phases
π
4
O
A
1
/
4
100%