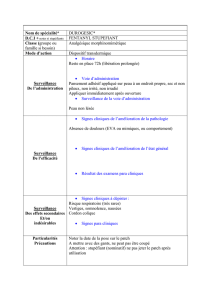
D La voie moléculaire dans la formation des carcinomes basocellulaires

La voie moléculaire
dans la formation
des carcinomes basocellulaires
Molecular pathway implicated in BCC development
N. Basset-Seguin*
* Polyclinique de dermatologie,
hôpital Saint-Louis, AP-HP, Paris ;
université Paris-7.
D
epuis 1996, grâce aux travaux réalisés
chez les patients atteints du syndrome de
Gorlin, la voie moléculaire impliquée dans
la formation des carcinomes basocellulaires (CBC)
a été identifiée : il s’agit de la voie patch/sonic/
hedgehog (1, 2).
Ces patients ont une mutation constitutive du
gène patch, ce qui explique que, dans toutes leurs
cellules, un seul allèle de patch soit normal. Il est
donc beaucoup plus facile d’inactiver l’allèle restant,
et la double inactivation est responsable de la forma-
tion de tumeur chez ces patients. Dans les carci-
nomes basocellulaires sporadiques, les deux allèles
de patch doivent être inactives, ce qui explique que
ce phénomène soit plus tardif.
Voie patch/sonic/hedgehog
et carcinomes basocellulaires
La voie patch/sonic/hedgehog contrôle la prolifé-
ration et la différenciation cellulaire au cours de
l’embryo genèse (3). Elle est composée de 2 récep-
teurs transmembranaires, PTCH et SMO. En l’absence
de son ligand hedgehog (HH), PTCH inhibe l’activa-
tion de SMO (figure 1). Lorsque le ligand HH se lie à
PTCH, il y a levée de l’inhibition de SMO par PTCH et
activation de la voie moléculaire d’aval, entraînant
l’activation, via divers protéines interactives, des
membres de la famille Gli (Gli1, Gli2, Gli3), qui sont
des activateurs transcriptionnels, et qui induisent
la transcription de divers gènes impliqués dans le
contrôle de la prolifération et la différenciation
cellulaires (figure 2).
Au cours des CBC, il y a activation de la voie surtout
par mutations inactivatrices de patch (décrites plus
haut) mais aussi par mutations activatrices de SMO
ou plus rarement de HH (figure 2, étoiles).
Molécules anti-SMO
disponibles et résultats
des essais cliniques
Il existe actuellement 2 molécules anti-SMO à
l’essai dans le traitement des CBC avancés ou
métastatiques : GDC-0449, ou vismodégib (labo-
ratoires Roche) [figure 3] et le LDE225 (laboratoires
Novartis). Les études cliniques sont plus avancées
Cet article a initialement été publié
dans
Images en Dermatologie
dejanvier-février 2014 (pp.20-21).
PTCH
Absence de signal
GLI
Inhibition de la croissance tumorale
SMO
Figure 1. Voie de signalisation hedgehog inactive.
116 | La Lettre du Cancérologue • Vol. XXIII - n° 4 - avril 2014
MISE AU POINT

Figure 2.
Voie patch activée.
PTCH
Absence de signal
GLI
Inhibition de la croissance tumorale
SMO
Vismodégib
GDC-0449
Inhibition
NHN
O
O
O
Cl
Cl
S
Figure 3. Vismodégib
(GDC-0449) inhibe SMO.
Un médiateur central
de la voie de signalisation
hedgehog.
Points forts
Highlights
»
Patch/sonic/hedgehog:
a driver pathway in the
development of BCC.
»
SMO inhibitors have
been developped for
the treatment of locally
advanced or metastatic
BCC.
»Patch/sonic/hedegehog : une voie essentielle dans le développement des CBC.
»
Des inhibiteurs de SMO ont été developpés pour le traitement des CBC localement avancés ou méta-
statiques.
avec le vismodégib, qui a été approuvé par la Food
and Drug Administration (FDA) aux États-Unis
en janvier 2012 dans l’indication : traitement des
carcinomes basocellulaires avancés ou métasta-
tiques. Plus récemment, une autorisation de mise
sur le marché (AMM) conditionnelle a été obtenue
en Europe. Les résultats d’une phase I ayant pour
objectif la tolérance, l’étude pharmacocinétique
et l’évaluation de l’efficacité du vismodégib dans
les CBC localement avancés (CBCLa) ou métasta-
tiques (CBCm) ont été publiés en 2009 (4). Dans
ce travail, 33 patients avec un CBCLa ou m ont pris
du vismodégib à 1 des 3 doses étudiées (150 mg
[n = 17], 250 mg [n = 15], 450 mg [n = 1]). Parmi
eux, 18 (54 %) patients ont eu une réponse objec-
tive clinique (n = 10), sur l’imagerie (n = 7) ou sur
les 2 (n = 1). Parmi les autres patients, 11 sont restés
stables (33 %) et 4 ont vu leur maladie progresser
(12 %).
Parmi les patients ayant un CBCLa (n = 15) et qui
avaient été suivis entre 2,1 et 19 mois au moment
de la publication, 2 (13 %) étaient en rémission
complète, 7 (46 %) en rémission partielle et 4 (26 %)
étaient stables. Enfin 2 (13 %) patients CBCLa étaient
La Lettre du Cancérologue • Vol. XXIII - n° 4 - avril 2014 | 117

en progression. La réponse globale pour les CBCLa
était de 60 % (IC95 : 33-83).
Parmi les patients CBCm, la réponse globale observée
était de 50 % (IC95 : 29-71).
Ces résultats sont remarquables étant donné l’ab-
sence de traitement de référence pour ce type de
patients qui n’avaient auparavant aucune solution.
Il n’y a pas eu, pendant l’étude, d’effet indésirable
dose limitant ou de grade 5. Parmi les effets indé-
sirables de grade 3 les plus fréquemment observés,
on notait : une hyponatrémie asymptomatique de
grade 3 ou 4, une fatigue, une perte de poids, une
dyspnée, des crampes musculaires et une fibrillation
auriculaire. Seul 1 patient est sorti de cette étude à
cause des effets indésirables.
Cette étude de phase I a donc montré la tolérabilité
et l’efficacité antitumorale du vismodégib dans le
traitement des CBCLa et m. Un essai de phase II
international multicentrique a suivi et a été publié
en 2012 (5). L’objectif primaire de cette étude
était le taux de réponse objective indépendante
du vismodégib dans les CBCLa et m (la réponse
étant évaluée par un panel d’experts indépendants
de l’essai à partir des données photographiques et
d’imagerie). Dans cette étude, 33 patients avaient
un CBCm, et leur taux de réponse indépendante
était de 30 % (IC95 : 16-48). Les patients avec un
CBCLa (n = 63) avaient un taux de réponse de 43 %
(IC
95
: 31-56), dont 13 réponses complètes (21 %).
Ces chiffres sont légèrement plus bas, à la fois pour
les CBCm et les CBCLa, que lors de l’étude de phase
I, mais cela est en partie lié à la sous-évaluation
de l’analyse indépendante qui n’a raisonné que sur
des documents photographiques.
Les effets indésirables étaient observés chez 30 %
des patients. Les plus fréquents étaient crampes,
alopécie, dysgueusie, perte de poids et fatigue,
et correspondent à ceux rapportés dans les études
de phases I et II avec le vismodégib ou avec d’autres
inhibiteurs de hedgehog (LDE225) [6]. Au moment
de la publication, environ la moitié des patients
avaient arrêté le traitement du fait d’effets indési-
rables et le temps moyen de prise du médicament
était de 10 mois dans les 2 groupes de patients
(CBCLa et m). L’arrêt du médicament était lié le
plus souvent à la progression de la maladie pour
les patients CBCm, et à la décision du patient
dans le groupe des CBCLa. Des effets indésirables
sérieux étaient notés chez 25 % des patients. Sept
décès ont été rapportés. Dans 3 cas, la cause de la
mort est restée inconnue. Dans les 4 autres cas,
le décès était dû à un choc hypovolémique, une
atteinte méningée, un infarctus du myocarde, un
accident vasculaire. Ces effets indésirables graves
sont survenus chez des patients à risque. La respon-
sabilité du vismodégib dans ces effets graves n’est
pas connue.
Ce travail a donc confirmé l’efficacité antitumorale
du vismodégib dans la prise en charge des patients
atteints de CBCLa ou m. Le problème de la tolé-
rance à long terme du vismodégib a été posé et
a justifié la mise en place de l’essai STEVIE, qui
prévoit a inclus 1 200 patients dans le monde. Cet
essai est toujours en cours. Son objectif principal
est l’évaluation de la tolérance du traitement. Son
objectif secondaire, celle de son efficacité.
Conclusion
La découverte de l’importance de la voie hedgehog
dans certains cancers, et en particulier dans les CBC,
et le développement d’inhibiteurs de cette voie ont
permis de transformer la prise en charge des formes
avancées ou métastatiques pour lesquels nous nous
trouvions dans une impasse thérapeutique. Les taux
de réponse observés sont très encourageants. ■
1. Hahn H, Wicking C, Zaphiropoulous PG et al. Mutations of the human homolog of
Drosophila patched in the nevoid basal cell carcinoma syndrome. Cell 1996;85(6):
841-51.
2. Johnson RL, Rothman AL, Xie J et al. Human homolog of patched, a candidate gene for
the basal cell nevus syndrome. Science 1996;272(5268):1668-71.
3. Ingham PW. Hedgehog signaling. Cold Spring Harb Perspect Biol 2012;4(6). pii:a011221.
4. Von Hoff DD, LoRusso PM, Rudin CM et al. Inhibition of the hedgehog pathway in advanced
basal-cell carcinoma. N Engl J Med 2009;361(12):1164-72.
5. Sekulic A, Migden MR, Oro AE et al. Efficacy and safety of vismodegib in advanced
basal-cell carcinoma. N Engl J Med 2012;366(23):2171-9.
Références bibliographiques
L’auteur déclare avoir des liens
d’intérêts avec Roche.
118 | La Lettre du Cancérologue • Vol. XXIII - n° 4 - avril 2014
La voie moléculaire dans laformation des carcinomes basocellulaire
MISE AU POINT
1
/
3
100%