Dérivées, primitives et intégrales

1
SOMMAIRE
Complément Fiche 1 ......................................................................................................... 2
Complément Fiches 4 et 8 ................................................................................................. 4
Complément Fiche 27 ....................................................................................................... 5
Complément Fiche 32 ....................................................................................................... 7
Complément Fiche 63 ....................................................................................................... 9
Complément Fiche 70 ..................................................................................................... 11
Complément Fiche 82 ..................................................................................................... 13
Complément Fiche 103 ................................................................................................... 16
Complément Fiche 150 ................................................................................................... 19
© DUNOD, Paris, 2013

2
Complément Fiche 1
Utilisation de la génétique en Neurosciences, exemple de la
Drosophile
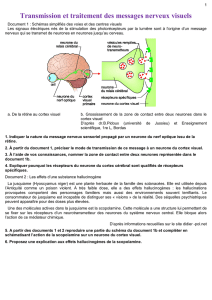
La Drosophile (ou mouche du vinaigre) présente de nombreux avantages pour la re-
cherche en Neurosciences. Son cycle biologique de 10 jours permet d’obtenir rapide-
ment un grand nombre de générations. Son génome de faible taille a été complètement
séquencé, montrant des équivalences intéressantes entre ses gènes et ceux de l’Homme.
La transgénèse est possible du fait de la présence d’éléments P ou transposons, frag-
ments d’ADN qui ont la propriété de se déplacer et de s’insérer au hasard dans le gé-
nome. Ces éléments P sont utilisés pour créer des souches mutantes, comme les souches
UAS et gal4, par exemple.
Le système UAS-GAL4 permet de diriger spécifiquement l’expression du gène X
dans un territoire donné ou à un moment donné.
Le gène gal4, présent chez la levure, code pour la protéine GAL4, facteur de trans-
cription dont on a montré qu’il est fonctionnel lorsqu’il est exprimé chez la Drosophile.
La souche de Drosophile gal4 est obtenue par injection chez l’embryon dans la zone des
cellules germinales d’un plasmide portant l’élément P et le gène gal4. L’insertion du
transposon modifié se fait alors au hasard dans le génome. L’expression de GAL4 de la
descendance se fait sous le contrôle de régions régulatrices d’un gène Y de la Droso-
phile, adjacentes au transposon véhiculant gal4. La protéine GAL4 exprimée selon le
patron d’expression du gène Y ne devient efficace qui si elle se fixe sur une séquence
UAS (Upstream Activation Sequence). Il s’agit d’une région régulatrice de l’ADN qui
fixe les facteurs de transcription. Les séquences UAS sont absentes chez la Drosophile.
Selon la même méthode de transgénèse, une souche UAS est créée pour laquelle le
transgène comporte la séquence codante d’un gène X en aval de la séquence UAS pro-
venant de la levure. Si l’on croise des mouches portant le transgène UAS-X avec des
mouches exprimant GAL4 dans des cellules particulières, les descendants du croisement
expriment le gène X dans les cellules qui expriment GAL4.
Le gène X peut être, par exemple, le gène codant pour la GFP, protéine verte fluores-
cente, ce qui permet de visualiser les cellules qui expriment GAL4 et donc de localiser
où s’exprime le gène Y. On parle dans ce cas de gène rapporteur.
Le gène X peut aussi être un effecteur dont l’expression modifie le fonctionnement
cellulaire. Par exemple il peut s’agir d’un gène codant pour un canal ionique membra-
naire (channel-rhodopsin), activé par la lumière de telle sorte que l’activité des neurones
exprimant ce canal sera déclenchée lorsque la Drosophile est soumise à une longueur
d’onde spécifique.
Le transgène shibire code pour la forme thermosensible de la dynamine impliquée
dans le recyclage vésiculaire. En portant l’organisme à 30 °C ou plus, la transmission
synaptique est bloquée dans les cellules qui expriment SHIBIRE mutant. Le blocage,
réversible par retour à une température permissive, permettra de cibler un processus
© DUNOD, Paris, 2013

3
spécifique. Il pourra être induit par exemple pendant un cycle de conditionnement, pen-
dant la consolidation de l’apprentissage ou au moment de sa restitution et l’effet sera
recherché sur les performances comportementales. Cette approche permet de déterminer
si les neurones qui expriment SHIBIRE participent aux fonctions étudiées.
Les gènes rapporteurs présentés dans le tableau 1 en association avec les techniques
d’imagerie cellulaire permettent de visualiser les neurones qui participent à une fonc-
tion.
Gènes rapporteurs Fonction impliquée
UAS-Cameleon 2.1 Rapporteur ratiométrique fluorescent du Ca
2+
intracellulaire
UAS-SpH Synaptophluorine, rapporteur fluorescent de la transmission
synaptique, sensible au pH
UAS-GCaMP Rapporteur fluorescent du Ca2+ intracellulaire ayant un fort
rapport signal sur bruit
Gènes effecteurs Effets produits
UAS-TNT Chaîne de la toxine tétanique, bloque la libération du neuro-
transmetteur
UAS-shibirets1 Bloqueur de l’endocytose des vésicules synaptiques sensible à
la température
UAS-P2X2 Récepteur à l’ATP couplé à un canal ionique stimulé par pho-
toactivation de l’ATP encagé
UAS-VR1 Récepteur vanilloïde activé par la capsaïcine
UAS-ChR2 Channelrhodopsine, canal ionique activé par la stimulation
avec une lumière bleue
UAS-PTX Toxine pertussique, inhibe la signalisation induite par la pro-
téine G0
UAS-PACα Adénylylcyclase activée par la lumière bleue, induit la synthèse
d’AMPc
L’interférence d’ARN permet l’inactivation sélective d’un gène. Le principe consiste
à induire par transgénèse, selon le principe décrit plus haut, la synthèse d’un double brin
d’ARN. Chez les organismes pour lesquels la transgénèse n’est pas possible, on peut
injecter directement le double brin dans le cerveau par exemple. Dans la cellule, le
double brin est sectionné par la protéine Dicer en brins courts d’ARN ciblant la sé-
quence d’intérêt. L’ARN interférent en se fixant sur l’ARNm dégrade la séquence
d’intérêt ou empêche sa traduction et l’expression de la protéine est partiellement inhi-
bée. La perte de fonction qui est observée renseigne sur le rôle du gène dans le proces-
sus étudié.
© DUNOD, Paris, 2013

4
Complément Fiches 4 et 8
La mort neuronale programmée
Dans de nombreuses régions du système nerveux central, la quantité de neurones formés
à l'origine est beaucoup plus importante que le nombre de neurones qui survivront au-
delà de la période de développement. Le nombre final des neurones s'ajuste au cours
d'une phase de mort cellulaire sélective qui semble faire partie intégrante du programme
de développement.
Le nombre final des cellules est directement lié au nombre de contacts fonctionnels
disponibles pour les axones des neurones en développement. Si on réduit expérimenta-
lement ce nombre, le nombre des morts neuronales est augmenté proportionnellement et
inversement si le nombre des sites disponibles est augmenté, la mort neuronale est
moins intense. Il est important de souligner que les modifications de la taille de la cible
ont des conséquences sur le nombre des cellules finales, mais aucune sur le nombre des
divisions cellulaires. Ainsi, par exemple chez les Amphibiens, le nombre de neurones
sensitifs contenus dans les ganglions rachidiens cervicaux est diminué si le membre
antérieur a été réséqué pendant l'embryogenèse. Inversement, ce nombre est augmenté si
un bourgeon de membre surnuméraire a été greffé. Des résultats analogues concernant
l'innervation motrice ont été obtenus chez le Poulet : le nombre des motoneurones con-
tenus dans la corne ventrale de la moelle épinière cervicale est accru si un bourgeon de
membre surnuméraire est greffé pendant le développement embryonnaire. Le nombre
final de neurones est donc ajusté par un contrôle de la mort cellulaire et non pas par une
régulation des mitoses.
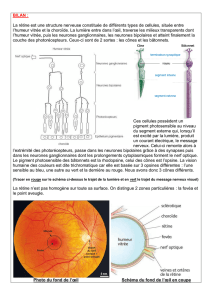
Les neurones qui meurent sont en fait ceux qui n'ont pas trouvé de cible. Chez les
Vertébrés, la survie des neurones pendant le développement dépend de manière critique
d'interactions entre le neurone et sa cible postsynaptique. Le rôle joué par la cible a été
mis en évidence notamment dans le système visuel. Les cellules ganglionnaires réti-
niennes se projettent sur les cellules du corps genouillé latéral (CGL) qui se projettent
elles-mêmes sur le cortex visuel. Une lésion du cortex visuel entraîne, avec un délai
relativement court, une dégénérescence rétrograde des neurones du CGL dont l'axone a
été coupé. Mais, quelques mois plus tard, on observe également une dégénérescence
trans-synaptique des cellules ganglionnaires de la rétine qui se projetaient sur les neu-
rones morts du CGL. On interprète ces résultats en supposant qu'un facteur trophique est
émis par le neurone postsynaptique (les neurones du CGL) en direction du neurone pré-
synaptique (les cellules ganglionnaires rétiniennes). La disparition de ce facteur entraîne
la dégénérescence du neurone pré-synaptique.
© DUNOD, Paris, 2013

5
Complément Fiche 27
Les maladies de la myéline
De nombreux axones du système nerveux central (SNC) et du système nerveux périphé-
rique (SNP) sont recouverts de myéline. Les maladies de la myéline conduisent à une
démyélinisation et une inflammation des axones, ce qui entraîne une diminution de la
vitesse de propagation du potentiel d’action axonal. La myéline est une membrane parti-
culière contenant 70 % de lipides et 30 % de protéines. Certaines protéines de la myéline
sont présentes dans le SNC et le SNP, tandis que d’autres sont spécifiques au SNC ou au
SNP.
⊃ 1. Les maladies de la myéline centrale
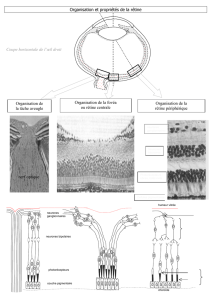
Dans le SNC, la myéline est synthétisée par les oligodendrocytes. La maladie démyéli-
nisante la plus fréquente de la myéline centrale est la sclérose en plaque (SEP). C’est
une maladie auto-immune dont l’origine exacte est inconnue. La SEP associe des fac-
teurs de risque environnementaux et génétiques de prédisposition à la maladie, avec des
facteurs déclenchant (infection virale).
Morphologiquement, la SEP se caractérise par l’apparition à la surface des axones, de
plaques où la myéline est en voie de dégénérescence (d’où son nom). Tous les axones
des neurones du SNC sont touchés, ce qui peut conduire à de nombreux troubles :
troubles de la marche, de l’acuité visuelle, troubles sensitifs, psychiques, cognitifs, etc.
Au début de l’apparition de la maladie, la SEP présente des épisodes de poussées al-
ternant avec des épisodes de rémission. Puis au bout d’une dizaine d’années, la maladie
s’installe de façon plus progressive, plus insidieuse. Cette seconde phase correspond à
une souffrance plus importante des axones, différente de l’inflammation observée lors
des poussées initiales, brutales et plus focales.
Il existe également d’autres maladies démyélinisantes auto-immunes plus rares que la
SEP, comme par exemple une maladie (la neuromyélite optique) dont la cause est la
perte d’aquaporine de type 4 dans la membrane plasmique des astrocytes. Le dysfonc-
tionnement astrocytaire entraîne alors la mort progressive des oligodendrocytes.
⊃ 2. Maladies de la myéline périphérique
Dans le SNP, la myéline est synthétisée par un certain type de cellules de Schwann. Les
maladies démyélinisantes de la myéline périphérique constituent un groupe hétérogène :
les neuropathies héréditaires sensitivo-motrices ou maladie de Charcot-Marie-Tooth et
les neuropathies apparentées.
La maladie de Charcot-Marie-Tooth(CMT) représente l’anomalie héréditaire la plus
fréquente du SNP. Plusieurs formes de la maladie existent. Une forme (CMT1A) est due
à la duplication d’un gène codant la protéine PMP22, alors qu’une autre forme(CM1B)
est due à la mutation du gène codant la protéine P0. Une troisième forme est liée au
© DUNOD, Paris, 2013
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%