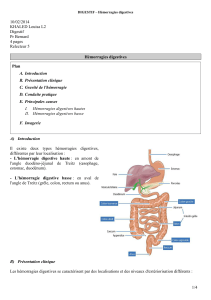
Hémorragies digestives basses

FCC1–Priseenchargedeshémorragiesd’originecolique(diverticulose,rectites,radiques,varices
rectales…)
SOMMAIRE
Président:
A.ALVES(Caen)
Modérateur:
J.‐L.FAUCHERON(Grenoble)
Lepointdevuedugastro‐entérologue
E.BARTOLI(Amiens)
Lepointdevueduradiologue
V.LEPENNEC(Caen)
Lepointdevueduchirurgien
G.LEBRETON(Caen)

FCC1–Priseenchargedeshémorragiesd’originecolique(diverticulose,rectites,radiques,varices
rectales…)
LAPLACEDEL’ENDOSCOPIEDEVANTUNEHEMORRAGIEDIGESTIVEBASSE
(HDB).
DrEricBartoli
Servicedegastroentérologie
CHUd’Amiens.
LesHDBsontdeshémorragiesdontlesiègeestclassiquementsituéenavaldel’angleduodéno‐jéjunal[1].
Dans90%descas,lacauseestcoliqueouproctologique.Ladiverticulosecoliqueetlesangiodysplasies
constituentlesprincipalescausesd’HDB.Sil’HDBdiverticulaires’arrêtespontanémentdansplusde80%des
cas,ellepeutêtregravedans10%descaspouvantengagerlepronosticvital.Laprised’AINSestunfacteurde
risqueprouvédanslasurvenued’HDBdiverticulaire[2‐6].Leterrain:âge,comorbiditésenconditionnele
pronostic.
L’interrogatoireestuneétapeessentiellepourétablirundiagnosticlésionnelprobabiliste.Laprised’AINSou
d’aspirineserarecherchéesystématiquement(diverticulose);lesATCDd’infectionVIH(coliteàCMV),
d’artériopathie,deMICI,depolypectomierécente,defacteurstraumatiques(prisedetempératurerectale,
manœuvred’extractiondesselles)etenfindecirrhose(varicerectale)serontnotés.
Lastratégieinitialeconsisteàéliminerd’embléeuneoriginehautedusaignement(instabilitéhémodynamique,
notiondeprised’AINS,syndromeulcéreuxretrouvéàl’interrogatoire),lesfistulesaorto‐digestives(ATCDde
prothèsevasculaire)etlescausesproctologiquessuspectéesparl’interrogatoirelaprésentationcliniqueet
confirméesparunexamenàl’anuscope.Enfonctiondecesdonnées,l’examendepremièreintentionsera
l’endoscopiedigestivehaute,lescanneravecinjectiondeproduitdecontrasteoulacoloscopie.
Lapriseenchargeinitialedecespatientsconsisteàrestaurerunehémodynamiqueefficaceetstable
permettantd’envisagerlaréalisationd’unbilanlésionneldequalité.Ilconvientd’apprécierlagravitéde
l’épisodehémorragiqueenrecherchantlessignesdechoc,présentsencasdepertede35%delamasse
sanguine[7].Lecaractèreactifdel’hémorragieestappréciéparlapersistancedel’instabilitéhémodynamique
ouunrendementtransfusionneldéfavorable.
Unefoislescauseshautesouvasculaireséliminées,lacoloscopieestl’examenclédanslapriseenchargede
l’épisodehémorragique.Réaliséeenurgencedansles12à24heuressuivantl’admission,ellepermetd’établir
lediagnosticétiologiquedans48à90%descas[8].L’explorationseraaidéeidéalementparuneirrigation
permanentedessegmentscoliquesàl’aidedepompeàlavage.Ledélaioptimalpourréaliserlacoloscopieainsi
queletypedepréparationcoliquerestentsujetsàcontroverse.Lesrecommandationsdel’HASpubliéesen
2006vontdanslesensd’unepréparationoraleparPEGquandl’étatdupatientlepermet[9].
Dessignesendoscopiquesd’imputabilitécoliqueàl’épisodehémorragiqueontétédécrits:hémorragieactive,
caillotadhérent,vaisseauvisible,ulcérationd’uncolletdiverticulaire.Leslésionstumorales,inflammatoiresou
ischémiquessontparfoisidentifiéescommelacausedusaignementmaisn’entrainentengénéralpasde
déglobulisationmassive.Laprésencedesangdansunsegmentcoliquen’aquepeudevaleurinformativesurle

FCC1–Priseenchargedeshémorragiesd’originecolique(diverticulose,rectites,radiques,varices
rectales…)
sitelésionnelprécisenraisondupéristaltismeexacerbélorsdesHDB.SelonFoutch[10],lesfacteursderisque
derécidivehémorragiqueoud’évolutiondéfavorablerejoignentceuxdécritspourleslésionsulcéréesdu
tractusdigestifhautdanslaclassificationdeForrest:saignementactif,caillotadhérent,vaisseauvisible.
Lediagnosticétiologiqueétabli,lacoloscopiepermettrad’effectuerungested’hémostasedansprèsde70%
descas.Lestechniquesd’hémostasevarientenfonctiondelalésionhémorragique.
Pourl’HDBdiverticulaire,lesaignementesthabituellementartérielsiégeantsoitaufonddudiverticule,soitau
niveaud’uneulcérationducollet.Ilestsouventdifficilederetrouverl’origineprécisedusaignementetle
diagnosticestsouventundiagnosticd’élimination.Si80%desdiverticulessiègentauniveauducolongauche,
50%desdiverticuleshémorragiquessontlocalisésauniveauducolondroit[11‐15].Lestechniquesthermiques,
monooubipolaires,lacoagulationauplasmad’argon(APC),lascléroseàl’adrénalinediluéeoul’interruption
d’unvaisseauvisibleparclipshémostatiquespeuventêtreproposées.Iln’existeàl’heureactuelleaucune
recommandationenfaveurdel’uneoul’autredestechniques.Bloomfeldrapportechez13maladesuntauxde
récidiveprécoceaprèstraitement(électrocoagulation+scléroseadrénalinée)de38%à1moisetunerécidive
tardivede23%[16].
Lesangiodysplasiescoliquessontresponsablesde3à12%desHDB[17‐18].Ellessiègentplusvolontiersdansle
colondroitetlecaecum.Leurtraitementreposeàl’heureactuellesurl’APCquipermetuneélectrocoagulation
monopolairesanscontactaveclamuqueusetraitéecequilimitelerisquedeperforation.Ilesthabituelde
débuterletraitementparlapériphériedelalésionetdeprogresserverssoncentre.
Leslésionsderectiteradiquetardivesurviennentchezenviron20%desmaladestraitésentre6et24mois
aprèslafindutraitement.Leslésionsapparaitraientau‐delàd’unedoseseuilde45grays.Laphysiopathologie
faitinterveniruneartériteoblitéranteetlaconstitutiond’unefibroseinterstitiellequiinduisentdeslésions
ischémiqueschroniques.Ceslésionsgénèrentunenéovascularisationsuperficiellesouslaformede
télangiectasiesresponsablesdessaignements.Denombreusesétudesontévaluél’efficacitédel’APCdans
cetteindication[19‐33].L’efficacitémoyennerapportéeestde80%surlessaignementsaprès1à3séancesen
moyenne(extrêmesde1à8).
Laprévalencedesvaricesectopiques(VE)aucoursdelacirrhoseestfaible(1à3%descas);lesVEsontplus
fréquentesencasd’hypertensionportale(HTP)extra‐hépatique(20à30%descas).LesVEsontresponsables
demoinsde5%deshémorragiesaucoursdel’HTPmaispeuventengagerlepronosticvitalenraisonde
l’importancedudébithémorragiqueetduterrainsous‐jacent.Iln’existepasderecommandationsurla
préventionprimaire,notammentparbéta‐bloqueursnoncardioselectifs,durisquehémorragique.Le
traitementendoscopiquedesVEnotammentrectalesestmalcodifiéetrelèvedel’expériencedesopérateurs.
Cetraitementesthabituellementuntraitementd’attentepermettantdecontrôlerl’hémorragieavantlamise
enplaced’unshuntporto‐cave(TIPS)oularéalisationd’uneembolisationradiologiqueduréseauvariqueuxen
cause.L’arsenalthérapeutiqueendoscopiquereposesur:l’encollageparunmélangecyanoacrilate/lipiodol
delavaricehémorragiquequandcelle‐ciestdetailleréduite(risquedemigrationdelacolle),sclérothérapieau
polidocanolenparavariqueuxetenfin,ligatureélastiquequiestleplussouventutiliséedansl’urgence[34‐35].

FCC1–Priseenchargedeshémorragiesd’originecolique(diverticulose,rectites,radiques,varices
rectales…)
Conclusions:
Lapriseencharged’unehémorragiedigestivebassecoliquereposesuruninterrogatoireminutieuxquipermet
dansunegrandemajoritédescasd’orienterlediagnostic.L’endoscopiecoliqueestl’examenderéférence,qui
permet,aprèslamiseenœuvredesmesuresderéanimationdeconfirmerlalocalisationdusitehémorragique
etd’enfairel’hémostase.L’originediverticulairedusaignementestsouventretenueenl’absenced’autre
lésionàpotentielhémorragique,sansqu’ilsoittoujourspossibled’identifierprécisémentlesitehémorragique.
Encasd’hémorragiepersistante,ilconvientalorsd’avoirrecoursauxexamensd’imagerie(TDM,artériographie
mésentérique)pourlocaliserlesegmentdigestifàl’originedusaignementetguideraumieuxlechirurgien
danssongestederésection.

FCC1–Priseenchargedeshémorragiesd’originecolique(diverticulose,rectites,radiques,varices
rectales…)
Référence:
[1]:HochainP,ColinR.EpidémiologieetétiologiedeshémorragiesaiguësenFrance.RevPrat1995;45:2277‐
82.
[2]:LangmanMJ,MorganL,WorrallA.Useofanti‐inflammatorydrugsbypatientsadmittedwithsmallorlarge
bowelperforationsandhaemorrhage.BMJ1985;290:347.
[3]:WilsonRG,SmithAN,MacintyreIM.Complicationsofdiverticulardiseaseandnon‐steroidalanti‐
inflammatorydrugs:aprospectivestudy.BrJSurg.1990Oct;77(10):1103‐4.
[4]:WilcoxCM,ClarkWS.Associationofnonsteroidalantiinflammatorydrugswithoutcomeinupperand
lowergastrointestinalbleeding.DigDisSci.1997May;42(5):985‐9.
[5]:WilcoxCM,AlexanderLN,CotsonisGA,ClarkWS.Nonsteroidalantiinflammatorydrugsareassociatedwith
bothupperandlowergastrointestinalbleeding.DigDisSci.1997May;42(5):990‐7.
[6]:AldooriWH,GiovannucciEL,RimmEB,WingAL,WillettWC.Useofacetaminophenandnonsteroidalanti‐
inflammatorydrugs:aprospectivestudyandtheriskofsymptomaticdiverticulardiseaseinmen.ArchFam
Med.1998May‐Jun;7(3):255‐60.
[7]:FaconA.Priseenchargeinitialedeshémorragiesdigestives.In:MonographiesdelaSociétéfrancophone
demédecined’urgenceedPateronD,priseenchargedeshémorragiesdigestives.Masson,Paris2002:21‐33.
[8]:ASGE.Theroleofendoscopyinthepatientswithlowergastrointestinalbleeding:Guidelinesforclinical
application.GastrointestEndosc1998;48:685‐8.
[9]:PilleulF,BucE,DupasJL,BoyerJ,BruelJM,BerdahS.Priseenchargedel’hémorragied’origine
diverticulaire.GastroenterolClinBiol2007;31:3S47‐3S52.
[10]:FoutchPG,ZimmermanK.Diverticularbleedingandthepigmentedprotuberance(sentinelclot):clinical
implications,histopathologicalcorrelation,andresultsofendoscopicintervention.AmJGastroenterol.1996
Dec;91(12):2589‐93.
[11]:McGuireHHJr,HaynesBWJr.Massivehemorrhagefordiverticulosisofthecolon:guidelinesfortherapy
basedonbleedingpatternsobservedinfiftycases.AnnSurg.1972Jun;175(6):847‐55.
[12]:McGuireHHJr.Bleedingcolonicdiverticula.Areappraisalofnaturalhistoryandmanagement.AnnSurg.
1994Nov;220(5):653‐6.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%