Gène MMR LocusN. mutations(%)

CANCER COLO-RECTAL
• Second cancer le plus fréquent.
• Âge moyen 70 ans.
• Plus de 36 000 nouveaux cas par an
• 50-60% de survie à 5 ans.
• Au stade II: 34% de récurrences.
• La chimiothérapie est prescrite dans 90 %
des cas

Cancérogenèse
6,5%: les trois mutations
38,7% une seule de ces mutations
27,1% APC et P53
61,3% P53 (chrom17)

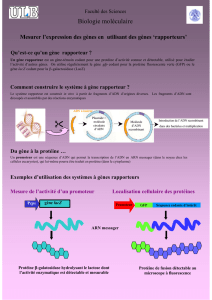
Biologie moléculaire et anatomie
pathologique
• Tout cancer est une maladie génétique
– 30 000 gènes
– Dans une tumeur, il y a 100 mutations
• 15 sont des mutations « meneuses » qui
concernent l’initiation, la progression et la survie
de la tumeur
• 80 sont des mutations « accompagnantes », reflet
de l’instabilité génique, sans impact thérapeutique,
sans sens causal.


Biologie moléculaire et anatomie
pathologique
• Cancers sporadiques : dus à des altérations somatiques, qui
s’accumulent avec le vieillissement.
• Cancers héréditaires précoces (5%; 1 personne
sur 400) dus à des altérations constitutionnelles auxquelles s’ajoutent des altérations
somatiques.
HNPCC
5% PAF
1%
A
utres CCR
familiaux
9%
CCR
sporadiques
MSI-H
15%
Autres CCR
sporadiques
70%
Cancers héréditaires
Cancers sporadiques
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
1
/
56
100%