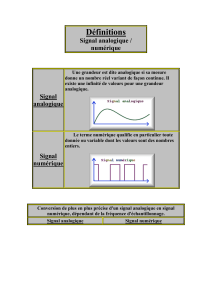
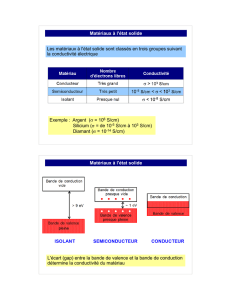
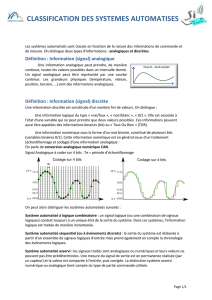
SEMICONDUCTEURS

11/09/01 Cours d ’électronique analogique 100
SEMICONDUCTEURS
I – Quelques rappels de physique atomique – Traitement classique
Dans un premier temps nous allons essayer de comprendre les différences essentielles
entre les matériaux conducteurs et les matériaux isolants. Nous montrerons que le
semiconducteur est en fait un isolant un peu particulier
Equilibre des forces :
Energie cinétique :
Energie potentielle : Ep = -eV
(V potentiel electrostatique à la distance r)
Ep = travail à fournir pour amener un
électron de l'infini à la distance r :
L'energie totale est donc :
Pour extraire un électron il faut donc lui
fournir de l'énergie.
r4
e
r
m
V
0
22
πε
πεπε
πε
=
==
=
r8 e
mV
2
1
E
0
2
C
0
πε
πεπε
πε
=
==
==
==
=
r4
e
E
0
2
pπε
πεπε
πε
−
−−
−=
==
=
r8
e
EEE
0
2
pCtot
πε
πεπε
πε
−
−−
−=
==
=+
++
+=
==
=
E
Ei
Energie
d'ionisation
Représentation planétaire
et traitement classique:
Noyau: charge >0
Electron: charge <0
e-
Noyau
V

11/09/01 Cours d ’électronique analogique 101
SEMICONDUCTEURS
Avec le traitement classique du problème toutes les énergies sont possibles
jusqu'à E
i
.
Il existe cependant un problème de taille : comme l'électron gravite il perd
de l'énergie et donc il doit s'effondrer sur le noyau au bout d'un certain temps.
Bohr : • l'électron ne peut prendre ou perdre que certaines quantité d'énergie nE
(n étant entier)
• un atome qui se trouve dans son état de plus faible énergie ne rayonne
pas (état fondamental)
• Si l'atome a été excité (au moyen d'une source d'énergie extérieure) il
retournera au niveau fondamental (se desexcitera) en émettant un photon
d'énergie E = hυoù h est la constante de Planck = 6.62 10-34 J/s et υla
fréquence.
I – Quelques rappels de physique atomique – Traitement classique
On définit ainsi des niveaux d’énergie, K, L, M, … sur lesquels on vient placer les
électrons, 2 sur le niveau K, 8 sur le niveau L, 18 sur le niveau M, etc…

11/09/01 Cours d ’électronique analogique 102
SEMICONDUCTEURS
II – Quelques rappels de physique atomique – Traitement quantique
Orbitales atomiques
On considère l'atome d'hydrogène. L'hamiltonien de l'électron dans son mouvement
autour du noyau s'écrit :
L'équation aux valeurs propres s'écrit :
H ϕ
ϕϕ
ϕ= Eϕ
ϕϕ
ϕ(Eq. de Schrodinger)
ϕ
ϕϕ
ϕ: orbitale atomique ("trajectoire")
)r(V
m2
H
2
2
r
h+
++
+∇
∇∇
∇−
−−
−=
==
=
Energie cinétique Energie potentielle dans le
champ Coulombien du noyau

11/09/01 Cours d ’électronique analogique 103
SEMICONDUCTEURS
II – Quelques rappels de physique atomique – Traitement quantique (suite)
Il existe bien sûr d'autres orbitales qu'il est impossible de représenter.
Ce sont les orbitales d au nombre de 5, les orbitales f au nombre de 7.
Chaque niveau principal (niveaux K, L, M,...) se décompose en ces différentes
orbitales.
y
x
z
Orbitale s
y
x
z
y
x
z
y
x
z
Orbitales p

11/09/01 Cours d ’électronique analogique 104
Au maximum 2 électrons peuvent se placer sur une orbitale donnée (PAULI)
Notation de physique atomique :
H 1 électron 1s
1
He 2 électrons 1s
2
.
.
B 5 électrons 1s
2
2s
2
2p
1
.
Si 14 électrons 1s
2
2s
2
2p
6
3s
2
3p
2
etc …
SEMICONDUCTEURS
II – Quelques rappels de physique atomique – Traitement quantique (suite)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
1
/
48
100%