John C. Willison CEA Grenoble BRGM Orléans / ARD Reims Contexte et Objectifs

Coordinateur: John C. Willison
Partenaires: CEA Grenoble / CNRS-LEPMI Grenoble / IRD Marseille /
BRGM Orléans / ARD Reims
Combustible non carboné et propre, hautement réactif et à forte densité
énergétique, l'hydrogène est considéré comme le vecteur énergétique du futur. Sa
conversion directe en électricité, via les piles à combustible, constitue un atout,
dans la mesure où le rendement énergétique de ces piles est élevé (80%) avec
l’eau pour seul rejet. Sur le plan économique, l’hydrogène représente un marché
qui croît de 10 % par an au niveau mondial et qui devrait représenter 8 à 10% de
l'énergie mondiale en 2025. Aujourd’hui, l’essentiel de l’hydrogène vendu sur le
marché est produit industriellement avec des procédés physico-chimiques très
énergivores (vaporeformage du méthane, oxydation partielle de combustible
fossile ou électrolyse de l'eau). En revanche, les voies de production biologiques
offrent des solutions technologiques potentiellement moins coûteuses en termes
de bilan énergétique et plus respectueuses pour l’environnement. Parmi ces
solutions, les bioprocédés associant fermentation à haute température (80°C) et
photofermentation présentent comme avantages, non seulement de produire de
l’hydrogène facilement « purifiable » à partir du biogaz produit, mais aussi de
dépolluer un effluent riche en hydrates de carbone tout en ne produisant que très
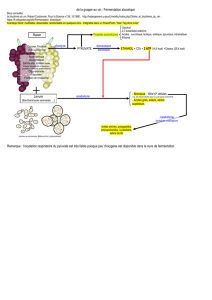
peu de déchets solides. Le projet HYCOFOL_BV a pour objectif de proposer un
bioprocédé de production d’hydrogène à partir de paille de blé, un sous-produit
d’origine agricole.
Contexte et Objectifs
Méthodologie et Résultats
Le projet s’articule autour de trois approches : recherche fondamentale
(protéomique et ingénierie métabolique), génie des procédés (bioréacteurs et
plans d’expériences) et microbiologie moléculaire (FISH, SSCP).
Les premiers objectifs (livrables à T0+6mois et jalon à T0+12mois) ont été
atteints: caractérisation physico-chimique de la paille de blé prétraitée (ARD) ;
définition d’un milieu synthétique représentatif du substrat industriel pour
l’optimisation de la fermentation à haute température (IRD) ; caractérisation
microbiologique de la paille de blé hydrolysée ou micronisée (BRGM); choix de la
meilleure souche hyperthermophile (IRD). Un quatrième livrable – mise au point
de sondes spécifiques (BRGM) - est en cours de réalisation.
Thermotoga maritima a été sélectionné, parmi les 17 espèces
hyperthermophiles testées, pour des études d’optimisation en bioréacteur.
Néanmoins, deux autres espèces, T. naphtophila et T. neopolitana, ont montré des
taux de production d’H2 intéressants à partir de la paille de blé micronisée.
La méthode des plans d’expériences est utilisée pour optimiser la
photoproduction d’H2 à partir de l’acétate en fonction de différents paramètres:
concentration en substrat, Fe, Mo, intensité lumineuse et la nature du tampon.
Deux plateformes expérimentales ont été ont été construites qui permettent la
réalisation simultanée de 45 expériences. Les plans d’expériences seront
réalisées sur la souche Rhodobacter capsulatus B10, ainsi que sur des mutants
dérivés de cette souche et sur d’autres espèces de bactéries photosynthétiques.
Les premiers résultats indiquent que, dans certaines conditions (non encore
optimisées) la bactérie hyperthermophile, Thermotoga maritima, ainsi que la
bactérie photosynthétique Rhodobacter capsulatus, peuvent convertir leur
substrats respectifs en H2 avec des efficacités proches de 70%. Les analyses
microbiologiques de la paille de blé indiquent l’absence de bactéries susceptibles
de proliférer dans ou de traverser l’étage hyperthermophile. Cependant, les outils
moléculaires sont en place pour pouvoir suivre l’état microbiologique des deux
étages lors des expériences d’optimisation.
La deuxième partie du projet concernera l’optimisation des étages de fermentation
à haute température et de photofermentation. L’optimisation sera réalisée, d’abord
sur du milieu synthétique, et ensuite sur le substrat industriel (fermentation hyper
thermophile) et sur l’effluent de la fermentation à haute température
(photofermentation) en tenant compte des contraintes posées par la composition
du substrat initial et la composition de l’effluent fourni par la première étape. Outre
le choix des souches et l’optimisation des paramètres physico-chimiques, l’étude
de la photoconversion de l’acétate en H2 permettra l’amélioration de la souche
photosynthétique par ingénierie métabolique. A plus long terme, les deux étages
seront intégrés dans un procédé couplé pour la production biologique d’hydrogène
à partir d’un déchet agricole.
Conclusions et Perspectives
john.willison@cea.fr
CONTACT
1
2
2
3
C6H12O6 + 6H2O -------> 6CO2 + 12 H2 Minéralization du glucose (procédé couplé)
C6H12O6 + 2H2O -------> 2CH3COOH + 2CO2 + 4H2 Fermentation hyperthermophile
2CH3COOH + 4H2O -------> 4CO2 + 8H2 Photofermentation
Rendement attendu: > 75% pour le procédé globale (> 9 mol H2/mol glucose) L’utilisation de l’acétate comme substrat pour la photoproduction d’H2 a été
peu étudiée par rapport à d’autres substrat, comme le lactate. Une étude de
protéomique a été entamée afin d’identifier les protéines qui sont synthétisées
de manière différente (1) dans des cellules cultivées sur acétate par rapport au
lactate; (2) dans le mutant IR3, dérivé de la souche B10, qui est surproducteur
d’H2 mais chez lequel la mutation n’a pas encore été identifiée.
4
1
/
1
100%