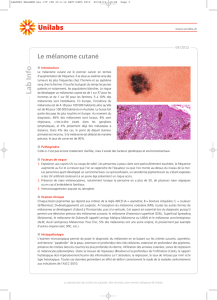
Voies de signalisation du mélanome et génotypage

FC
AC
AMPc
PKA
CREB
MITF
BRAF
MEK
ERK
Prolifération/différenciation/survie
PI3KPTEN
AC : Adenylyl Cyclase ; AMPc : AMP cyclique ; CREB : cAMP Responsive Element Binding Protein ;
ERK : Extracellular signal-Regulated Kinase ; FC : facteur de croissance ; MEK : Mitogen-activated ERK Kinase ;
MITF : MIcrophtalmia-associated Transcription Factor ; MSH : Melanocyte Stimulating Hormone ;
mTOR : mammalian Target Of Rapamycin ; PI3K : phosphatidylinositol 3-kinase ; PKA : Protein Kinase A ;
PTEN : Phosphatase and TENsin homolog located on chromosome 10 ; RAS : RAt Sarcoma ;
RTK : récepteur à activité tyrosine kinase.
RAS MC1R
R
T
K
R
T
K
AKT
mTOR
ATP
α-MSH
Figure 1. les trois voies de signalisation majeures impliquées dans le développement des
mélanomes. La voie PI3K (gauche), la voie MAPK (centre) et la voie de l’AMPc (droite).
Les protéines indiquées en orange sont codées par des gènes fréquemment mutés ou
amplifiés dans les mélanomes cutanés.
536 | La Lettre du Cancérologue ̐ Vol. XX - n° 9 - novembre 2011
DOSSIER THÉMATIQUE
Oncodermatologie
Les voies de signalisation
activées dans le mélanome
et les principes actuels
du génotypage
Signalling pathways activated in melanoma
and the current principles of genotyping
N. Dumaz*, S. Mourah**
* Inserm U976 ; UMR-S 976, UFR de
médecine Paris-Diderot, Paris.
** Laboratoire de pharmacogéno-
mique, hôpital Saint-Louis, Paris ;
Inserm U940, Paris ; UMR-S 940,
université Paris-Diderot, Paris.
L
e mélanome cutané, tumeur issue des mélano-
cytes, est devenu un problème majeur de santé
publique dans de nombreux pays. À un stade
précoce, le mélanome sous une forme localisée
est curable par exérèse chirurgicale. Néanmoins, à
un stade avancé, le mélanome est de très mauvais
pronostic, car les formes métastatiques sont résis-
tantes aux chimiothérapies. Par conséquent, l’iden-
tification des cibles moléculaires pour le diagnostic
et le traitement des patients au stade métastatique
est d’une importance particulière et a été récem-
ment l’objet d’intenses recherches. De nombreuses
altérations génétiques ont été décrites ces dernières
années dans le mélanome cutané, permettant de
mettre en évidence de nouvelles cibles thérapeu-
tiques potentielles. Au moins 3 voies de transduction
du signal sont impliquées dans la mélanogenèse : la
voie des MAPK (Mitogen-Activated Protein Kinases),
celle de la PI3K (phosphatidylinositol 3-kinase) et
celle de l’AMPc (AMP cyclique) [figure 1]. Leurs
implications dans le développement des mélanomes,
leur intérêt thérapeutique et les principes du géno-
typage sont détaillés ci-dessous.
La voie MAPK
La voie MAPK est activée en aval de la plupart des
récepteurs des facteurs de croissance (FC). C’est une
cascade essentielle de signaux de transduction qui
contrôle la survie, la croissance et la différenciation
cellulaire, mais aussi la transformation tumorale (1).
L’activation de la voie MAPK est initiée par les récep-
teurs à activité tyrosine kinase (RTK). Ces derniers
sont des protéines transmembranaires formées d’un
domaine amino-terminal qui lie le ligand extracellu-
laire et d’un domaine carboxy-terminal qui possède
une activité tyrosine kinase. La liaison du ligand à son
RTK induit l’activation du récepteur, qui se traduit

La Lettre du Cancérologue ̐ Vol. XX - n° 9 - novembre 2011 | 537
Points forts
»
Le mélanome est un cancer de la peau dont l’incidence augmente de façon constante. La découverte récente
d’altérations génétiques fréquentes et récurrentes dans les mélanomes cutanés permet une classi fication
moléculaire de ces tumeurs en sous-groupes distincts, ouvrant ainsi la voie à la thérapie ciblée.
»
Plusieurs voies de signalisation telles que MAPK, PI3K, AMPc et cyclineD1/CDK4 sont impliquées dans la
progression de cette maladie et sont affectées par certaines mutations oncogéniques. Dans chaque voie, plusieurs
cibles thérapeutiques potentielles ont été identifiées, et des inhibiteurs spécifiques sont en développement.
»
Certains inhibiteurs, comme ceux ciblant c-KIT ou BRAF, ont montré une certaine efficacité dans des essais
cliniques et devraient rapidement être utilisés en clinique. Malheureusement, certains sous-groupes de
mélanomes, comme ceux présentant des mutations de RAS, n’ont pas encore de traitement ciblé approprié.
»Nous commençons tout juste à comprendre comment les différentes voies de signalisation activées dans
les mélanomes interagissent entre elles, mais il est clair qu’il va être nécessaire de combiner plusieurs inhi-
biteurs pour obtenir une efficacité thérapeutique à long terme.
Mots-clés
Mélanome
Voies de signalisation
Inhibiteurs
Thérapie
Génotypage
Highlights
»
Melanoma is a deadly skin
cancer, the incidence of which
has been increasing world-
wide. The recent discovery of
frequent and recurrent genetic
alterations in cutaneous mela-
noma allows a molecular clas-
sification of these tumours into
distinct subgroups, opening the
road to oncogene-targeted
therapy.
»
Several signalling pathways
are involved in the progression
of this disease, with oncogenic
mutations affecting the MAPK,
the PI3K, the cAMP and the
cyclin D1/ CDK4 pathways. In
each pathway, several potential
therapeutic targets have been
identified, and specific inhibi-
tors are under development.
»
Some drugs, such as those
targeting c-KIT or BRAF, are
showing promising clinical
activity and are quickly moving
into the clinics. However, some
melanoma subgroups, such as
those with RAS mutations,
are still without appropriate
therapy.
»
We are just beginning to
understand the interplays
between the different signal-
ling pathways, but it is clear
that we will need to develop
appropriate combination
therapy strategies to achieve
long-term clinical efficacy.
Keywords
Melanoma
Signalling pathways
Inhibitors
Therapy
Genotyping
par l’autophosphorylation de résidus tyrosine dans
le domaine intracellulaire. Ces tyrosines phospho-
rylées servent de sites de liaison pour des protéines
adaptatrices responsables de l’activation de plusieurs
molécules et donc de plusieurs voies de signalisa-
tion (figure 1, p. 536) [2]. Dans les mélanocytes,
la voie MAPK est activée par différents facteurs de
croissance et stimule la prolifération cellulaire (3).
La situation est différente dans le mélanome, où la
voie MAPK est activée de façon constitutive dans
la majorité des tumeurs grâce à l’acquisition d’une
mutation dans l’une des protéines de la voie MAPK,
comme détaillé ci-dessous.
Le récepteur c-KIT
c-KIT est le récepteur du SCF (Stem Cell Factor),
qui joue un rôle central dans le développement de
multiples lignées cellulaires, dont les mélanocytes.
Ainsi, les mutations qui inactivent le récepteur sont
associées aux taches blanches dépigmentées que l’on
retrouve dans le piébaldisme chez l’homme et chez
la souris “Dominant White Spotting” (4). La liaison
du SCF à c-KIT induit l’activation du récepteur et
l’autophosphorylation des résidus tyrosine spéci-
fiques dans la partie intracellulaire du récepteur. Ces
acides aminés phosphorylés sont des sites d’accueil
pour différentes protéines, qui à leur tour contrôlent
plusieurs voies de signalisation intra cellulaire, dont
les voies MAPK et PI3K. Jusqu’à récemment, les
données publiées suggéraient que c-KIT agissait
comme un gène suppresseur de tumeur dans le
mélanome, puisque son expression est réduite ou
perdue lors de la progression tumorale du méla-
nome vers les stades invasifs et métastatiques (5).
Cependant, il a récemment été démontré que
certains mélanomes surexpriment c-KIT, y compris
dans des lésions métastatiques, et des mutations
activatrices de c-KIT ont récemment été identifiées
dans moins de 3 % des mélanomes (6). Bien que
globalement rares, les mutations de c-KIT sont plus
fréquentes dans les mélanomes muqueux, acraux
et les mélanomes survenant sur peau avec élastose
solaire (Chronic Sun Damage ou CSD melanoma). Ces
mutations affectent le domaine juxta-membranaire
du récepteur. Ces résultats sont importants sur le
plan thérapeutique, puisque les tumeurs de type
tumeurs stromales gastro-intestinales (GIST), ayant
une mutation de domaine juxta-membranaire de
c-KIT, répondent à un inhibiteur de c-KIT (7), suggé-
rant que les mélanomes porteurs d’une mutation
de c-KIT pourraient être traités par un tel inhibiteur.
En effet, les formes mutées de c-KIT sont capables
de transformer des mélanocytes en culture, et ces
cellules transformées sont très sensibles à l’ima-
tinib, un inhibiteur de c-KIT qui inhibe leur proli-
fération (8). Plusieurs inhibiteurs de c-KIT sont en
cours de développement clinique pour différentes
tumeurs, dont le mélanome (tableau I).
La petite GTPase RAS
Les protéines RAS sont des petites GTPase qui
forment le lien essentiel entre le RTK et l’activation
de la voie MAPK. La protéine RAS agit comme un
interrupteur moléculaire : elle est “on” lorsqu’elle est
liée au GTP (guanine triphosphate) et “off” quand elle
est liée au GDP (guanine diphosphate). Après activa-
tion d’un RTK, le complexe protéique Shc/Grb2/SOS
s’y fixe et stimule le remplacement du GDP par le
GTP sur RAS, l’activant ainsi (9). Les réponses cellu-
laires à l’activation de RAS sont variées du fait que
Tableau I. Inhibiteurs de kinases en développement clinique.
Cibles Inhibiteurs en développement clinique
c-KIT Imatinib, nilotinib, sunitinib, dasatinib
RAF PLX4032/vémurafenib, GSK2118436,
XL281/BMS-908662, Raf265/Chir-265, SB-590885
MEK PD0325901, AZD6244, AZD3844, AZD8330,
RDEA119, GDC-0973/XL518, GSK1120212,
RO4987655
AKT GSK2141795, MK2206, GSK690693,
perifosine/KRX-0401, VQD-002, TCN-PM/VD-0002
mTOR Rapamycine/sirolimus, Rad001/évérolimus,
CCI-779/temsirolimus, MK8669/ridaforolimus,
BEZ235*, XL765/SAR245409*, GSK2126458*,
BGT226*, AZD8055, OSI-027, SF1126*
PI3K GDC0941, BEZ235*, BKM120,
XL147/SAR245408, XL765/SAR245409*,
GSK2126458*, PX-866, SF1126*, BGT226*
CDK4 PD0332991, LY2835219, LEE011, P1446A-05
* Inhibent à la fois mTOR et PI3K.

538 | La Lettre du Cancérologue ̐ Vol. XX - n° 9 - novembre 2011
Les voies de signalisation activées dans le mélanome
et les principes actuels dugénotypage
DOSSIER THÉMATIQUE
Oncodermatologie
la protéine RAS associée au GTP peut lier plusieurs
protéines effectrices, telles que les protéines RAF,
PI3K, RalGDS et phospho lipase Cε (10). Il y a
3 protéines RAS très similaires, HRAS, KRAS et NRAS,
et les mutations des acides aminés 12, 13 ou 61 de
l’une des 3 protéines RAS les convertissent en onco-
gènes. Ces mutations inhibant l’activité GTPase des
protéines RAS, celles-ci, liées en permanence au GTP,
sont donc actives de façon constitutive. Environ 20 %
des mélanomes présentent une mutation d’un gène
RAS et, dans la plupart des cas, cette mutation est
située au niveau du codon 61 de NRAS (Q61R ou
Q61K) [11]. Les protéines RAS ont plusieurs effec-
teurs qui peuvent contribuer aux propriétés oncogé-
niques de la forme mutée RAS (figure 1, p. 536). La
présence de mutations de RAS ou de RTK en amont
de RAS suggère que la protéine RAS pourrait être
une bonne cible thérapeutique pour le traitement
du mélanome. Les seuls agents développés à ce jour
qui affectent l’activité de RAS sont les inhibiteurs
de farnésyl transférase (FTI). Ces agents inhibent
la modification post- traductionnelle des protéines
RAS, empêchant de fait leur localisation membra-
naire, qui est nécessaire à leur activité (12). Un grand
nombre de FTI très efficaces ont été identifiés (13),
mais la farnésylation n’étant pas un processus propre
aux seules protéines RAS, l’utilisation de ces inhi-
biteurs est limitée par leur manque de spécificité.
Les protéines RAS pouvant donc difficilement être
ciblées par des inhibiteurs spécifiques, les recherches
actuelles s’orientent plutôt vers des cibles impliquées
dans les voies de signalisation activées en aval de
RAS comme RAF, MEK, PI3K, AKT ou mTOR, qui sont
impliquées dans les voies MAPK et PI3K. Au sein
d’une même voie de signalisation, les mutations sont
mutuellement exclusives : c’est le cas, par exemple,
des mutations de c-KIT, NRAS et BRAF, qui toutes 3
activent la voie MAPK et ne sont quasiment jamais
retrouvées de façon concomitante dans les méla-
nomes (6, 11).
Les kinases de la famille RAF
Les protéines RAF sont des sérine/thréonine kinases
qui jouent un rôle pivot dans la voie MAPK. La famille
des kinases RAF est composée de 3 membres :
ARAF, BRAF et CRAF (également appelé Raf-1), qui
partagent une architecture commune et qui sont
soumis à une régulation complexe (14). Les protéines
RAF sont recrutées à la membrane plasmique par
liaison directe aux protéines RAS actives et sont acti-
vées en plusieurs étapes. Les protéines RAF phospho-
rylent et activent une protéine kinase appelée MAPK/
ERK kinase (MEK), qui à son tour active une troisième
protéine kinase appelée ERK. ERK est elle-même
une protéine kinase qui phosphoryle de nombreuses
cibles, notamment des facteurs de transcription,
régulant ainsi l’expression de nombreux gènes
(figure 1, p. 536). Le gène BRAF, qui est impliqué
dans la voie MAPK, est muté dans 50 à 70 % des
mélanomes cutanés (15). La mutation la plus
commune se trouve dans le domaine kinase de
BRAF, avec une substitution de la valine en gluta-
mate au codon 600 (V600E) représentant 80 %
des mutations observées (16). La protéine mutante
BRAFV600E active la voie MAPK de façon constitutive,
stimulant la prolifération et la survie cellulaires, qui
sont essentielles à la croissance tumorale (17, 18).
La protéine mutante BRAFV600E contribue également
à la néoangiogenèse en provoquant l’expression et
la sécrétion autocrine du VEGF (Vascular Endothe-
lial Growth Factor) [19]. La présence fréquente de
mutations de BRAF dans le mélanome fait de cette
protéine une cible attrayante dans cette pathologie.
Plusieurs inhibiteurs de RAF ont été développés.
Ils sont de 2 sortes : d’une part, des inhibiteurs de
classe I, qui agissent spécifiquement sur la protéine
mutante BRAF
V600E
; d’autre part, des inhibiteurs
de classe II, qui inhibent toutes les protéines RAF.
Les inhibiteurs de classe I incluent le vémurafénib,
XL281 et GSK2118436, qui sont des inhibiteurs spéci-
fiques de la protéine mutée BRAF
V600E
et qui ont
montré leur efficacité dans des modèles précliniques
(tableau I, p. 537) [20]. Leur activité clinique est en
cours d’étude, et les résultats des essais cliniques
sont présentés dans l’article “Résultats et pers-
pectives des thérapies ciblées” (p. 572). Le premier
inhibiteur de RAF de classe II a avoir été testé en
clinique fut le sorafénib. Cet inhibiteur a démontré
une certaine efficacité dans des modèles précliniques
de mélanomes (18), mais les résultats cliniques ont
été décevants en raison de la capacité du sorafénib
à inhiber un large spectre de kinases, augmentant
ainsi sa toxicité (21, 22). Cependant, d’autres inhi-
biteurs ciblant toutes les kinases RAF sont en cours
de développement clinique et ne devraient pas être
négligés, en particulier pour cibler les mélanomes
mutés sur RAS dans lesquels la protéine CRAF joue
un rôle prédominant (23). Par ailleurs, MEK étant le
seul substrat décrit de BRAF, c’est une cible théra-
peutique intéressante pour les mélanomes mutés
sur BRAF. Dans des modèles précliniques, les inhi-
biteurs de MEK induisent une réduction significative
de la croissance du mélanome (24). Néanmoins,
ces inhibiteurs n’ont pas, jusqu’à présent, montré

La Lettre du Cancérologue ̐ Vol. XX - n° 9 - novembre 2011 | 539
DOSSIER THÉMATIQUE
une efficacité significative sur les mélanomes dans
les essais cliniques, leur toxicité limitant la dose
maximale utilisable (24). Une nouvelle génération
d’inhibiteurs de MEK est en développement clinique
(tableau I, p. 537). Si leur toxicité est limitée, ces
inhibiteurs pourraient être utiles pour traiter des
patients ayant acquis la résistance aux inhibiteurs
de BRAF (25).
La voie PI3K
La PI3K est à la fois un effecteur de RAS et un
effecteur direct des RTK. Une fois activée, la PI3K
convertit le PIP2 (phosphatidylinositol 4,5 phos-
phate) en PIP3 (phosphatidylinositol 3,4,5 phos-
phate), qui, en fixant les protéines ayant un domaine
PH (Pleckstrin Homology), régule leur localisation
et leur activité (figure 1, p. 536) [26]. Les protéines
AKT (AKT1, AKT2 et AKT3), appelées aussi protéines
kinase B, contiennent un tel domaine PH et sont les
effecteurs les plus connus de PI3K. Les protéines
AKT ont de nombreuses cibles, et en particulier
plusieurs protéines associées à l’apoptose, comme
la caspase 9 et BAD (27). Ainsi, lorsqu’elle est activée,
la voie PI3K/AKT protège les cellules de l’apoptose. Il
n’est donc pas étonnant de retrouver une activation
constitutive de cette voie de signalisation dans de
nombreux cancers, dont les mélanomes. La voie PI3K
est régulée négativement par la lipide phosphatase
PTEN (Phosphatase and TENsin homolog located on
chromosome 10) qui déphosphoryle PIP3, inhibant
ainsi l’activation des protéines AKT par PI3K (28).
Des délétions partielles ou totales du gène PTEN
ont été décrites dans 30 à 50 % des mélanomes,
et des mutations ponctuelles dans 10 % d’entre
eux (29, 30). Par ailleurs, l’activation constitutive
de la protéine AKT3, l’isoforme pré dominante AKT
dans le mélanome, a été récemment retrouvée
dans plus de 60 % des mélanomes (31), soulignant
l’importance de l’activation de la voie PI3K dans leur
développement. In situ, l’expression des protéines
AKT phosphorylées et donc actives est importante
dans les mélanomes invasifs et les métastases, et est
inversement corrélée à la survie des patients (32).
Plusieurs systèmes modèles ont montré que l’inhibi-
tion de la voie PI3K/AKT agissait sur la croissance des
cellules de mélanome en culture et in vivo, démon-
trant que cette voie était une cible thérapeutique
intéressante pour le traitement du mélanome (31).
L’inhibition pharmacologique des composants de
la voie PI3K vise les protéines PI3K, AKT mais aussi
mTOR (mammalian Target Of Rapamycin), une cible
des protéines AKT, impliquée dans la régulation de
la traduction des protéines et le cycle cellulaire
(tableau I, p. 537) [33].
Il est important de noter que les mutations du
gène BRAF, en particulier la mutation V600E, sont
également observées dans les nævus bénins, ce qui
suggère que la mutation de BRAF n’est pas suffi-
sante pour transformer les mélanocytes (34). Ainsi,
plusieurs altérations génétiques sont nécessaires au
développement des mélanomes. Dans un modèle
de souris transgénique, la mutation V600E de BRAF
coopère avec la perte de PTEN pour induire des
mélanomes (35). Par ailleurs, les mutations de BRAF
sont fréquemment associées à la perte de PTEN dans
les mélanomes humains. Ces données suggèrent
que la voie MAPK et la voie PI3K coopèrent lors du
développement des mélanomes et qu’il sera néces-
saire de cibler de façon concomitante ces 2 voies de
signalisation pour traiter les mélanomes de façon
durable. En effet, plusieurs publications montrent
que cibler à la fois la voie MAPK et la voie PI3K est
plus efficace pour inhiber la prolifération des méla-
nomes que cibler seulement l’une des 2 voies (36).
Des essais cliniques allant dans ce sens sont en cours.
La voie de l’AMPc et MITF
La voie de l’AMPc est stimulée par des hormones
mélanotropes produites par les kératinocytes comme
l’α-MSH (alpha-Melanocyte Stimulating Hormone), qui
se lie au récepteur MC1R (Melanocortin 1 Receptor)
et stimule la production d’AMPc. L’AMPc active la
protéine kinase A (PKA), qui phosphoryle et active
le facteur de transcription CREB (cAMP Responsive
Element Binding Protein), qui à son tour, stimule l’ex-
pression de la protéine MITF (figure 1, p. 536) [37]. La
protéine MITF est un facteur de transcription situé au
centre de multiples voies de signalisation contrôlant
la différenciation, la morphologie, la prolifération et
la survie des différentes cellules de la lignée méla-
nocytaire : les mélanoblastes, les mélanocytes et les
mélanomes (38). Il a récemment été montré que le
gène MITF était amplifié dans environ 20 % des méla-
nomes, mais pas dans les nævus (39). L’amplification
de MITF est corrélée à une diminution de la survie
globale des patients. L’expression ectopique de MITF
coopère avec la protéine mutante BRAF
V600E
pour
transformer des mélanocytes humains, démontrant
que MITF peut agir comme un oncogène dans le méla-
nome (39). L’inhibition de l’expression de MITF induit
l’apoptose des lignées de mélanomes dans lesquelles
le gène MITF est amplifié, mais aussi des lignées dans

Figure 2. La demande
de génotypage dans les
mélanomes, réalisée en
3 étapes, selon les moda-
lités établies par l’INCa.
Le clinicien prescripteur
du génotypage remplit la fiche
dédiée téléchargeable sur le
site Internet de la plate-forme
de génétique moléculaire
de son secteur
Cette demande est transmise
au médecin anatomopathologiste
qui détient le prélèvement
tumoral
Le médecin anatomopathologiste
envoie cette fiche accompagnée
de la tumeur au laboratoire
réalisant le génotypage
Le laboratoire réalise le test
et envoie les résultats
au clinicien prescripteur
et anatomopathologiste
qui lui a adressé le prélèvement
540 | La Lettre du Cancérologue ̐ Vol. XX - n° 9 - novembre 2011
Les voies de signalisation activées dans le mélanome
et les principes actuels dugénotypage
DOSSIER THÉMATIQUE
Oncodermatologie
lesquelles il ne l’est pas (39, 40). La protéine MITF est
donc une cible potentielle dans le mélanome, mais
moduler son activité in vivo semble encore difficile.
La voie p16/CDK4
La protéine p16 (CDKN2A) régule le cycle cellulaire
à travers son interaction avec la kinase CDK4. En
effet, alors que la protéine kinase CDK4 s’associe à
la cycline D1 pour stimuler la progression du cycle
cellulaire, la protéine p16, en se liant à CDK4,
inhibe le cycle cellulaire. Les mutations germinales
du gène p16 prédisposent au développement du
mélanome, et des mutations ou délétions soma-
tiques de p16 sont des événements fréquents dans le
mélanome (41). Des mutations activatrices de CDK4
ont été décrites dans le mélanome familial ainsi que
dans des cas sporadiques de mélanome (42). Enfin,
l’amplification des gènes codant pour la cycline D1
ou CDK4 a été observée dans un sous-ensemble de
mélanomes (43). Ces données démontrent que l’acti-
vité du complexe CDK4/cycline D1 est un élément
important dans la transformation des mélanocytes,
et par là même que CDK4 est une cible thérapeutique
dans le mélanome. Des inhibiteurs spécifiques de
CDK4/CDK6 qui sont en développement préclinique
et clinique pourraient avoir un intérêt thérapeutique
dans certains mélanomes (tableau I, p. 537).
Génotypages
dans les mélanomes : outils
d’orientation thérapeutique
Développement
de la médecine personnalisée
et de la pharmacogénomique
en oncologie
La caractérisation moléculaire de la tumeur devient
un critère déterminant dans le choix de la stratégie
thérapeutique, qui ne repose plus seulement sur
le type et le stade de la maladie. Elle permet un
accès optimal aux thérapies ciblées : un traitement
n’est prescrit qu’aux seuls patients susceptibles
d’en bénéficier, et un traitement inutile, toxique et
coûteux est épargné aux autres. En agissant sur des
altérations moléculaires spécifiques, les thérapies
ciblées constituent ainsi des traitements personna-
lisés. Cette approche innovante est particulièrement
axée sur l’identification de biomarqueurs prédictifs
de la réponse et du suivi aux thérapies ciblées.
Depuis 2001, plusieurs thérapies ciblées ont reçu une
autorisation de mise sur le marché (AMM) restreinte
à un groupe de pathologies présentant des altéra-
tions moléculaires spécifiques, parmi lesquelles : les
cancers du sein avec amplification du gène HER2
dans 15 à 20 % des cas, les cancers du poumon avec
la présence de mutations d’EGFR dans près de 12 %
des cas, et les cancers colorectaux métastatiques
avec la présence de mutations du gène KRAS dans
environ 40 % des cas.
Dans le mélanome, il s’agit de rechercher les muta-
tions des gènes BRAF et de c-KIT chez les patients
atteints d’un mélanome métastatique. En effet,
le mélanome métastatique est une affection de
pronostic redoutable (médiane de survie : 6,2 mois).
La chimiothérapie de référence, la dacarbazine,
permet d’obtenir des taux de réponse de 7,5 %
de courte durée. L’ipilimumab, anticorps mono-
clonal anti-CTLA4, augmente la survie de patients
prétraités de 30 %.
L’avènement des thérapies ciblées dans le méla-
nome en est à ses débuts. Environ 50 % des méla-
nomes métastatiques présentent des mutations
activatrices sur le gène BRAF. La plus fréquente
(74 % des cas) est celle localisée sur le codon 600
(BRAFV600E). Plus de la moitié des patients porteurs
de cette mutation sont répondeurs aux inhibiteurs
de BRAF actuellement évalués dans le cadre d’essais
cliniques (20). L’inhibiteur vémurafénib, dont les
résultats obtenus en phase II sont disponibles et
qui est évalué actuellement en phase III, a obtenu
l’AMM en août 2011. Le génotypage BRAF condi-
tionnera ces traitements. En effet, c’est précisément
cette population de patients qui est identifiée par
génotypage et qui pourra bénéficier d’un traitement
par ces inhibiteurs.
Par ailleurs, un sous-groupe de mélanomes est carac-
térisé par une grande fréquence des mutations et
amplifications de c-KIT (15 %, contre moins de 1 %
pour l’ensemble des mélanomes) [6]. Ce sous-groupe
est représenté par les mélanomes acraux, muqueux
ou les mélanomes de Dubreuilh. La recherche de
ces mutations, centralisée à l’hôpital Saint-Louis
(Paris) dans le cadre d’inclusions dans le programme
hospitalier de recherche clinique (PHRC) “étude du
nilotinib dans les mélanomes porteurs de mutations
de c-KIT”, est également réalisée suite à des données
de réunions de concertation pluridisciplinaire.
En France, ces tests sont réalisés depuis 2009 pour
la prescription de thérapies ciblées au sein des
plates-formes de génétique moléculaire labellisées
et soutenues par l’Institut national du cancer (INCa)
[figure 2].
 6
6
 7
7
 8
8
1
/
8
100%