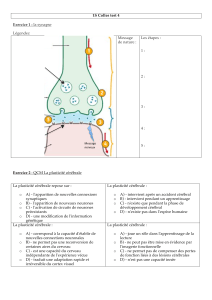
Cliquez-ici pour télécharger le fichier PDF de la publication.

Hémodynamique cérébrale de
l’enfant et particularités cliniques
Bruno Bissonnette
Professor of Anaesthesia, Department of Anaesthesia, Faculty of Medicine, University of
Toronto, Director of Neurosurgical Anaesthesia, Cross-Appointment Intensive Care Medicine,
Department of Anaesthesia, The Hospital for Sick Children, Toronto, Ontario, Canada, M5G
1X8
Introduction
L’analyse de la structure, de la physiologie et du fonctionnement du cerveau humain représente
un des problèmes les plus complexes dans la compréhension des systèmes biologiques. Celui-ci
est considéré comme le centre le plus important de l'organisme, interférant avec la fonction de
tous les autres organes. Les concepts physiologiques et physiopathologiques "classiques"
incluant l’énergétique cérébrale, l'hémodynamique cérébrale, l’effet des modifications
hémodynamiques sur le liquide céphalorachidien et la pression intracrânienne sont importants
pour l’anesthésiste réanimateur. Ces différents facteurs physiologiques doivent être bien compris
par l'anesthésiste car celui-ci peut agir sur ces systèmes de régulation pour mettre le cerveau dans

D Bracco & B. Bissonnette: Physiologie du système nerveux central
2
les meilleures conditions, afin de prévenir les lésions cérébrales secondaires d'origine
systémique, principalement d’origine hémodynamiques.
Débit sanguin et volume cérébral
Le débit sanguin cérébral (DSC) est contrôlé par plusieurs paramètres physiologiques et
pharmacologiques. Le débit sanguin cérébral de l'adulte est de 50 mL•100g • min
-1
. Il est plus
élevé chez l'enfant de 6 mois à 6 ans (90-110 mL•100 • min
-1
) et plus bas chez l’enfant
prématuré et le nourrisson (≈ 35 mL•100g•min
-1
). La perfusion de la substance blanche
représente environ un tiers de celle de la substance grise quelque soit l’âge.[1] Lorsque le DSC
diminue, deux seuils sont observés. Le premier d’environ 25 ml•100g
-
•min
-1
est reconnu comme
le seuil de dysfonction neuronale. L'intégrité neuronale est maintenue, mais les mécanismes
électrochimiques sont atteints. Le second seuil de 10-12 mL•100 g•min
-1
représente celui de la
destruction membranaire rencontrée durant une période d'ischémie ou d'anoxie cérébrale.[1] Le
premier est réversible alors que le deuxième conduit à la mort cellulaire cérébrale, soit par
destruction neuronale (catatlisme cellulaire) soit par apoptose (mort cellulaire programmée).
Les gradients de pression arterio-veineux observés au niveau cérébral sont beaucoup plus
complexes que dans les autres organes parce que le cerveau est contenu dans une boite crânienne
fermée et qu’une partie des vaisseaux ne peuvent, de par leur structure, se collaber. La présence
d'une "boîte" rigide entraîne la production de gradients artério-veineux directement dépendants
des variations de la pression intracrânienne (PIC). En situation physiologique, la PIC est
supérieure à la pression veineuse centrale (PVC) et à la pression atmosphérique. La pression de
perfusion cérébrale (PPC) est égale à la différence entre la pression artérielle moyenne (PAM) et
la PIC ou la PVC (si elle est plus élevée).

D Bracco & B. Bissonnette: Physiologie du système nerveux central
3
La vascularisation cérébrale ne possède pas de récepteurs adrénergiques ou à la vasopressine.
Elle est donc indépendante de ces deux modes de régulation du tonus vasculaire systémique. Ces
agents ont néanmoins leur place en neuroanesthésie car ils permettent de manipuler le tonus
vasculaire systémique afin d'optimiser la perfusion cérébrale.[2] Les mécanismes physiologiques
assurant le maintien de l’hémodynamique vasculaire cérébrale sont [1] : 1) le couplage
métabolique, 2) l'autorégulation et 3) la vasoréactivité au CO
2
.
1) Le couplage métabolique est le contrôle du débit sanguin cérébral global ou régional par
la demande métabolique. En cas d'accroissement de la demande métabolique cérébrale, une
modification immédiate de l’hémodynamique cérébrale se produit par une vasodilatation et une
augmentation du DSC. A l'inverse en cas de diminution de la consommation énergétique
cérébrale (en glucose ou en oxygène) il se produit une diminution du DSC. Du point de vue
clinique cette approche hémodynanique est intéressante : si on administre des médicaments qui
diminuent la consommation cérébrale en oxygène (les agents anesthésiques intraveineux) et que
le couplage métabolique / vasculaire est maintenu, une diminution du DSC et du volume sanguin
cérébral se produit entrainant une baisse de la PIC. A l'inverse, en cas d'augmentation de la
consommation en oxygène (crises convulsives par exemple) la vasodilatation va induire une
augmentation du volume sanguin cérébral et de la PIC. Il est important de rappeler qu’une
modification de la pression partielle artérielle en oxygène n’affectera le DSC qu’en dessous
d’une valeur de 60 mmHg.
2) L'autorégulation est le contrôle du DSC en fonction de la pression de perfusion
cérébrale. Dans une plage de pression de perfusion importante, le DSC est maintenu constant par
adaptation des résistances vasculaires cérébrales. Chez l'adulte normotendu, la plage
d'autorégulation s'étend de 50 à 150 mmHg de PPC. Les seuils et les débits sanguins cérébraux

D Bracco & B. Bissonnette: Physiologie du système nerveux central
4
diffèrent chez l'enfant et le nourrisson. Lorsque la PPC descend au-dessous du seuil critique une
ischémie cérébrale apparaît. Elle touche en premier les zones de transition vasculaire entre la
substance blanche et grise et les noyaux de la base. Lorsque la pression de perfusion augmente
au delà de la limite supérieure de l'autorégulation, la perfusion cérébrale augmente et un œdème
cérébral apparaît. Cet œdème dit vasogénique s'accompagne de thromboses et d'hémorragies
intracérébrales. Chez le nouveau-né et l'enfant, les mécanismes d'adaptation de l'autorégulation
sont rapides et précis.[3] Chez l’enfant prématuré, ces mécanismes sont immatures et ces enfants
supportent moins bien les variations de pression de perfusion. L'autorégulation est altérée ou
abolie par de nombreux mécanismes physiopathologiques ou pharmacologiques. Lors d'états de
détresse sévère [4] en présence d'anoxie ou d'hypoxie systémique [5] l'autorégulation est altérée.
Bien que tous les médicaments anesthésiques halogénés abolissent de façon dose-dépendante
l'autorégulation, leurs effets cérébrovasculaires individuels varient dans l’ordre suivant :
desflurane>halothane>isoflurane>sevoflurane. En situation clinique, comme un traumatisme
crânio-cérébral, l’autorégulation cérébrale résiduelle peut être utilisée pour diminuer la pression
intracrânienne. Lorsque la pression artérielle augmente, la vasoconstriction cérébrale induit une
diminution du volume sanguin cérébral et de la pression intracrânienne. Son utilisation clinique
implique des variations de pression artérielle progressives afin de permettre aux mécanismes
d'autorégulation de fonctionner et des pressions de perfusion maintenues dans les limites de
l'autorégulation.[6,7]
3) La vasoréactivité au CO
2
est le contrôle du débit sanguin cérébral (DSC) par la pression
partielle artérielle en CO
2
. Le CO
2
est un puissant vasodilatateur cérébral. Chez l'adulte il existe
une relation quasi linéaire entre la PaCO
2
et le DSC. Lorsque la PaCO
2
passe de 40 à 80 mmHg
le DSC double et lorsque la PaCO
2
diminue de 40 à 20 mmHg le DSC diminue de 50%. Chez

D Bracco & B. Bissonnette: Physiologie du système nerveux central
5
l'enfant, la relation est curviligne avec un effet vasodilatateur quasi maximal atteint à environ 50
mmHg. La vasoconstriction cérébrale induite par une hyperventilation va induire une diminution
du volume sanguin cérébral et de la PIC. Néanmoins en cas de vasoconstriction excessive la
diminution du DSC peut induire une ischémie cérébrale.[8,9] Le seuil d'ischémie induit par
hyperventilation est peu connu et n'est probablement pas homogène d'un territoire cérébral à
l'autre. Sur la base des données actuelles, il semble sécuritaire d'hyperventiler jusqu'à une PaCO
2
de 30 mmHg, seuil au-dessous duquel la mesure de la saturation jugulaire en oxygène semble
justifiée pour détecter l’apparition d’une ischémie cérébrale (au moins globale). Il est important
de rappeller qu’il existe une adaptation à l'effet du CO
2
sur la vascularisation cérébrale. Par
exemple, l’utilisation soutenue d’une hyperventilation au-delà de 6 heures entraînera un
rétablissement du DSC comme si la PaCO
2
était à la valeur initiale. Après modification de la
PaCO
2
il existe une diminution des H
+
de l'espace extracellulaire. Parce que le bicarbonate
(HCO
3
) extracellulaire a besoin d'au moins 6 heures pour rétablir l'équilibre acido-basique, l'effet
vasculaire du CO
2
sera d'environ six heures. L'importance clinique de cette observation
physiologique est que, si l'hyperventilation est maintenue au-delà de 6-8 heures et qu'à ce point
une normocapnie est rétablie, le pH du liquide interstitiel diminuera et le DSC augmentera de
façon significative, pouvant causer une élévation de la PIC.
Particularités cliniques
Les conséquences physiopathologiques d'une altération de la pression de perfusion
cérébrale peuvent être majeures. Par exemple, chez l’enfant présentant un traumatisme cérébral
et une élevation de la pression intracrânienne, la diminution de la pression de perfusion cérébrale
(<40 mmHg) et/ou de la pression artérielle moyenne (<70 mmHg), est clairement impliquée
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%