Lire l'article complet

DOULEUR
La Lettre du Neurologue - Hors-série - avril 2002
42
L’
imagerie cérébrale, qui permet d’observer la région
sollicitée par l’action en cours grâce à l’analyse
dynamique des modifications de débit par la tomo-
graphie par émission de positons (TEP) ou l’IRM fonction-
nelle (IRMf), a fait faire de grands progrès dans la compré-
hension du rôle du cortex dans la douleur. Depuis dix ans, une
vingtaine d’équipes dans le monde étudient les réponses céré-
brales à la douleur pour tenter de répondre à des questions
insolubles sans ces techniques : existe-t-il des régions céré-
brales spécifiques du traitement de la douleur ? La réponse
dépend-elle de la qualité physique du stimulus douloureux
(piqûre, chaleur, électricité...), du type de nocicepteurs ou
d’organes, ou bien les réponses corticales sont-elles iden-
tiques dans tous ces cas, mais proportionnelles au désagré-
ment ? Peut-on différencier des zones répondant à la nocicep-
tion et à la souffrance ? Peut-on distinguer la douleur de
l’anticipation de la douleur, observer des zones cérébrales
impliquées dans le contrôle antinociceptif ? Peut-on analyser
les mécanismes complexes de la douleur, qui font intervenir
l’attention, l’anticipation et l’affectivité du sujet qui souffre ?
La réponse varie-t-elle chez les sujets qui souffrent de douleur
chronique ? Peut-on voir où agissent les médicaments comme
la morphine ou les techniques comme les stimulations antal-
giques, l’hypnose ou l’effet placebo ?
Les premières études ont analysé une douleur expérimentale
aiguë chez le sujet normal.
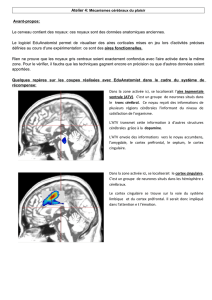
Le réseau cortical qui intègre la douleur repose sur quatre sys-
tèmes aux rôles distincts : la région pariétale (aires SI et SII)
gère les données physiques du stimulus, cette analyse sensori-
discriminative permettant de localiser la stimulation et de la
qualifier afin de préparer la réponse la plus adaptée ; les
régions motrices ou de préparation au mouvement sont acti-
vées dès que l’on franchit un certain stade de douleur, non seu-
lement au niveau cortical dans la somatotopie correspondant
au territoire stimulé, mais aussi au niveau sous-cortical,
comme le noyau caudé ou le cervelet. Les régions fronto-
cingulaires sont impliquées dans les réponses attentionnelles et
anticipatoires indispensables à la réaction de retrait ou de fuite,
de même que dans les réponses émotionnelles de souffrance.
Des travaux en IRMf permettent de préciser, au sein du cortex
cingulaire antérieur, une véritable somatotopie fonctionnelle
différenciant l’attention à la douleur, l’anticipation, la discri-
mination sensitive, la réponse au caractère désagréable, la
réponse motrice et les phénomènes cognitifs liés à la douleur
aiguë. Face à une stimulation douloureuse donnée, la réponse
cingulaire est en effet modulée par des paramètres autres que
les caractéristiques physiques du stimulus : l’hypnose, qui atté-
nue ou fait disparaître la réponse cingulaire, la suggestion, qui
la renforce, alors que les réponses pariétales restent inchan-
gées ; la chronicité d’une douleur antécédente... Si l’on fait
varier le niveau d’attention à la douleur, les modifications
attentionnelles augmentent les réponses douloureuses
constantes insulaires, thalamiques et cingulaires, mais égale-
ment les zones classiques du réseau attentionnel, en particulier
pariétal et frontal. Il est vraisemblable que l’attention au sti-
mulus douloureux entraîne de façon anticipatoire une synchro-
nisation des neurones qui vont être sollicités dans les zones
nociceptives spécifiques, par exemple de l’insula ou du cortex
cingulaire. On voit donc que la région cingulaire est un carre-
four extrêmement complexe d’intégration sensorielle, motrice,
émotionnelle et cognitive, mais avec des réseaux indépendants.
On conçoit qu’il s’agisse d’une région candidate aux régula-
tions descendantes inhibitrices de la douleur. Les régions
amygdalienne et hippocampiques semblent avoir un rôle capi-
tal dans le conditionnement douloureux, l’enregistrement
contextuel d’une douleur et dans les cascades émotionnelles,
en particulier végétatives. Toute l’émotion “primaire” automa-
tique à médiation endocrinienne et végétative retentit sur les
perceptions élaborées, et il se crée au niveau amygdalien des
conditionnements qui pourraient s’avérer déterminants dans
l’analyse de certaines douleurs chroniques mal comprises et
parfois abusivement appelées psychogéniques.
Apports de l’imagerie
● B. Laurent, R. Peyron*
* Centre anti-douleur, service de neurologie, hôpital de Bellevue, Saint-
Étienne.

La Lettre du Neurologue - Hors-série - avril 2002 43
L’imagerie cérébrale ne permet que rarement de visualiser les
systèmes de contrôle descendants issus du tronc cérébral (sub-
stance grise péri-aqueducale). Cette activation peut apparaître
dans des douleurs soutenues, avec parfois un décalage temporel
et un post-effet. On l’observe également nettement lors du post-
effet des stimulations corticales rolandiques à visée antalgique
dans les douleurs centrales. Une autre approche consiste à visua-
liser les récepteurs opiacés endogènes par des ligands spéci-
fiques et dans différentes situations de douleur et de repos. Cela
a été fait grâce au PET scan chez le sujet normal, avec la 11C-
dynorphine marquée pour les récepteurs opiacés et avec le dex-
trométorphan pour les récepteurs NMDA. Toutes les régions où
s’intègre la douleur “diffuse” sont riches en récepteurs opiacés :
thalamus, régions cingulaires et tronc cérébral. En revanche, ces
récepteurs sont absents au niveau pariétal, lieu de l’analyse phy-
sique du stimulus. Ces recherches en sont à leur début dans des
situations de douleurs chroniques ou de pharmacologie. Une
étude récente de Zubieta et al. (2001) montre qu’une douleur
soutenue chez le sujet normal s’accompagne d’une occupation
des récepteurs mu de toutes les zones intégrant la douleur aux
niveaux thalamique et cortical.
On peut aussi visualiser les aires qui s’activent de façon
contemporaine à des analgésies pharmacologiques ou lors de
stimulations centrales : le bloc anesthésique dans les douleurs
neuropathiques, la cordotomie dans les douleurs cancéreuses par
excès de nociception ou la stimulation du cortex moteur dans les
douleurs centrales par lésion thalamique ou corticale.
Deux faits se dégagent : les procédures antalgiques activent des
zones identiques à celles qui s’activent lors de la stimulation
douloureuse du sujet normal (gyrus cingulaire, insula...) ; le
gyrus cingulaire antérieur et moyen est constamment activé,
quel que soit le type des thérapeutiques antalgiques utilisées,
laissant penser qu’il s’agit d’un intermédiaire obligé pour toute
analgésie. Évidemment, les plus grands progrès sont attendus de
l’utilisation de ligands spécifiques, et éventuellement de médi-
caments marqués que l’on peut suivre en TEP. Il a ainsi été mis
en évidence une diminution de la fixation de diprénorphine dans
le thalamus et le gyrus cingulaire antérieur lors des poussées de
polyarthrite rhumatoïde comparativement à l’état de rémission,
à cause d’une occupation des sites récepteurs par des molécules
opiacées endogènes. Enfin, des corrélations ont été établies
entre l’analgésie à la morphine et l’augmentation du DSC dans
le cortex préfrontal et le gyrus cingulaire antérieur, l’insula et le
cortex temporal.
Les techniques de type TEP en FDG peuvent être appliquées à
l’étude de la pathologie, en particulier à l’étude des douleurs
chroniques : algie vasculaire de la face, douleurs faciales aty-
piques, arthrite rhumatoïde, angine de poitrine, douleurs den-
taires, avec des zones d’hyperdébit qui voisinent avec des zones
d’hypodébit dont la signification est encore objet de débat. Par
exemple, nous avons observé une diminution de débit cingu-
laire de repos dans les Wallenberg avec allodynie qui pose la
question d’une dérégulation des systèmes inhibiteurs cingu-
laires à l’état basal. Le “paradoxe” des douleurs neuropathiques
est celui d’un thalamus associant une hyperactivité électrophy-
siologique et un hypométabolisme de repos. Nous avons com-
paré l’activité cérébrale produite par l’allodynie sur l’hémi-
corps malade et par une douleur électrique sur l’hémicorps
sain : l’allodynie déclenche une réponse excessive du thalamus
et des aires pariétales sans aucune réponse cingulaire, qui est
une zone indispensable pour le contrôle antalgique. Cette
réponse thalamique excessive et anormale du côté de la lésion
spino-thalamique pourrait avoir un rôle amplificateur de
réponses corticales impliquant le système “latéral” de la dou-
leur (cortex pariétal et insulaire/SII). Chez ces patients, l’ab-
sence d’augmentation du DSC dans le gyrus cingulaire anté-
rieur traduirait un découplage entre l’hyperactivité du système
“latéral” et la mise au repos du système “médian”, profil qui
pourrait être spécifique de la situation allodynique.
Des champs entiers restent à explorer, mais, d’ores et déjà, ces
études ruinent l’idée naïve d’un traitement de la douleur méca-
nique et stéréotypé, à la façon d’un cablage électrique répondant
en fonction du voltage. La douleur est, comme toute stimulation
sensorielle, soumise aux influences de l’attention, de l’anticipa-
tion, de l’imagerie mentale, de conditionnements antérieurs...
De plus, on découvre que les zones fronto-cingulaires activées
par les médicaments antalgiques comme la morphine, par
exemple, ou par des stimulations antalgiques du cortex comme
la stimulation corticale sont les mêmes que celles sollicitées lors
d’interventions non médicamenteuses comme l’hypnose. Ainsi
se trouve encore réduite la dichotomie entre les approches ana-
tomo-biologique et psychologique de la douleur. ■
1
/
2
100%