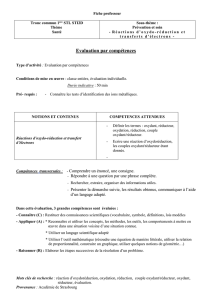
Antiseptiques, Désinfectants & Oxydoréduction - Cours de Chimie

Chapitre 9
Antiseptiques et désinfectants
Réactions d’oxydoréduction
Programme
Santé : prévention et soin
NOTIONS ET CONTENUS CAPACITÉS EXIGIBLES
Antiseptiques et désinfectants • Citer les principaux antiseptiques et désinfectants
usuels et montrer expérimentalement le caractère
oxydant d’un antiseptique.
Activité documentaire n° 1
Exercices : 11, 20, 21
Réactions d’oxydoréduction
et transferts d’électrons
• Dénir les termes suivants : oxydant, réducteur,
oxydation, réduction, couple oxydant/réducteur.
Ecrire une réaction d’oxydoréduction, les couples
oxydant/réducteur étant donnés
Activité expérimentale n° 2
Comment résoudre un exercice
Exercices : 12, 13, 14, 15, 18, 19, 22, 23, 24, 25
Concentrations massique et molaire • Préparer une solution d’antiseptique de
concentration molaire donnée par dissolution ou
dilution.
Réaliser un TP : liquide de Dakin
Réaliser un TP : dosage Bétadine
Exercices : 16, 17
• Doser par comparaison une solution d’antiseptique.
Réaliser un TP : dosage Bétadine
Découvrir
Activité documentaire n° 1
Bétadine et eau de Javel au cœur de l’hôpital…
• Objectifs :
– présenter un antiseptique et un désinfectant couramment utilisés ;
– mettre en évidence leurs traits communs et leurs différences.
• Exploiter :
1. Le sufxe « cide » signie « tuer » (comme dans régicide, meurtre du roi, parricide, meurtre du
père, génocide, meurtre d’une race, etc.)
2. Un degré chlorométrique correspond à 3,17 g · L–1 de chlore actif. Une solution d’eau de Javel de
12 degrés chlorométriques diluée au 1/10e possède un degré chlorométrique de 1,2, soit 3,8 g · L–1
de concentration de chlore actif.
3. L’action des antiseptiques est inhibée par les matières organiques. Il faut bien nettoyer la
plaie avant d’utiliser l’antiseptique pour que son action soit la plus efcace possible sur les tissus
infectés.
52
© NATHAN - La photocopie non autorisée est un déli t.

53
© NATHAN - La photocopie non autorisée est un délit.
Activité expérimentale n° 2
Comment réagit le zinc dans une solution de sulfate de cuivre ?
• Objectifs :
– observer une réaction d’oxydoréduction avec échanges électroniques entre deux métaux ;
– identier l’oxydant et le réducteur de cette réaction.
• Exploiter :
1. À la n de la réaction, la solution est quasiment incolore, les ions cuivre Cu2+ ont disparu de
la solution.
2. À la n de la réaction, le métal présent au fond du bécher a une coloration rougeâtre et non
grise. Le zinc a donc disparu du milieu réactionnel.
3. Le métal rougeâtre obtenu en n de réaction est du cuivre.
4. Cu2+(aq) devient Cu (s)
Zn (s) devient Zn2+(aq).
5. Cu2+(aq) a gagné 2 électrons
Zn (s) a perdu 2 électrons.
Réaliser un TP
Réalisation d’une solution de liqueur de Dakin
• Objectifs :
– réaliser une solution d’antiseptique ;
– réaliser une solution par dissolution d’un solide (permanganate de potassium) et par dilution
d’une solution existante (eau de Javel) ;
– manipuler les notions de concentrations massique et molaire.
• Exploiter :
1. On a introduit 1 mg de permanganate dans un volume total de 100 mL. La concentration mas-
sique en permanganate est donc cm = 0,01 g · L–1.
2. La masse molaire du permanganate de potassium est :
M = M(K) + M(Mn) + 4 × M(O) = 158,0 g · mol–1.
3. On a donc introduit n = m
M = 0,001
158 = 6,3 · 10–6 mol de permanganate de potassium. La concen-
tration molaire en ions MnO4
– de la solution obtenue est donc :
c = n
V = 6,3 · 10–6
100 · 10–8 = 6,3 · 10–5 mol · L–3.
4. On a introduit 13,2 mL de solution d’eau de Javel à 38 g · L–1 de chlore actif dans un volume
total de 100 mL. La concentration en ions hypochlorite de la solution obtenue est donc :
cm = 38 × 13,2
100 = 5,0 g · L–1.
5. On a réalisé exactement les concentrations usuelles du liquide de Dakin.
Dosage du diiode contenu dans la Bétadine
• Objectifs :
– réaliser une échelle de teinte par dilutions successives ;
– effectuer un dosage par comparaison grâce à une échelle de teinte ;
– comparer la concentration obtenue aux indications du acon.
• Exploiter :
1. Pour la solution « mère », on a dilué 1 g de diiode dans 100 mL d’iodure de potassium, ce qui
nous donne une concentration massique de diiode égale à cm, mère = m
V = 1
100 · 10–8 = 10 g · L–1.
Chapitre 9 - Antiseptiques et désinfectants. Réactions d’oxydoréduction

54
© NATHAN - La photocopie non autorisée est un délit.
La première solution « lle 1 » correspond à un facteur de dilution dlle1 = 50
100 = 0,5. La concen-
tration de la solution « lle 1 » est donc cm, lle1 = cm, mère × dlle1 = 5 g · L–1.
La solution « lle 2 » correspond à un facteur de dilution dlle2 = 20
100 = 0,2 soit une concentration
cm, lle2 = cm, mère × dlle2 = 2 g · L–1.
La solution « lle 3 » correspond à un facteur de dilution dlle3 = 10
100 = 0,1 soit une concentration
cm, lle3 = cm, mère × dlle3 = 1 g · L–1.
2. Selon le acon utilisé, les concentrations peuvent varier. Si le tube à essai contenant la vraie
bétadine diluée est trop foncé par rapport à l’échelle de teinte, diluer encore au 1/10e pour pouvoir
faire la comparaison, jusqu’à tomber dans l’échelle de teinte.
3. L’indication du acon est en concentration de diiode libre (exprimée en pourcentage), ou en
concentration en PVPI (Polyvinylpyrrolidone iodée) ce qui peut rendre délicate son interprétation.
On peut au mieux se contenter d’une comparaison qualitative. La forme sous laquelle se trouve le
diiode dans la bétadine n’est pas la même que dans l’échelle de teinte réalisée (ou le diiode est en
fait complexé par les ions I– de l’iodure de potassium pour forme l’ion I3
– coloré).
S’entraîner
Testez vos connaissances
1. a) et b) ; 2. a) et b) et c) ; 3. c) ; 4. a) ; 5. b) et c) ; 6. c) ; 7. a) ; 8. b) ; 9. a) ; 10. c)
Applications directes du cours
11 Dégagements gazeux
1. 1 L 2. 1,5 L 3. 38 g · L–1 4. 152 g · L–1
12 Marions-les
Cu2+(aq)/Cu(s) ; I2(aq)/I–(aq) ; ClO–(aq)/Cl2(g) ; Fe3+(aq)/Fe2+(aq) ; Ag+(aq)/Ag(s) ; H+(aq)/H2(g).
13 Histoires de couples
1. Hg2+(aq)/Hg2
2+(aq).
2. Fe3+(aq)/Fe2+(aq).
3. Fe2+(aq)/Fe(s).
4. Br2(g)/Br–(aq).
14 Identification
1. Cu2+(aq)/Cu(s) et Zn2+(aq)/Zn(s).
2. Fe3+(aq)/Fe2+(aq) et MnO4
–(aq)/Mn2+(aq).
3. I2(aq)/I–(aq) et Al3+(aq)/Al(s).
4. ClO–(aq)/Cl2(g) et Cl2(g)/Cl–(aq).
15 Équilibriste
1. MnO4
–(aq) + 8 H+ + 5 e– Mn2+(aq) + 4 H2O.
2. 2 S2O3
2– S4O6
2– + 2 e–.
3. L’ion tétrathionate S4O6
2– est l’oxydant et l’ion thiosulfate S2O3
2– est le réducteur.
4. Fe2+(aq) + 2 e– Fe(s) ; Fe3+(aq) + 1 e– Fe2+(aq).
Bilan Fe(s) + 2 Fe3+(aq) 3 Fe2+(aq). L’ion Fer III Fe3+(aq) est l’oxydant, tandis que le fer solide
Fe(s) est le réducteur.

55
© NATHAN - La photocopie non autorisée est un délit.
16 Concentrons-nous
1. M(I2) = 2M(I) = 253,8 g · mol–1 ; cm = c × M = 0,254 g · L–1.
2. m0 = cmV = 2,54 · 10–2 g = 25,4 mg.
3. M(KMnO4) = M(K) + M(Mn) + 4M(O) = 158 g · mol–1 ; cm = 0,158 g · L–1 ; m0 = 15,8 mg.
17 Mère et fille
1. Non.
2. Prélever 10 mL de solution mère et l’introduire dans la ole jaugée de 100 mL, puis compléter
jusqu’au trait de jauge avec de l’eau distillée.
3. Réaliser deux dilutions successives au 1/10.
18 Meccano
Fe2+(aq) + 2 e– Fe(s) ; Ni2+(aq) + 2 e– Ni(s) ; Ni2+(aq) + Fe(s) Fe2+(aq) + Ni(s).
19 Moi aussi, je veux ressembler à un gaz noble
1. Les alcalins ont un électron de valence à céder, ils vont former des ions chargés une fois posi-
tivement : Li+, Na+, K+. Les métaux alcalins Li, Na, K, … sont des réducteurs.
2. Les alcalino-terreux ont deux électrons de valence à céder, ils vont former des ions chargés
deux fois positivement : Be2+, Mg2+, Ca2+. Ces éléments chimiques Be, Mg, Ca sont également des
métaux, et ils sont également réducteurs.
3. Les halogènes n’ont qu’un électron à capter pour avoir la structure électronique du gaz noble
suivant, ils vont former des ions chargés une fois négativement : F–, Cl–, Br–. Les halogènes F, Cl,
Br sont des oxydants.
Exercices d’entraînement
20 Ménage dangereux
1. 2 ClO–(aq) + 4 H+(aq) + 2 e– Cl2(g) + 4 H2O.
2. Cl2 (g) + 2 e– 2 Cl–(aq).
3. 2 ClO–(aq) + 2 Cl–(aq) + 4 H+(aq) 2 Cl2(g) + 4 H2O.
4. On observe un dégagement de dichlore gazeux, ce qui présente un risque sanitaire.
21 Eau oxygénée : dismutation
1. Les deux : il est oxydant dans le couple H2O2(aq)/H2O et réducteur dans le couple O2(aq)/H2O2(aq).
2. H2O2(aq) + 2H+(aq) + 2 e– 2H2O et O2(g) + 2H+(aq) + 2 e– H2O2(aq).
3. 2H2O2(aq) 2H2O + O2(g). La dismutation de l’eau oxygénée s’accompagne d’un dégage-
ment gazeux de dioxygène.
22 Eau : on ne dismute pas !
1. H2O + 2H+(aq) + 2 e– H2(g) + H2O ou encore, plus simplement 2H+(aq) + 2 e– H2(g)
O2(g) + 4H+(aq) + 4 e– 2H2O.
2. H2O est oxydant dans le couple H2O/H2(g), et réducteur dans le couple O2(g)/H2O.
3. 4H2O 2H2(g) + 2H2O + O2(g) ou une fois simpliée 2H2O 2H2(g) + O2(g).
23 Pile bouton au mercure
1. 2Hg2+(aq) + 2 e– Hg2
2+(aq).
2. O2(g) + 4H+(aq) + 4 e– 2H2O, O2(g) joue le rôle d’un oxydant.
3. Le dioxygène va réagir avec le réducteur du couple du mercure, c’est-à-dire les ions mercureux
Hg2
2+(aq), selon la réaction 4H+(aq) + 2Hg2
2+(aq) + O2(g) 2H2O + 4Hg2+(aq).
Chapitre 9 - Antiseptiques et désinfectants. Réactions d’oxydoréduction

56
© NATHAN - La photocopie non autorisée est un délit.
4. La solution d’ions mercureux n’est donc pas stable en présence de dioxygène dissous dans l’eau.
En revanche, les ions mercuriques Hg2+(aq) étant des oxydants, ils ne peuvent pas réagir avec
l’oxydant O2(g). Une solution d’ions mercuriques est stable.
5. Zn2+(aq) est un oxydant, il ne réagit pas avec l’oxydant O2(g).
24 Attaque acide sur les métaux
1. Zn2+(aq) + 2 e– Zn(s) et 2H+(aq) + 2 e– H2(g).
2. Zn(s) + 2H+(aq) Zn2+(aq) + H2(g).
3. Le dégagement gazeux est un dégagement de dihydrogène H2(g). On peut le caractériser en
approchant une allumette allumée, car il éteint la amme.
25 It’s in English
Énoncé
1. Identier l’oxydant dans chacune des demi-équations suivantes :
a. Cr2O7
2– + 14 H+ + 6 e– 2 Cr3+ + 7 H2O
b. 2 I– I2 + 2 e–
c. 2 ClO– + 4 H+ + 2 e– Cl2 + 4 H2O
d. 2S2O3
2– S4O6
2– + 2 e–
2. Dans les réactions d’oxydoréduction suivantes, identier les deux couples oxydant/réducteur
mis en jeu :
a. Ni2+ + Fe Ni + Fe2+
b. 2 Cu+ Cu2+ + Cu
c. H2O2 + 2 H+ + Zn Zn2+ + 2H2O
3. Équilibrer les demi-équations en plaçant le nombre correct d’électrons du côté droit ou gauche
de l’équation :
a. Cl2 + … 2Cl– + …
b. Al3+ + … Al + …
c. H2O2 + 2H+ + … 2H2O+
Réponses
1. L’oxydant est du côté des électrons : Cr2O7
2– ; I2 ; ClO– ; S4O6
2–.
2. Couples Ni2+/Ni et Fe2+/Fe ;
Couples Cu+/Cu et Cu2+/Cu+ ;
Couples H2O2/H2O et Zn2+/Zn.
3. Cl2 + 2 e– 2 Cl– ;
Al3+ + 3 e– Al ;
H2O2 + 2 H+ + 2 e– 2 H2O.
1
/
5
100%