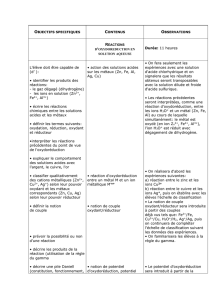
Transformations lentes et transformations rapides I) Rappels d

1/3
Transformations lentes et transformations rapides
I) Rappels d’oxydoréduction.
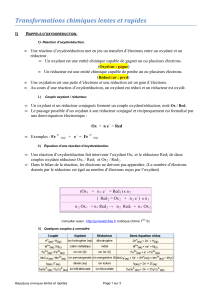
1) Réaction d’oxydoréduction.
Une réaction d’oxydoréduction met en jeu un transfert d’électrons entre un oxydant et un réducteur.
Un oxydant est une entité chimique capable de gagner un ou plusieurs électrons. (Oxydant : gagne)
Un réducteur est une entité chimique capable de perdre un ou plusieurs électrons. (Réducteur : perd)
Une oxydation est une perte d’électrons et une réduction est un gain d’électrons.
Au cours d’une réaction d’oxydoréduction, un oxydant est réduit et un réducteur est oxydé.
Pour le couple Ox/Red : Red = Ox + ne- ou Ox + ne- = Red
2) Équation d’une réaction d’oxydoréduction.
Une réaction d’oxydoréduction fait intervenir l’oxydant Ox1 et le réducteur Red2 de deux couples
oxydant réducteur Ox1 / Red1 et Ox2 / Red2.
II) Transformations rapides et lentes.
Chaque système chimique évolue à une certaine vitesse, l’étude de l’évolution temporelle de systèmes
chimiques constitue la cinétique chimique.
On peut distinguer trois catégories de transformations chimiques :
Les transformations quasi instantanées. On dit que la réaction est rapide. Sa durée est inférieure à la
seconde. On ne peut pas observer l’évolution de la réaction à l’œil. C’est le cas de certaines réactions
de précipitation ou celle utilisée pour faire un dosage.
Les transformations lentes. Une réaction est lente si sa durée est de l'ordre de quelques secondes à
plusieurs minutes. On peut observer l'évolution de la réaction.
Les transformations extrêmement lentes ou infiniment lentes. Une réaction est infiniment lente si
sa durée est de l'ordre de plusieurs jours à plusieurs semaines. On ne peut pas observer l’évolution de
la réaction à l’œil.
III) Mise en évidence expérimentale d’une transformation rapide.
1) Réaction entre les ions permanganate et les ions fer (II) en solution aqueuse acidifiée.
On verse une solution aqueuse de permanganate de potassium dans un bécher contenant une solution
aqueuse acidifiée de sulfate de fer II.
Observations : il se produit une décoloration immédiate de la solution de permanganate de potassium.
En présence des ions fer II en solution aqueuse, ions permanganate disparaissent. Il se produit une
réaction d’oxydoréduction entre les couples rédox suivants :
Ecrire la demi-équation associée à chaque couple et écrire l’équation de la réaction.
Couple :
Couple :
Equation de la réaction :
réduction
oxydation

2/3
2) Réaction de précipitation.
Formation d’un précipité d’hydroxyde de fer III.
On verse quelques gouttes de soude dans une solution aqueuse de chlorure de fer III.
Il se forme un précipité jaune orangé d’hydroxyde de fer III. La formation du précipité est immédiate.
C’est une réaction rapide.
Équation de la réaction :
IV) Mise en évidence expérimentale de transformations lentes.
1) Oxydation des ions iodure par de peroxyde d’hydrogène en milieu acide. Voir TP
a) Expérience :
A l’instant t = 0 s, on verse dans un erlenmeyer.
un volume V3 = 100 mL d’une solution d’iodure de potassium de concentration C3 = 0,20 mol.L-1
un volume V1 = 100 mL d’une solution d’eau oxygénée de concentration C1 = 5,6 x 10-2 mol.L-1
On ajoute quelques gouttes d’acide sulfurique concentré.
Le peroxyde d’oxygène est de l’eau oxygénée, c’est l’oxydant du couple :
Au cours du temps, la solution contenue dans le bécher prend une teinte brun orangé de plus en plus
intense. Le changement de teinte est dû à la formation de diiode en milieu aqueux.
b) Interprétation.
Il se produit une réaction d’oxydoréduction entre les ions iodure et l’eau oxygénée en milieu acide.
Cette transformation est lente par rapport à l’échelle humaine.
Écrire l’équation de la réaction chimique.
2) Dismutation de l’ion thiosulfate en milieu acide. (voir activité : dismutation de l’ion thiosulfate)
La réaction de dismutation de l’ion thiosulfate en milieu acide est une transformation lente.
V) Les facteurs cinétiques.
1) Influence de la concentration des réactifs.
a) Dismutation de l’ion thiosulfate en milieu acide.
La vitesse de formation du soufre augmente avec la concentration des réactifs. On dit que la
concentration des réactifs est un facteur cinétique.
L’avancement temporel d’une réaction augmente généralement avec la concentration des réactifs.
2) Influence de la température.
a) Expérience : oxydation des ions iodure par l’eau oxygénée.
On observe l’évolution de la coloration de la solution au cours du temps à différentes températures.
b) Conclusion.
La température d’un mélange réactionnel est un facteur cinétique. En effet le mélange réagit plus
rapidement si la température est plus élevée.

3/3
VI) Applications.
1) La trempe.
Elle désigne le refroidissement brutal d’un milieu réactionnel pour le rendre cinétiquement inerte.
On utilise ce procédé lors de dosages en séances de travaux pratiques pour arrêter la réaction à un
instant donné t.
2) Conservations des aliments.
Pour ralentir les réactions indésirables, on place les aliments au réfrigérateur ou au congélateur.
3) Accélération des réactions.
Pour accélérer la cuisson des aliments, on utilise des autocuiseurs. En augmentant la température, on
diminue le temps de cuisson des aliments.
4) Interprétation microscopique des facteurs cinétiques.
Les facteurs cinétiques sont : la concentration des réactifs et la température.
Etudions une réaction chimique entre les espèces A et B, il se forme les espèces chimiques C et D.
Au cours de la réaction chimique des liaisons chimiques ont été rompues et de nouvelles liaisons
chimiques se sont formées.
Pour que la réaction chimique ait lieu entre les espèces chimiques A et B, il faut deux conditions :
Il faut que les deux espèces chimiques A et B se rencontrent,
Il faut que le choc entre les deux espèces chimiques soit efficace. (vitesse suffisante)
En conséquence, plus la concentration des réactifs et grandes, plus la probabilité de rencontre est
grande et plus la transformation est rapide.
D’autre part, plus la température est élevée et plus l’énergie cinétique des espèces chimiques sera
importante et plus le choc est efficace.
1
/
3
100%